不同预处理方法对木薯渣水解效果的影响
王寒,韩刚,于晓艳,吕学斌* ,张书廷
1.天津大学环境科学与工程学院,天津 300072
2.天津大学化工学院,天津 300072
木薯渣是木薯淀粉加工过程中的废弃物,其干基主要成分为淀粉、粗纤维、少量蛋白质、脂肪及灰分等,含淀粉量平均达40%以上[1-2]。据估计我国木薯渣的年产量约为30万t[3],如不加处理直接丢弃既造成浪费又占用土地,而且木薯渣在贮存过程中易酸化,产生的腐败气味会污染周边环境[4],因此木薯渣的处理和利用是木薯淀粉厂亟需解决的问题。目前木薯渣主要用作动物饲料,但动物对木薯渣本身的营养消化吸收率极低,造成其生长缓慢。国内很多淀粉企业尝试用木薯渣发酵生产酒精,但发酵效率低,成本高。此外也有人用其生产单细胞蛋白、柠檬酸、建材以及与木薯杆混合共同培养黑木耳和食用菌等[5-11]。但在对木薯渣的诸多资源化利用途径中,最具有市场前景、符合当今社会需求的是厌氧发酵制取生物质能源[4,12-13]。
由于木薯渣中淀粉的颗粒结构以及其结晶组织、木质素和纤维素的包裹作用对生物降解具有一定的抑制作用,将其投入厌氧反应器直接进行水解酸化会极大降低发酵效率,增加运行能耗[12]。因此如果对木薯渣进行预处理,将固相中微生物可利用的有机质转移到液相中,使半纤维素、纤维素水解为低聚糖或单糖,不仅可以增强淀粉溶解性和流动性,降低黏性,而且可在一定程度上提高生物的降解效率。目前最常用的预处理法是硫酸处理法[14],但水解液中含有的大量SO42-,经硫酸盐还原菌作用会转化成 H2S,对后续产甲烷过程具有抑制作用。HNO3作为一种强氧化性酸因价格较高研究的较少,用HNO3水解木薯渣时,脱除NO3-产生的N2不会污染环境,因此对于后续产甲烷工艺不存在上述问题。
笔者分别采用高温水热、稀HNO3高温催化法对木薯渣进行预处理,探索不同的预处理方法对木薯渣水解液可生化性,BOD5,TCODCr,糖分以及木薯渣固体损失的影响,以期为提高实际工程应用提供理论依据和借鉴意义。
1 材料、装置与方法
1.1 材料
木薯渣由广西必佳微生物工程有限公司提供。其含水率为71.7%,含纤维素6.9%,半纤维素1.9%,淀粉14.2%及其他物质5.3%,TCODCr(以干渣计)为940 mg/g。
1.2 装置
高温反应器为磁力搅拌反应釜〔PCF02(05)-10/TA2〕,设计压力12 MPa,设计温度320℃,搅拌速度0~1000 r/min。
1.3 方法
1.3.1 高温水热法
蒸馏水与木薯渣按液固比14∶1,分别在150和180 ℃下水解5,10,20,30 和45 min。
1.3.2 稀HNO3高温催化法
采用浓度为0.2%的HNO3与木薯渣按液固比14∶1,分别在150和180℃下水解5和10 min。
1.4 分析项目
生物质中半纤维素、纤维素的测定采用美国可再生能源实验室(NREL)的分析方法[15];淀粉的测定参照文献[16];单糖的测定采用高效液相色谱法(HPLC,Lab Alliance),色谱柱为 BioRad Aminex HPX-87H(300 mm ×7.8 mm),RI示差检测器,色谱条件:柱温65℃,流动相为5 mmol/L H2SO4溶液,流速为0.6 mL/min,进样量为20 μL;同时测定水解液中的 CODCr,BOD5以及木薯渣的干固体损失。
2 结果与分析
2.1 高温水热水解的效果
由于木薯渣中含有大量易水解的木薯淀粉,因此首先考虑采用高温水对木薯渣进行水解。图1为150和180℃水解条件下木薯渣水解液CODCr随时间的变化。由图1可见,150和180℃时水解液的CODCr均随水解时间的延长呈上升趋势,150℃水解45 min时水解液的CODCr达11093 mg/L,这时木薯渣中约76%的有机物发生水解;而180℃水解45 min时水解液的CODCr高达13121 mg/L,这时木薯渣中约85%的有机物发生水解。180℃时木薯渣的水解效果优于150℃,且水解液CODCr均比150℃的高1888 mg/L以上;说明温度越高,越有利于木薯渣的水解。

图1 高温条件下水解液CODCr随水解时间的变化Fig.1 CODCrchanges of hydrolysate with hydrolysis time
但高温条件下水解液中的木糖和葡萄糖会发生降解生成糠醛和5-羟甲基糠醛等副产物,而这些副产物在后续的厌氧发酵过程中不易被微生物所利用[17]。笔者通过测定水解液的BOD5/CODCr(B/C)来评价其可生化性的情况。其中水解液的BOD5如表1所示。
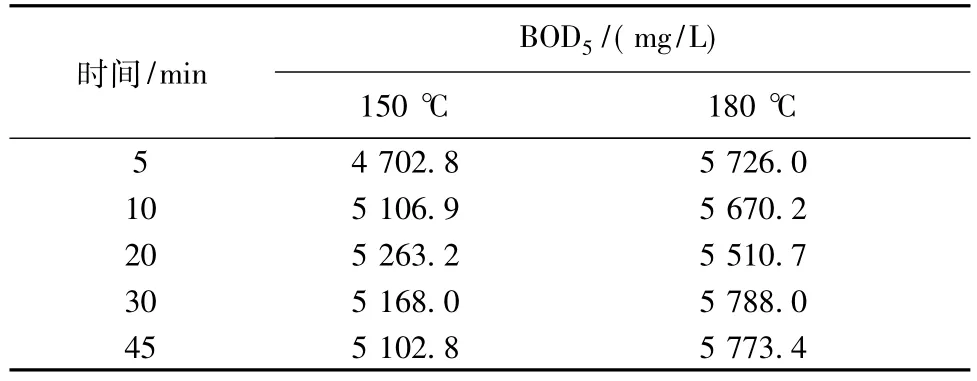
表1 木薯渣高温水热水解液的BOD5Table 1 BOD5of hydrolysate obtained from cassava starch dregs pretreated by hot water at higher temperature
图2为木薯渣水解液B/C随水解时间的变化。由图2可见,150℃时水解液的B/C随时间呈先上升后下降的趋势,当水解10 min时B/C达到最大值0.53。这可能因为水解初始阶段淀粉、纤维素及半纤维素的水解占主导地位,其单糖的水解生成速率大于其降解速率,表现为前期B/C升高,但随着水解时间的延长,其单糖的降解逐渐占主导地位,单糖降解速率逐渐大于其水解生成速率,表现为B/C后期下降。然而180℃时水解液的B/C随水解时间呈逐渐下降的趋势,45 min时其降低到0.44,这是因为温度较高时水解液单糖的降解速率远大于其生成速率。因此,温度的升高或水解时间的增加易造成水解液的可生化性降低。
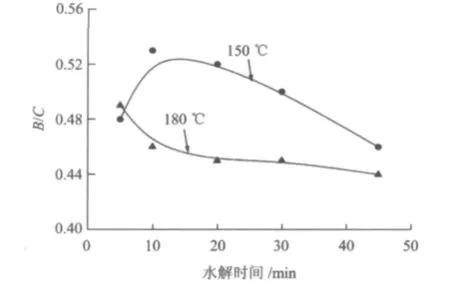
图2 水解液可生化性随水解时间的变化Fig.2 Changes of the biodegradability of hydrolysate with time
木薯渣的淀粉、纤维素以及半纤维素在高温水热水解时分别会水解成葡萄糖、木糖以及阿拉伯糖,因而分析水解液中的糖组分是非常必要的。图3为木薯渣水解液的葡萄糖、木糖以及阿拉伯糖浓度随时间的变化。由图3可见,葡萄糖是构成水解液中总糖的主要成分,占总糖的90%以上。150℃时水解液的葡萄糖随水解时间呈上升趋势,而木糖和阿拉伯糖浓度随时间变化不明显;180℃时除木糖浓度稍微增加外,葡萄糖和阿拉伯糖浓度随水解时间的延长都在降低。这表明升高温度或延长水解时间时,水解液中的葡萄糖和阿拉伯糖都发生降解。150℃时水解液葡萄糖浓度的变化与其CODCr的变化规律一致,说明水解液的CODCr大部分来自于其中的葡萄糖;而180℃时水解液葡萄糖浓度的变化与B/C的变化趋势相似,表明水解液可生化性的降低主要归因于葡萄糖的降解。
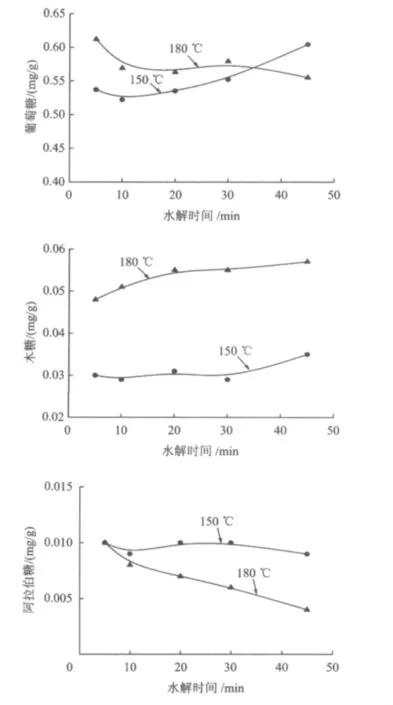
图3 水解液中单糖浓度随时间的变化(以干渣计)Fig.3 Change of monosaccharides concentrations in hydrolysate with time(Total dry residue)
木薯渣中的淀粉、半纤维素、纤维素等在水解过程中会从固相逐渐转移到液相形成溶解性的低聚糖和单糖,所以木薯渣必然存在固体损失,而固体损失的多少也可间接地反映木薯渣水解效果的好坏。图4为木薯渣固体损失与水解液CODCr的关系。由图4可见,木薯渣的固体损失与水解液中的CODCr呈线性正相关,且每减少1 g干渣可产生1.05 g的CODCr。
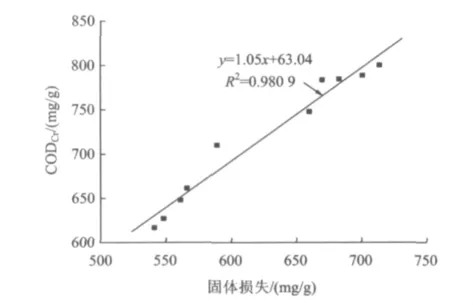
图4 水解液CODCr与固体损失对应关系(以干渣计)Fig.4 The relationship between CODCrof hydrolyzate and solids loss(Total dry residue)
2.2 稀HNO3高温水解的效果
为提高木薯渣的水解效果,降低加热能耗,采用稀HNO3为催化剂以实现短时间内对木薯渣的可溶化水解。图5为木薯渣在稀HNO3高温催化与水热水解时水解液CODCr的比较。由图5可见,稀HNO3的加入显著提高了木薯渣的水解效果,150℃水解5 min时稀HNO3组水解液的CODCr比水热组提高了29%,但随着温度的升高以及水解时间的延长,稀HNO3组水解液CODCr的增幅不大。
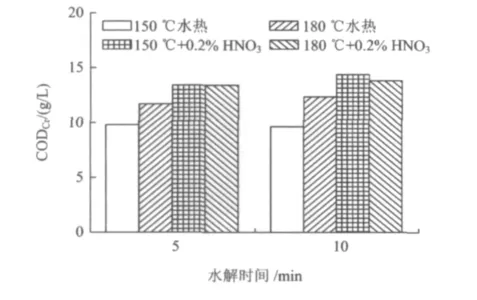
图5 稀HNO3高温催化水解时水解液CODCr随时间的变化Fig.5 Change of CODCrwith time when catalyzed by dilute HNO3at high temperature
表2为稀HNO3催化木薯渣水解时水解液的BOD5。由表2可见,同一温度下随着水解时间的延长,水解液的BOD5降低;同时相同水解时间内随着温度的升高,水解液的BOD5也降低。
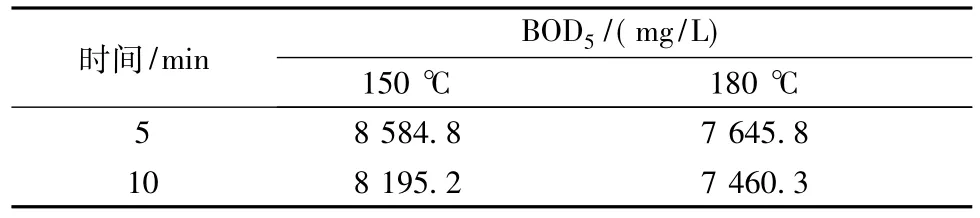
表2 稀HNO3高温催化水解木薯渣时水解液的BOD5Table 2 BOD5of hydrolysate obtained from cassava starch dregs pretreated by dilute HNO3at higher temperature
图6为木薯渣在稀HNO3高温催化与水热水解时水解液可生化性的比较。由图6可见,加稀HNO3组水解液的B/C均比水热组高,150℃水解5 min时稀HNO3组水解液的B/C达到0.64,比相同条件下水热组B/C的0.48,提高了33%。但随着温度的升高及水解时间的延长,稀HNO3组水解液的B/C明显降低,在180℃水解10 min时水解液的B/C降到0.54。因此0.2%稀HNO3的加入不仅提高了木薯渣的水解效果,而且对水解液的可生化性也有所提高。
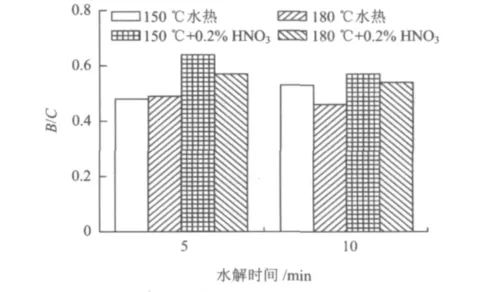
图6 稀HNO3高温催化水解时水解液可生化性随时间的变化Fig.6 Change of biodegradability of hydrolysate with time when catalyzed by dilute HNO3at high temperature
表3为木薯渣稀HNO3高温催化水解时水解液中各单糖浓度。由表3可见,0.2%HNO3处理组水解液的各单糖浓度均高于水热处理组。当温度相对较低时,随着水解时间的增加,水解液中的葡萄糖浓度升高,木糖和阿拉伯糖浓度的变化不大,这是因为150℃水解5 min时木薯渣大约有81%的葡萄糖发生溶解,而木糖和阿拉伯糖基本已全部溶出。当温度相对较高时,随着水解时间的增加,水解液中的葡萄糖浓度有所降低,木糖浓度稍有增加,而阿拉伯糖浓度变化甚微。可见,在高温稀HNO3的催化作用下木薯渣的淀粉、半纤维素已基本水解完全,而纤维 素部分发生水解。
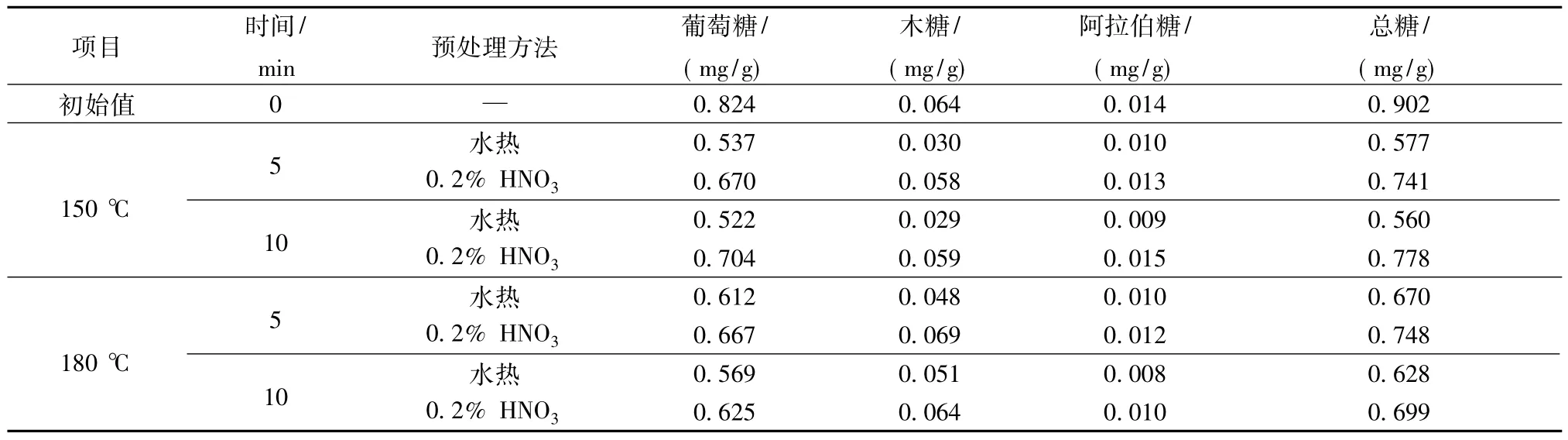
表3 稀HNO3高温催化水解时水解液中各单糖浓度(以干渣计)Table 3 Monosaccharides concentrations in hydrolysate when catalyzed by dilute HNO3at higher temperature(Total dry residue)
表4为木薯渣稀HNO3高温催化水解时的固体损失。由表4可见,稀HNO3高温催化水解木薯渣时,每减少1 g的干渣可产生1.0~1.2 g的CODCr。
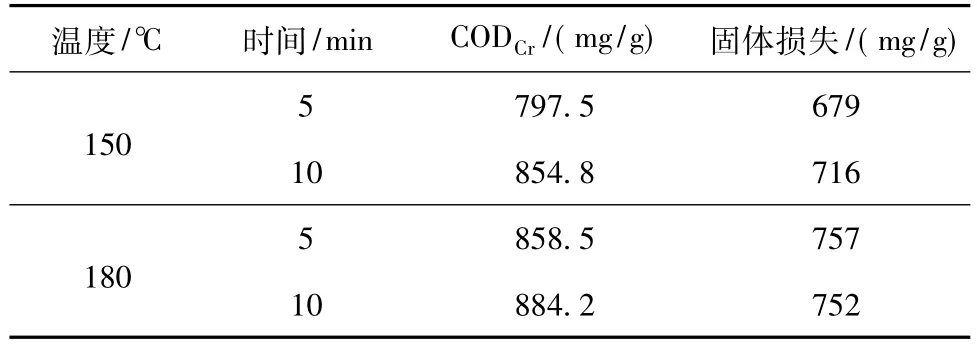
表4 稀HNO3高温催化水解时的固体损失(以干渣计)Table 4 Solids loss when catalyzed by dilute HNO3at higher temperature(Total dry residue)
3 结论
(1)木薯渣高温水热水解时,高温有利于木薯渣的水解,180℃时水解液的CODCr均比150℃时高1888 mg/L以上,但易造成水解液的可生化性降低。同时木薯渣固体的损失与水解液中的CODCr呈正相关性,且每减少1 g干渣可产生1.05 g CODCr。
(2)稀HNO3的加入不仅对木薯渣的水解起催化促进作用,而且提高了水解液的可生化性。在稀HNO3水解情况下,温度及水解时间对水解液CODCr的影响不大,但随着温度的升高及水解时间的延长,水解液的可生化性降低。因而选择150℃下稀HNO3水解5 min较合适,其B/C可达到0.64。
[1]刘琨.木薯渣的干燥特性探讨[J].广西大学学报:自然科学版,2001,26(3):165-167.
[2]刘琨.木薯淀粉废渣的利用[J].中国饲料,1996(10):34.
[3]黄金华,王士长,梁珠民,等.不同处理对木薯渣饲料营养价值的比较[J].广西农业科学,2009,40(6):768-771.
[4]浦跃武,刘坚.木薯渣厌氧发酵制取沼气的研究[J].安徽农业科学,2009,37(29):14308-14310.
[5]SRIHERWANTO C,KOOB C,BISPING B.Cassava bagasse fermented by Rhizopus spp.for potential use as animal feed[J].New Biotechnology,2009,25(suppl 1):289.
[6]WANAPAT M,PURAMONGKON T,SIPHUAK W.Feeding of cassava hay for lactating dairy cows[J].Asian-Australasian Journal of Animal Sciences,2000,13(4):478-482.
[7]WANAPAT M.Manipulation of cassava cultivation and utilization to improve protein to energy biomass for liverstock feeding in the tropics [J].Asian-Australasian Journal of Animal Sciences,2003,16(4):463-472.
[8]邹璇,王德汉,李淑仪,等.木薯渣堆肥及其对难溶性磷的活化试验研究[J].生态环境学报,2010,19(1):81-85.
[9]管军军,张同斌,崔九红,等.木薯渣生产菌体蛋白的研究[J].安徽农业科学,2008,36(22):9556-9558.
[10]苏启苞.木薯秆屑木薯渣营养成分及栽培杏鲍菇试验[J].食用菌,2008,27(4):59-61.
[11]苏启苞,刘传森.利用木薯秆、木薯渣栽培真姬菇试验[J].中国食用菌,2008(3):36-38.
[12]容元平,廖兰,伍时华,等.木薯渣残余淀粉提取与发酵酒精工艺研究[J].安徽农业科学,2010,38(6):2793-2794.
[13]苏小建,谢丽霞,曹子慧,等.木薯渣的发酵工艺研究[J].粮油加工,2010(10):127-129.
[14]项宜娟,蔡谨,江凌,等.木薯渣的稀酸水解及用于丁酸固定化发酵[J].中国科技论文在线,2010,5(3):249-254.
[15]SLUITER A,HAMES B,RUIZ R,et al.Determination of structural carbohydrates and lignin in biomass[R].Golden,Colorado:National Renewable Energy Laboratory,2008.
[16]卫生部.GB/T 5009.9—2008 食品中淀粉的测定[S].北京:中国标准出版社,2009.
[17]ZHANG R,LU X B,SUN Y S,et al.Modeling and optimization of dilute nitric acid hydrolysis on corn stover[J].J Chemical Technology and Biotechnology,2011,86(2):306-314. △

