硝化产物对硝化细菌混培物保藏特性的影响
汪彩华,郑 平,胡安辉 (.浙江大学环境工程系,浙江 杭州 30029;2.北京天地人环保科技有限公司,北京0076)
硝化产物对硝化细菌混培物保藏特性的影响
汪彩华1,2,郑 平1*,胡安辉1(1.浙江大学环境工程系,浙江 杭州 310029;2.北京天地人环保科技有限公司,北京100176)
采用添加硝化产物的方法,研究了饥饿保藏过程中硝化产物对硝化细菌混培物活性和相关性状的影响.结果表明,饥饿保藏过程中添加亚硝酸盐可改善硝化细菌混培物的保藏效果,并明显降低硝化活性的衰减速率.缺氧条件下,4℃加5mmol/L亚硝态氮、4℃加5mmol/L硝态氮及4℃不加代谢产物3种保藏方法下的硝化活性均呈指数衰减,衰减速率分别为0.010d-1、0.020d-1、0.021d-1,半衰期分别为72.3、33.9、32.7d;硝化活性趋于稳定时,3种方法下的硝化活性保留率分别为18.7%、19.1%和15.1%,总菌体量保留率分别为62.0%、47.3%和58.7%;随着饥饿保藏时间的延长,各方法下的硝化细菌混培物ATP含量和血红素c含量均随硝化活性的衰减而下降,混培物颜色也随硝化活性的衰减而变黑.
硝化细菌混培物;硝化产物;保藏特性
硝化作用是多种生物脱氮技术的基础,是氨经亚硝酸细菌氧化成亚硝酸,再经硝酸细菌氧化成硝酸的一个系列反应[1-2],除了涉及到氨、亚硝酸和硝酸等多种产物和基质外,还涉及到生物催化剂—硝化细菌.由于硝化装置中基质氨浓度较高,硝化过程中常有亚硝酸和硝酸的积累,而当亚硝酸和硝酸积累到一定浓度时会对硝化细菌活性产生抑制作用[3-5].
而随着废水生物脱氮工程的普及,对高效硝化菌种的需求日益增大.但至今为此,国内对硝化细菌混培物保藏的研究还未见报道,国外也仅仅停留于研究低温对硝化细菌混培物保藏的影响[6-8].亚硝酸盐和硝酸盐作为硝化作用的产物,积累到一定浓度会对硝化活性产生抑制作用,但若能在基质缺乏的工况下仍对硝化活性有抑制作用,却变成了是一件幸事.因此,设计了在硝化细菌混培物保藏过程中加入硝化产物的试验,以探究硝化产物亚硝态氮和硝态氮是否可以对硝化细菌混培物的饥饿状况起到正调控作用,从而有助于硝化菌种的保藏和应用.
1 材料与方法
1.1 试验材料
试验所用硝化细菌混培物取自浙江某企业短程硝化池(总容积2.5m3),该短程硝化池采用模拟废水(其成分详见文献[9])运行,并已在自然环境温度下稳定运行一年半,混培物浓度为2~3gMLVSS/L,容积负荷达 1.5~2kg/(m·d),沉降比为15%.
1.2 保藏试验
硝化细菌混培物用自来水洗涤 3次后自然沉降滗水,分别在3个1L的玻璃瓶(R1、R2、R3)中分装800mL沉降滗水后的混培物和100mL模拟废水,使 3个瓶中的最终氨氮浓度均为5mmol/L,混培物浓度均为 19.72gMLSS/L、13.48gMLVSS/L;再分别在 R1中另加入亚硝态氮,R2中加入硝态氮,使其终浓度均为 5mmol/L;最后将 3个玻璃瓶(R1、R2、R3)用铝箔封口并置于 4℃冰箱中保藏,每隔 1个月取混培物测定活性和其他相关指标.模拟废水成分为MgSO4· 7H2O 0.3g/L, KHCO32.0g/L, KH2PO40.01g/L, CaCl2·2H2O 0.0056g/L,微量元素Ⅰ、Ⅱ各1mL/L[2].
1.3 活性测定
活性测定所用的模拟废水成分同上,氨氮浓度为50mg/L,pH值控制在7.7~7.8.每20mL模拟废水中加入 2.5g湿硝化细菌混培物后曝气2min使溶解氧达到饱和,再在 30℃下用溶解氧自动记录仪记录溶解氧的消耗情况,每隔 2s记录一次,直至溶解氧降为0.5mg/L.另设不加基质的对照试验,用同样的方法测定硝化细菌混培物的耗氧速率.
1.4 测定项目与方法
SS、VSS(总菌体量)、SV30采用国标法[10]; COD采用EVOVI ET99718COD仪快速测定;pH值采用pHS-9V型酸度计测定;DO采用YSI 58型溶解氧仪测定(外接自动记录仪);硫化物采用亚甲基蓝分光光度法测定;硫酸盐采用铬酸钡分光光度法测定.
ATP:荧光素酶法[11-12].取 1g湿硝化细菌混培物于2mL双蒸水中制成菌悬液,再于沸水浴中煮1h的4.5mL提取剂(20mmol/L Tris、2mmol/L EDTA, pH值7.75)中加入0.5mL菌悬液,共同煮10min,冷却后于10,000g、4℃下离心4min,取上清夜待用.25℃下,向2mL计数瓶中加入1mL缓冲液(0.05mol/L Tris-HAc、0.01mol/L MgSO4· 7H2O、2mmol/L EDTA,pH值7.75)后,再加入样品提取液、荧光素和荧光素酶,混合后立即于荧光分光光度计中测定发光值.
血红素:吡啶血红素分光光度法.取 1g湿硝化细菌混培物悬浮于25mL 10mmol/L、pH值为7.5的磷酸缓冲液中,再于800W功率下超声破碎20min,最后于 15,000g、4℃条件下离心 15min,取上清液进行测定,测定方法详见文献[13].
扫描电镜观察:取适量混培物样品于2.5%戊二醛溶液中 4℃固定过夜,经 0.1mol/L pH值为7.0磷酸缓冲液洗涤3次后用1%锇酸溶液固定1~2h, 接着用0.1mol/L pH 7.0磷酸缓冲液洗涤3次,再用梯度浓度乙醇(包括 50%、70%、80%、90%和 100%)进行脱水处理,脱水处理后的样品用1:1乙醇醋酸异戊酯处理30min,用纯醋酸异戊酯处理 1~2h.最后将样品置于临界点干燥,镀膜后用XL30型环境样品扫描电镜(荷兰Philips公司)观察结果.
2 结果与分析
2.1 硝化产物对硝化活性和总菌体量的影响
2.1.1 硝化产物对硝化活性的影响 高浓度氨氮的硝化装置中,当代谢产物亚硝态氮和硝态氮积累到一定浓度时会对硝化细菌活性产生抑制作用.添加不同代谢产物后硝化活性随饥饿保藏时间的变化如图1.
从图 1可看出,在保藏过程中,硝化细菌混培物活性呈指数衰减,活性衰减速率和半衰期见表1.饥饿保藏120d后,各保藏方法的硝化活性均趋于稳定,R1(4℃加 5mmol/L亚硝态氮)、R2(4℃加 5mmol/L硝态氮)和 R3(4℃不加硝化产物)的活性保留率分别为 18.7%,19.1%和15.1%.虽然硝化活性趋于稳定时 3者表观上显示的活性保留率相差不多,但比较3者的半衰期发现,R1的半衰期远远长于R2和R3,分别是两者的2.13倍和2.21倍,这一结果说明添加亚硝态氮可以暂时缓解硝化细菌混培物因饥饿所致的不利影响,但添加硝态氮的效果不明显.亚硝态氮和硝态氮虽然同为硝化作用代谢产物,但在硝化细菌混培物的饥饿保藏过程中所起作用不同,饥饿保藏中加入亚硝态氮可明显缓解硝化细菌的饥饿状况,而加入硝态氮却没有这种效用.究其原因可能有:一是本试验所用硝化细菌混培物取自短程硝化池,除了优势菌——氨氧化细菌外还含有亚硝酸氧化细菌和反硝化细菌,在短程硝化工艺的长期驯化过程中反硝化细菌还原硝态氮的能力被慢慢弱化,相反还原亚硝态氮的能力却被逐渐加强,保藏过程中加入的亚硝态氮可在亚硝酸盐还原酶的作用下还原成NO[14-15],NO进一步转化成NO2,缺氧条件下 NO2成为氨单加氧酶的共基质,从而发生厌氧氨氧化反应[16],而一般氨氧化细菌的厌氧氨氧化速率仅有好氧氨氧化速率的1/10[2],因此减少了硝化细菌对氨氮的需求量;二是某些氨氧化细菌胞内也含有亚硝酸盐还原酶[12],同样可以将亚硝态氮还原成NO而发生厌氧氨氧化反应.所以,在氨氮供应不足的情况下外加亚硝态氮可起正调控.
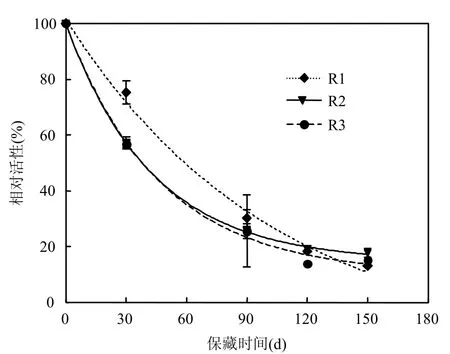
图1 硝化活性随保藏时间的变化Fig.1 The change of nitrifying activity during preservation
2.1.2 硝化产物对总菌体量的影响 随着饥饿保藏时间的延长,硝化细菌混培物发生解体,菌体浓度逐渐下降,试验中总菌体量随保藏时间的变化如图2所示.
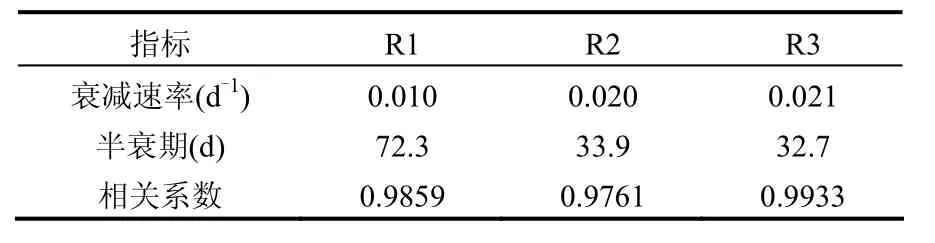
表1 不同保藏方法下硝化活性衰减速率和半衰期Table 1 The decay rate and half-life of nitrifying activity under different preservation conditions
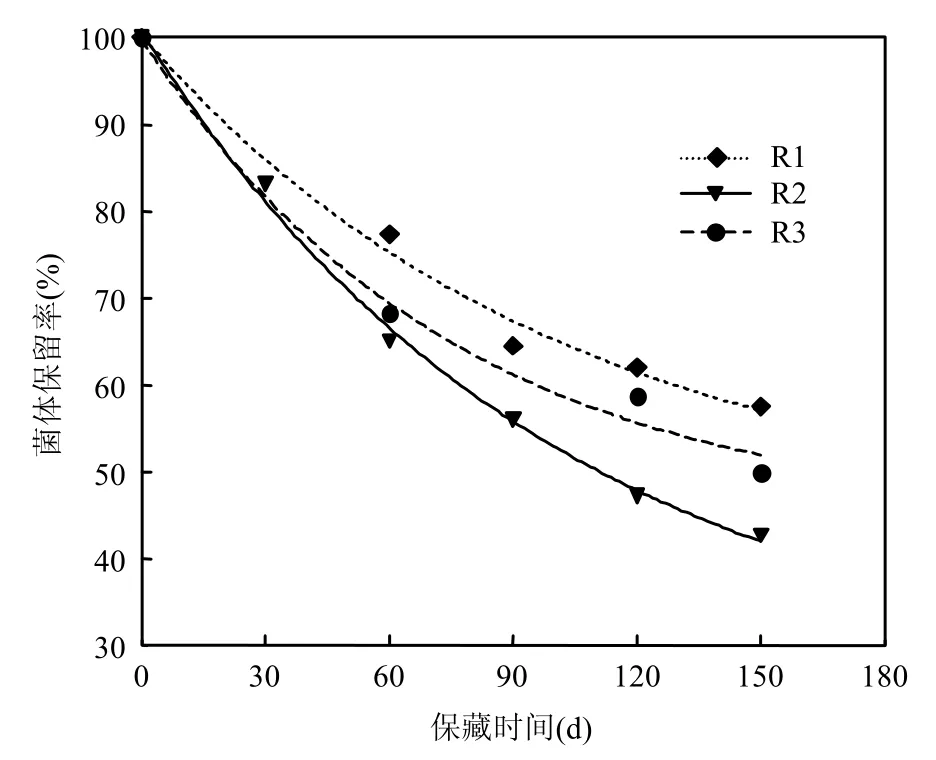
图2 总菌体保留率随保藏时间的变化量Fig.2 The change of total biomass during preservation
从图2可知,在饥饿保藏过程中,总菌体保留率随保藏时间的延长而减少,且前60d的衰减速率要明显比后90d大.保藏的前60d, R1、R2、R3的总菌体量分别下降 22.6%、34.0%、31.8%,而后90d仅分别下降19.8%、22.3%、18.2%.保藏150d后,R1、R2和R3的总菌体量保留率分别为57.6%、42.7%和50.0%,但保藏过程中3者的总衰减速率始终为 R2>R3>R1.这一结果表明, 在硝化细菌混培物保藏过程中,加入亚硝态氮不仅可以减缓硝化活性的衰减,而且可以减缓菌体的衰减,但加入硝态氮的情况却与此相反,原因有待深入研究.但可说明经饥饿保藏后存活下来的硝化细菌具有抗性强、活性高的特性,而用总菌体量作为硝化活性评价指标会产生虚高现象.
2.2 硝化产物对硝化细菌混培物性状的影响
2.2.1 硝化产物对生化性状的影响 血红素是硝化细菌中血红蛋白的重要辅基,ATP则是硝化细胞中重要的能量载体,因此两者的含量可以反映硝化细菌的生理状况.饥饿保藏时,硝化细菌混培物中血红素c和ATP含量保留率与时间的关系见表2.
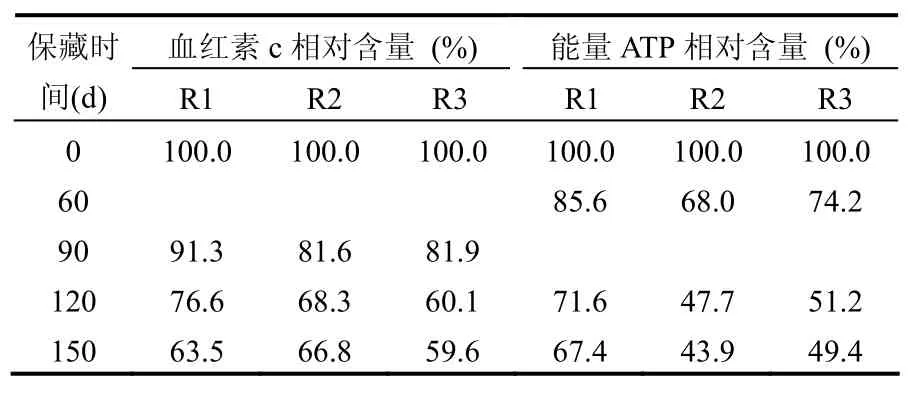
表2 保藏过程中血红素c和ATP保留率的变化Table 2 The change of heme c and ATP during preservation
饥饿保藏过程中,各种方法下的硝化细菌混培物血红素c含量和ATP含量均随保藏时间的延长而下降,且两者的衰减速率均随硝化活性衰减速率的变化而变化,但两者的总体衰减速率要小于硝化活性的总体衰减速率,这与实验室已有实验结果相符.这也进一步证明,硝化细菌混培物血红素c含量和ATP含量可用于定性的表示硝化细菌混培物的硝化活性,但与硝化活性间不具有线性相关性.
2.2.2 硝化产物对物化性状的影响 饥饿保藏过程中,混培物上清液中可溶性 COD(SCOD)和混培物沉降比(SV30)随时间的变化如图3所示.由图3(a)可知, R1、R2和R3的SCOD值均随着饥饿时间的延长而增加,且 R3的增长速率明显快于R1和R2,但相比于菌体衰减理论COD值,3者混培物上清液中增加的SCOD均可忽略不计,增加的最大SCOD值也仅为菌体衰减理论COD值的0.24%,进一步证明饥饿情况下活菌会利用死亡菌体水解产物的推测是正确的.由图3(b)可知,R1、R2和R3的SV30值下降速率均是先快后慢,但随保藏时间的延长3者间的变化差异不大,且在试验期间SV30值没有像实验室温度保藏试验[17]一样最终趋于稳定.
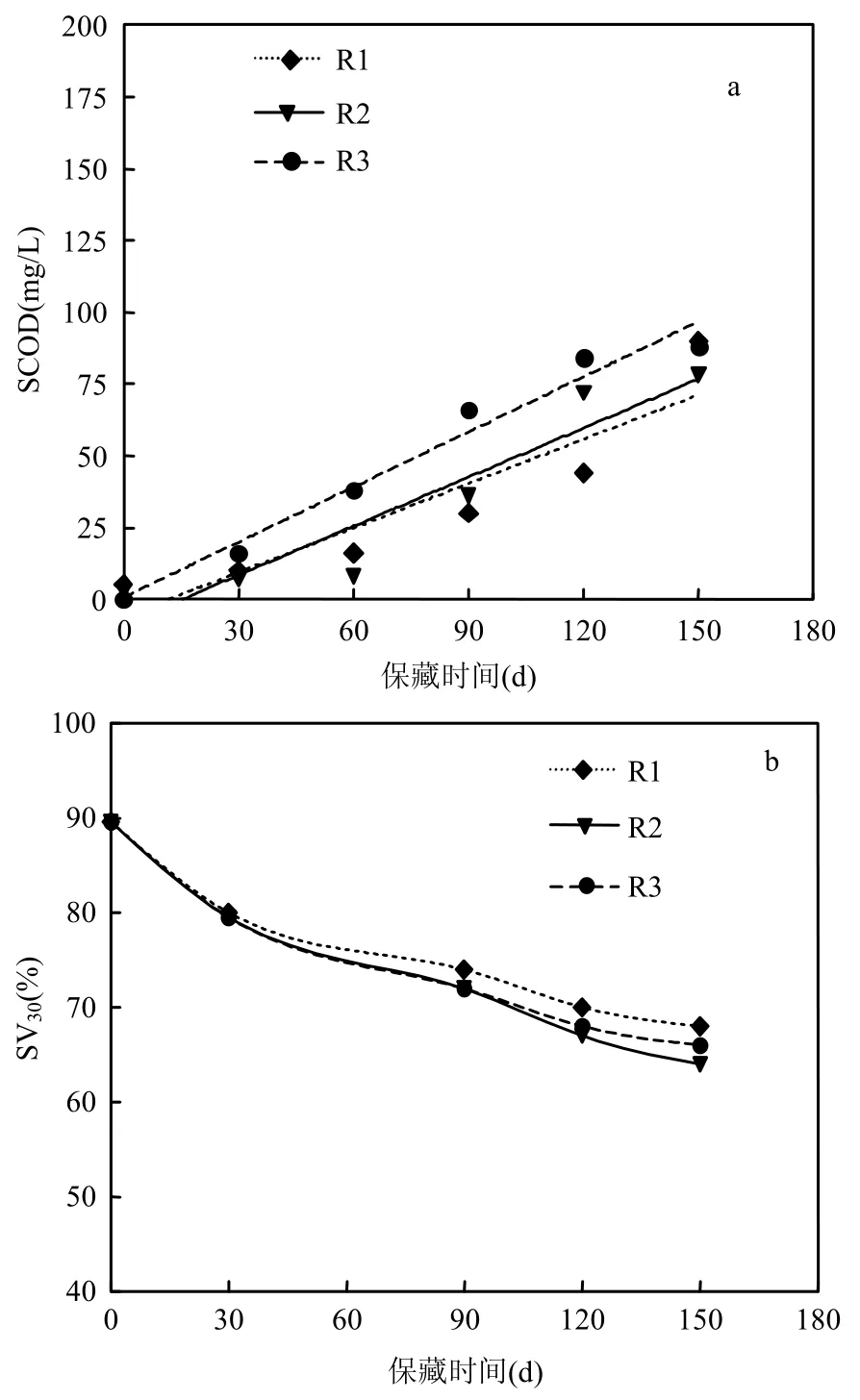
图3 SCOD和SV30值随时间的变化Fig.3 The change of SCOD and SV30during preservation
2.2.3 硝化产物对形态结构的影响 保藏过程中,硝化细菌混培物颜色和菌群结构均发生了明显变化.由图4可知,各方法下的混培物颜色随保藏时间的延长均从下至上逐渐变黑,但不同方法间又有一些差异.R1和R2中的混培物保藏60d后出现混培物上浮现象,且可见明显的气泡,但随着保藏时间的进一步延长此现象又消失,而 R3中自始至终都无此现象;另外,保藏过程中 R1和R2的混培物颜色变化速率相比于 R3来说是先慢后快.测定混培物中的硫化物含量发现,混培物中的硫化物含量与颜色变化成正相关.这主要是因试验用硝化细菌混培物中含有部分反硝化细菌,其可以以死亡菌体产生的有机物为电子供体,以加入或产生的亚硝态氮和硝态氮为电子受体发生反硝化反应,而随硝化产物的逐渐减少反硝化作用会慢慢减弱.缺氧环境中,某些氨氧化细菌可利用反硝化作用产生的NO或NO2取代氨氧化过程中氧气的常规电子受体地位而发生厌氧氨氧化反应,从而减少了硝化细菌对 O2的需求,降低了硫酸盐被还原的速度,所以硝化细菌混培物保藏初期加有硝化产物的混培物颜色变化较不加硝化产物要慢,而当反硝化作用减弱时混培物颜色变化速率加快并最终与不加硝化产物趋于一致.
从图5可以看出,与保藏前相比,R2和R3中的丝状菌比例增加,絮体结构变得松散,而 R1中的丝状菌不但没有增加反而有下降的趋势,絮体结构更加紧密.表明硝化细菌混培物的饥饿保藏过程中加入亚硝态氮可以保持球菌的优势地位.

图4 混培物颜色随保藏时间的变化Fig.4 The change of color during preservation

图5 保藏过程中混培物结构的变化的扫描电镜图像Fig.5 SEM graph of change of mixed culture structure
3 结论
3.1 在硝化细菌混培物饥饿保藏过程中,亚硝态氮可明显降低硝化活性的衰减速率.4℃加5mmol/L亚硝态氮、4℃加5mmol/L硝态氮、4℃3种保藏方法的硝化活性衰减速率分别为0.010d-1、0.020d-1、0.021d-1,半衰期分别为72.3、33.9、32.7d.
3.2 在硝化细菌混培物饥饿保藏过程中,总菌体量用作硝化活性的评价指标会产生虚高现象.活性趋于稳定时,采用4℃加5mmol/L亚硝态氮、4℃加5mmol/L硝态氮、4℃ 3种方法保藏的硝化细菌混培物活性保留率分别为18.7%、19.1%、15.1%,总菌体量保留率分别为 62.0%、47.3%和58.7%.
3.3 在硝化细菌混培物饥饿保藏过程中,混培物血红素c含量和ATP含量可用于定性表征硝化活性.4℃加 5mmol/L亚硝态氮、4℃加5mmol/L硝态氮、4℃ 3种保藏方法的血红素c和ATP含量均随硝化活性的衰减而下降.
3.4 在硝化细菌混培物饥饿保藏过程中,硝化产物可减慢混培物变黑速度.保藏前期,4℃加5mmol/L亚硝态氮和4℃加5mmol/L硝态氮两方法的硫化物生成速度慢于4℃方法.
[1] 陈婷婷,郑 平.硝化基质和产物对发光细菌的急性毒性 [J].微生物学报, 2009 49(6):759-765.
[2] 唐崇俭,郑 平.厌氧氨氧化膨胀污泥床反应器的化学计量学特性 [J]. 中国环境科学, 2010, 30(11):1446-1452.
[3] Stein L Y, Arp D J. Ammonium limitation results in the loss of ammonia-oxidizing activity in Nitrosomonas europaea [J]. Applied and Environmental Microbiology, 1998,64(4):1514-1521.
[4] Yarbrough J M, Rake J B, Eagon R G. Bacterial inhibitory effects of nitrite: inhibition of active transport, but not of group translocation, and of intracellular enzymes [J]. Applied and Environmental Microbiology, 1980,39(4):831-834.
[5] Sharma B, Ahler R C. Nitrification and nitrogen removal [J]. Water Research, 1977,11:897-925.
[6] Vlaeminck S E, Geets J, Vervaeren H, et al. Reactivation of aerobic and anaerobic ammonium oxidizers in OLAND biomass after long-term storage [J]. Applied Microbiology and Biotechnology, 2007,74(6):1376-1384.
[7] Laurin V, Labbe V, Juteau P, et al. Long-term storage conditions for carriers with denitrifying biomass of the fluidized, methanol-fed denitrification reactor of the Montreal Biodome, and the impact on denitrifying activity and bacterial population. [J] Water Research, 2006, 40(9):1836-1840.
[8] Vogelsang C, Gollembiewski K, Ostgaard K. Effect of preservation techniques on the regeneration of gel entrapped nitrifying sludge [J]. Water Research, 1999, 33(1):164-168.
[9] 卢 刚,郑 平.气升式内循环反应器短程硝化控制策略的研究[J]. 浙江大学学报(工学版), 2005, 39(4):542-546.
[10] 国家环境保护总局.水和废水监测分析方法 [M]. 4版.北京:中国环境科学出版社, 2002.
[11] 姚槐应,黄昌勇.土壤微生物生态学及其实验技术 [M]. 北京:科教出版社, 2005:143-144.
[12] Thore A, Lundin A. Firefly luciferase ATP assay as a screening method for bacteriuria [J]. Journal of clinical microbiology, 1983, 17(2):218-224.
[13] Berry E A, Trumpower B L. Simultaneous determination of hemes a, b, and c from pyridine hemochrome spectra [J]. Analytical Biochemistry, 1987,161(1):1-15.
[14] Carr G J, Page M D, Ferguson S J. The energy-conserving nitric-oxide-reductase system in Paracoccus denitrificans. distinction from the nitrite reductase that catalyses synthesis of nitric oxide and evidence from trapping experiments for nitric oxide as a free intermediate during denitrification [J]. European Journal of Biochemistry, 1989,179(3):683-692.
[15] Goretski J, Hollocher T C. The kinetic and isotopic competence of nitric oxide as an intermediate in denitrification [J]. The Journal of Biological Chemistry, 1990,265(2):889-895.
[16] Zart D, Schmidet I, Bork E. Significance of gaseous NO for ammonia oxidation by Nitrosomonas eutropha [J]. Antonie Leeuwenhoek, 2000,77:49-55.
Influence of nitration product on the preservation characteristics of mixed nitrifying culture.
WANG Cai-hua1,2, ZHENG Ping1*, HU An-hui1(1.Department of Environmental Engineering, Zhejiang University, Hangzhou 310029, China;2.Beijing Tiandiren Environment and Technology Corporation limited, Beijing 100176, China). China Environmental Science, 2011,31(10):1663~1668
Influence of nitration product on the preservation characteristics of mixed nitrifying culture was studied. Nitrite could decrease the decay rate of nitrifying activity, and also improve the other characteristics during the starvation period. Under the anaerobic conditions of 4℃ with 5mmol/L nitrite, 4 ℃ with 5mmol/L nitrate and 4℃, the decay rate of nitrifying activity was 0.010/d, 0.020/d and 0.021/d, and the half-life was 72.3, 33.9 and 32.7d, respectively. After 5months’ preservation, the relative activity survival and relative biomass survival were 18.7%, 19.1%, 15.1%, and 62.0%, 47.3%, 58.7%, respectively. With storage time prolonging and the activity decayed, the heme c and ATP contents decreased, and the mixed nitrifying culture changed to black gradually.
mixed nitrifying culture;nitration product;preservation characteristics
X 703.1
A
1000-6923(2011)10-1663-06
2011-01-22
国家“863”项目(2009AA06Z311);国家自然科学基金资助项目(30770039)
* 责任作者, 教授, pzheng@zju.edu.cn
汪彩华(1983-),女,安徽省安庆市人,浙江大学环境工程系硕士研究生,主要从事废水生物处理方面的研究.发表论文4篇.

