芽孢杆菌Z5溶铜绿微囊藻特性研究
马宏瑞,章 欣,王晓蓉,耿金菊,顾雪元 (.陕西科技大学资源与环境学院,陕西 西安 700;.南京大学环境学院,江苏 南京 0046)
芽孢杆菌Z5溶铜绿微囊藻特性研究
马宏瑞1*,章 欣1,王晓蓉2,耿金菊2,顾雪元2(1.陕西科技大学资源与环境学院,陕西 西安 710021;2.南京大学环境学院,江苏 南京 210046)
从利用铜绿微囊藻液人工驯化的活性污泥中分离出一株编号为Z5的溶藻细菌,通过生理生化实验及16S rDNA序列分析,鉴定为芽孢杆菌.研究了Z5菌对铜绿微囊藻(Microcystis aeruginosa PCC 7806)的溶藻能力,考察了不同生长期的Z5菌无菌滤液及添加比例对铜绿微囊藻生长的影响.结果表明,作用6d后,Z5菌稳定期的无菌滤液对处于稳定期的铜绿微囊藻的去除效果达到91.36%.在4%~12%的投加范围内,无菌滤液的投加量与对铜绿微囊藻生长的抑制作用和溶解作用呈正比.研究表明芽孢杆菌Z5是通过分泌具有部分热稳定性的溶藻活性物质进行溶藻.
铜绿微囊藻;溶藻;芽孢杆菌Z5
近年来,由于水体的富营养化而导致的藻类水华暴发,对人类社会以及水生生态系统产生了各种危害[1].在对水华防治的研究中,有学者注意到,水华和赤潮的消亡可能与溶藻细菌的侵染有关[2-3].溶藻细菌的作用方式一般分为直接溶藻和间接溶藻.其中,间接溶藻是指细菌同藻竞争有限营养[4],或细菌分泌胞外物质溶藻[5].利用溶藻细菌作为水华治理的潜在手段已得到学界的广泛关注,如史顺玉[6]报道了一株能显著抑制水华束丝藻的生长的溶藻细菌,Kim等[7]分离到一株新的溶藻细菌,5d内可以去除90%以上的微型原甲藻.这些溶藻细菌大多分离自发生水华或赤潮的自然水体.由于溶藻细菌在天然水体中分布较少,采用传统方法直接从天然水体中分离比较困难,本试验从利用铜绿微囊藻液人工驯化的活性污泥中分离出一株编号为 Z5溶藻细菌,对其溶藻特性进行了研究,同时利用16SrDNA序列分析对其进行鉴定,为实际水华的生态治理提供参考.
1 材料与方法
1.1 藻种及培养基
铜绿微囊藻(Microcystis aeruginosa PCC 7806)由中国科学院南京地理湖泊研究所提供.溶藻菌种从活性污泥中筛选获得.
溶藻细菌的富集培养采用牛肉膏蛋白胨培养基[8],铜绿微囊藻培养采用 BG11培养基[9].藻种经活化后,采用BG11培养基在26℃、光照强度为2000lx条件下培养,光暗周期为12h:12h.采用血球计数板对铜绿微囊藻细胞浓度进行计数.
1.2 实验方法
1.2.1 溶解铜绿微囊藻菌株的分离 溶藻细菌的分离参见文献[10],具体操作如下:用无菌枪头吸取1mL活性污泥于9mL无菌水中,制成10-1稀释液.以此类推分别制成10-2,10-3,10-4,10-5,10-6, 10-7,10-8稀释液.做平板涂布,将获得的单菌落划线3次以获得纯种.将纯化的各种细菌分别置于200mL液体培养基中,在37℃下180r/min振荡培养 24h,将所有菌液稀释至相同菌浓度,等体积接种入一定量铜绿微囊藻藻液中培养,6d后寻找并确认藻液明显黄化的样品,将样品所对应的接种菌株编号并保存.实验用菌株编号为Z5.
1.2.2 生长曲线测定 取100mL牛肉膏蛋白胨培养基于250mL三角瓶中,用无菌吸管吸取1mL培养18h的Z5菌培养液于三角瓶中,将其置于振荡培养箱中振荡培养.培养条件:37℃、180r/min.其生长曲线的测定参照文献[10].
1.2.3 细菌培养物不同处理方式对铜绿微囊藻生长的影响[11]将Z5菌的纯培养液、经0.22μm滤膜抽滤2次的无菌滤液(在平板上划线证明滤液无菌)及高温灭菌液(120℃、0.1MPa 灭菌20min)各10mL,分别加入100mL铜绿微囊藻藻液中进行溶藻实验,4d后测定藻密度.
1.2.4 细菌不同生长期滤液对铜绿微囊藻生长的影响 根据1.2.2部分实验所得的生长曲线确定Z5菌株的不同生长期,将Z5菌株在1.1的培养条件下经延迟期、对数期、稳定期后培养至衰亡期,分别取各生长期的细菌菌液 10mL,经0.22μm滤膜抽滤3次后,加入100mL处于稳定期的藻液中,进行溶藻实验.每个实验设3个平行.
1.2.5 滤液与藻液的不同投加比例对铜绿微囊藻生长的影响 取0,2,4,6,8,10,12mL Z5菌稳定期的无菌滤液,分别投加进100mL处于对数期的藻液中,各设3个平行实验,每24h测1次藻密度.
1.2.6 生理生化鉴定 革兰氏染色、淀粉水解、明胶液化、V-P实验、柠檬酸盐实验等生理生化实验参照文献[10].
1.2.7 16S rDNA序列分析 Z5
菌株的16S rDNA的提取、扩增和序列检测由南京金斯瑞生物科技有限公司进行测定.将所测得的基因序列经BLAST程序与GenBank核酸数据库进行比对分析(http://www.ncbi.nlm.nih.gov/blast).相似的序列在ClustalX软件中进行多重匹配排列分析,用MEGA4.0软件中 Neighbor-Joining方法构建系统发育树.
1.2.8 藻去除率的计算 藻的去除率R定义为:

式中:C0为对照组铜绿微囊藻浓度,106cells/mL; Ce为处理组铜绿微囊藻浓度,106cells/mL.
2 结果和讨论
2.1 Z5菌的生长曲线

图1 细菌Z5的生长曲线Fig.1 The growth curve of bacterium strain Z5
从图1可知,Z5菌株的延迟期约为2h,对数生长期为2~10h,稳定期为10~38h;38h后进入衰亡期.根据文献[10]的代时计算公式得Z5的代时G=1.03h.史顺玉等[12]报道,溶藻细菌的溶藻活性与细菌生长速度和细菌浓度呈正相关.菌株 Z5代时较短,因此增殖速度快,可以在较短时间内达到较高的生物量.
2.2 细菌培养物不同处理方式对铜绿微囊藻生长的影响

图2 菌液不同处理方式的溶藻效果Fig.2 Lytic effects of Z5 bacteria liquids after different treatments
由图2可见,菌液与经0.22μm滤膜抽滤2次的无菌滤液均有溶藻作用,说明 Z5菌株的除藻作用并没有因为去除了菌体而减弱,因此 Z5菌株对铜绿微囊藻的溶藻过程可能是通过分泌溶藻活性物质来实现的.T检验结果显示(表1),原菌液与无菌滤液之间不存在显著性差异,证实了Z5菌株间接除藻的机制.高温灭菌后,溶藻能力显著下降,但仍远高于对照组,可能是高温使 Z5菌株代谢释放的部分溶藻活性物质的性质发生改变,但Z5菌株分泌的部分溶藻活性物质具有抗高温性能.裴海燕等[13]对溶藻细菌P15所做的研究中发现该菌可释放某种具有热稳定性的物质溶藻;Kim等[14]研究了 1株海洋溶藻细菌 Bacillus sp.AB-4,与本研究结果相类似,其释放的溶藻活性物质的溶藻能力在高温下(100℃)略有降低.目前已得到分离鉴定的溶藻活性物质种类包括蛋白质[2,15]、多肽[3]、氨基酸[16-17]、抗生素[18]、含氮化合物[19]、生物碱[20]、色素[21]等.Nobuyuki等[22]发现,对微囊藻具有溶藻效应的溶藻细菌是通过分泌胞外亲水性非蛋白质类物质杀藻.Z5菌是通过分泌胞外物质溶藻,且这种溶藻物质具有一定的热稳定性,可能为非蛋白质类物质.有关Z5菌株分泌的溶藻活性物质的结构与性质有待进一步研究.

表1 不同处理组溶藻效果的T-检验分析结果Table 1 T-test between different bacteria liquids under different treatments
2.3 Z5菌不同生长期滤液对铜绿微囊藻生长的影响
细菌在不同生长期的代谢活动和代谢产物具有较大差异,进而影响了细菌的溶藻能力.本研究取不同生长期的菌液经过滤处理后投入铜绿微囊藻液中.根据图1细菌的生长曲线,本研究选取t=2,8,18,40h时的无菌滤液分别检测Z5菌在生长延迟期、对数期、稳定期和衰亡期的溶藻能力.结果如图3所示.从图3中可以看出,除衰亡期处理外,其他生长期无菌滤液均表现出显著的除藻能力,衰亡期无菌滤液则在36h后显示除藻能力,投加滤液84~108h时,各处理中藻细胞数快速下降,而后藻细胞数接近稳定.经计算,Z5延迟期、对数期、稳定期和衰亡期无菌滤液的除藻率分别达到 73.80%、78.42%、91.36%和 59.57%,说明采用稳定期的 Z5菌株溶藻能力最强,且溶藻持续时间可达140h,表现出良好的溶藻稳定性.
Z5菌株从延迟期就开始产生溶藻物质,处于稳定期的细菌滤液具有较好的溶藻效果,而处于衰亡期的细菌滤液溶藻效果最弱,只对铜绿微囊藻的生长具有一定的抑制作用,可能是易利用的营养物质被消耗殆尽,细菌转而利用包括溶藻物质在内的胞外分泌物作为二次营养物质维持生命代谢.关英红等[23]比较了细菌对不同时期藻的溶解效果,在延迟期的铜绿微囊藻液中加入细菌可以较为有效地控制藻细胞的增殖,而在对数期和稳定期中加入菌液,其效果不如延迟期显著.本实验结果表明,稳定期 Z5菌株的溶藻效果最强.所以在控制水华的实际应用中,应采用在藻类生长的延迟期投加用处于稳定期Z5菌株制得的无菌滤液的控藻策略,以获得更好的控藻效果.

图3 不同生长期的Z5菌株制得的无菌滤液的溶藻效果Fig.3 The algicidal effect of the bacteria-free filtrates of strain Z5 in different growth periods
2.4 滤液与藻液的不同投加比例对铜绿微囊藻生长的影响

图4 滤液与藻液不同投加体积对微铜绿微囊藻生长的影响Fig.4 The lytic effect of different addition volumes of bacteria-free filtrates of strain Z5 on Microcystis aeruginosa
如图4所示,铜绿微囊藻的去除效果与滤液与藻液间的不同投加比例有很大关系.与不加入无菌滤液相比,2%加入量对铜绿微囊藻有明显促进生长作用,说明滤液中溶藻活性物质浓度不足以对藻的生长产生影响,这可能与滤液中营养成分被铜绿微囊藻利用有关.当 4%加入量,铜绿微囊藻的生长在前5d没有受到明显的影响,在第6d,铜绿微囊藻的生长出现停滞,表现出了无菌滤液对铜绿微囊藻生长的抑制作用;当无菌滤液的投加量为6%、8%、10%、12%时,处理组的藻细胞浓度整体上一直低于对照,且随着无菌滤液体积的投加量逐渐增大,其抑藻和溶藻效果愈加明显,实验进行到第 6d,相对于对照分别去除36.42%、69.32%、89.27%和90.51%的藻细胞(表2).即无菌滤液投加量越多,则溶藻现象越明显,这与牛丹丹等[24]的研究结果相似.

表2 6d后不同体积Z5无菌滤液和细菌培养基对铜绿微囊藻生长的影响Table 2 The effect of different addition volumes of the bacteria-free filtrates of Z5 and bacteria culture medium on Microcystis aeruginosa in 6 days
当铜绿微囊藻初始藻密度为 3.6×106cells/mL时,向藻液中投加10%处于稳定期的Z5菌株制得的无菌滤液,144h后,稳定期的铜绿微囊藻的去除率为 91.36%(图 3),而对数期的铜绿微囊藻去除率为89.27%(图4),由此可知,Z5菌株对稳定期铜绿微囊藻的溶藻效果与对对数期铜绿微囊藻的溶藻效果相当.
2.5 Z5菌的生理生化特征及分子生物学鉴定
Z5菌在牛肉膏蛋白胨培养基上培养24h,单菌落为圆形,乳白色,表面褶皱,干燥不透明,菌体杆状,可运动,菌体大小(6~8)μm×(14~20)μm(图5).革兰氏染色阳性,可以利用淀粉、液化明胶,V-P实验、柠檬酸盐实验阳性,吲哚、甲基红实验阴性,不能利用葡萄糖、蔗糖、乳糖产酸产气.PCR扩增产物的长度为1.512kb,图6为Z5菌株的电泳图谱.获得的16S rDNA序列已在GenBank注册,注册号为lcl|12589,用Blast程序对Z5的16S rDNA序列和GenBank中已登录的16S rDNA序列进行核苷酸序列同源性比较,结果发现,与多株芽孢杆菌的同源性极高,达到 99.7%以上,再结合生理生化指标可以推断出,Z5菌株属于芽孢杆菌属,Z5菌株的系统发育树见图7.

图5 Z5菌株扫描电镜图Fig.5 Strain Z5 observed by scanning electron microscope
目前,国内外已有一些关于芽孢杆菌溶藻的报道.裴海燕等[25]、晋利等[26]、Kim等[27]分别不同介质中分离获得了能够杀死不同类型藻的芽孢杆菌.本研究显微观察发现,在 Z5菌株对铜绿微囊藻的溶藻过程中,藻体颜色渐渐由浓绿转为淡绿直至变黄,变黄时藻细胞已死亡,溶藻过程表现为藻体叶绿素含量逐步减少.同时还发现,溶藻时少数藻细胞在体积上发生变化,与正常藻细胞相比变大或变小,林伟等[28]报道,某些细菌可能影响藻细胞的形态,使藻细胞大小不一,促使藻细胞老化.汪辉[29]分离得到一株溶藻细菌 YZ,其在最优溶藻条件下经过 12d对铜绿微囊藻的去除率为85.44%,而Z5菌6d内对藻的去除率可达到90%以上,显示其较强的溶藻能力.另外,Z5菌延滞期和代时皆较短,分别为2h和1.03h,能够在较短的时间内增加浓度,达到溶藻的要求.

图6 菌株Z5的16S rDNA PCR扩增产物电泳图Fig.6 Electrophoresis pattern of PCR-amplified products of strain Z5 16S rDNA
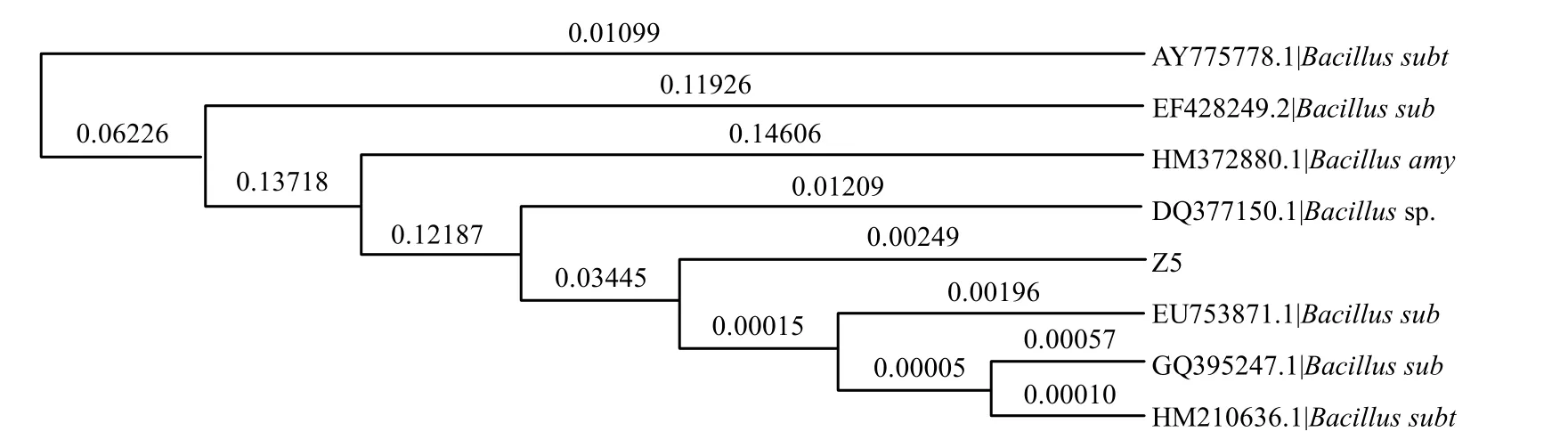
图7 菌株Z5的系统发育树Fig.7 The phylogenetic tree of strain
3 结论
3.1 Z5菌株通过分泌胞外溶藻活性物质达到除藻效果,且这种溶藻活性物质具有一定的热稳定性.
3.2 在牛肉膏蛋白胨液体培养基中,Z5菌生长代时 G=1.03h,延迟期约为 0~2h,对数生长期为2~10h,稳定期为10~38h;38h后进入衰亡期.Z5菌株的最佳溶藻时期为稳定期.向铜绿微囊藻液中加入稳定期Z5菌的无菌滤液,作用6d后可使初始浓度为 3.6×106cells/mL左右的铜绿微囊藻液藻细胞浓度下降90%以上.
3.3 在一定的投加比例范围内,无菌滤液相对于藻液的投加比例越高,对铜绿微囊藻的溶藻作用越明显.
3.4 细菌Z5经生理生化和16S rDNA鉴定,与多株芽孢杆菌的同源性较高,应属于芽孢杆菌属.
[1] 齐雨藻.赤潮 [M]. 广州:广东科技出版社, 1999.
[2] Lee S,Kato J, Takiguchi N, et a1. Involvement of an extracellular protease in algicidal activity of the marine Bacterium Pseudoalteromonas sp Strain A28 [J]. Appl. Environ. Microbiol., 2000,66(10):4334-4339.
[3] Imamura N, Motoike I, Shimada N, et al. An efficient screening approach for anti-Microcystis Compounds based on knowledge of aquatimicrobial ecosystem [J]. J. Antibiotics,2001,54(6):582-587.
[4] 赵以军,刘永定.有害藻类及其微生物防治的基础—藻菌关系的研究动态 [J]. 水生生物学报, 1996,20(2):173-181.
[5] 于凤娟,徐玲玲,程 凯,等.2株高效溶赤潮异湾藻放线菌的鉴定及溶藻特性 [J]. 中国环境科学, 2011,31(1):111-115
[6] Shi Shunyu, Tang Dongshan, Liu Yongding. Effects of an algicidal bacterium Pseudoalteromonas mendocina on the growth and Antioxidant system of Aphanizomenon flos-aquae [J]. Curr. Microbiol., 2009,59:107-112.
[7] Kim Jenong-Dong, Kim Ji-Yong. Selective control of the prorocentrum minimum harmful algae blooms by a novel algae-lytic bacterium Pseudomonas haloplanktis AFMB-008041 [J]. Mar. Biotechnol., 2009,11:463-472.
[8] 赵 斌,何绍江.微生物学实验 [M]. 北京:科学出版社, 2002.
[9] Kazunori S, Hiroshi I, Fumiko N,et al. Purification of microcystins by DEAE and C18Cartridge chromatography [J].Toxicon., 2002, 40:97-101
[10] 沈 萍,范秀容,李广武.微生物学实验 [M]. 北京:高等教育出版社, 2002.
[11] Pei Haiyan, Hu Wenrong. Lytic characteristic and identification of two alga-lysing bacterial strains [J]. Journal of Ocean University of China, 2006,5(4):368-374.
[12] 史顺玉,刘永定,沈银武.细菌溶藻的初步研究 [J]. 水生生物学报, 2004,28(2):219-221.
[13] 裴海燕,胡文容.一株溶藻细菌的溶藻特性及其鉴定 [J]. 中国环境科学, 2005,25(3):283-287.
[14] Kim Yun Sook, Lee Dae-Sung, Jeong Seong-Yun, et al. Isolation and characterization of a marine algicidal bacterium against the harmful raphidophyceae Chattonella marina [J]. The Journal of Microbiology, 2009,47(1): 9-18
[15] Mitsutani A, Takesue K, Kirita M. Lysis of Skeletonema costatum by Cytophaga sp., isolated from the coastal water of the Ariake sea [J]. Nippon Suisan Gakkaishi, 1992,58(2):2158-2167.
[16] Yoshikawa K, Adachi K, Nishijima M, et a1. β–cyanoalanine produced by marine bacteria on cyanide-free medium and its specific inhibitory activity toward cyanobacteria [J]. Appl. Environ. Microbiol., 2006,66(2):718-722.
[17] 张涵之,潘伟斌,马 超.溶藻细菌L7溶藻活性代谢产物的分离鉴定 [J]. 中国环境科学, 2010,30(Suppl.):19-23.
[18] Kawano Y, Nagawa Y,Nakanishi H. Production of thiotropocin by a marine bacterium, Caulobacter sp. and its antimicroalgal activities [J]. J. Mar. Biotechnol., 1997,34(5):225-229.
[19] Berger P S,Rho J,Gunner H B. Bacterial suppression of Chlorella by hydroxylamine production [J].Water Res., 1979,13(1):267-273.
[20] Kodani S, Imoto A, Mitsutani A. Isolation and identification of the antialgal compound, harmane (1-methyl-β-carboline), produced by the algicidal bacterium, Pseudomonas sp. K44-1 [J]. J. Appl. Phycol., 2002,14(2):109-114.
[21] 刘伯雅,魏东芝,鲁思然,等.灵菌红素对有害藻类的除藻活性研究 [J]. 中国环境科学, 2010,30(4):477-482.
[22] Nobuyuki N, Kazunori N. A novel cyanobacteriolytic bacterium, Bacillus cereus isolated from a eutrophic lake [J]. Jounal of Bioscience and Bioengineering, 2003, 95(2):179-184.
[23] 关英红,马 军,雷国元,等.一株溶藻菌株的分离鉴定及溶藻特性 [J]. 环境科学学报, 2008,28(7):1288-1293.
[24] 牛丹丹,郑青松,刘兆普,等.溶藻细菌 YZ对铜绿微囊藻的溶藻特性研究 [J]. 中国环境科学, 2011,31(2):321-326
[25] 裴海燕,胡文荣,曲音波,等.一株溶藻细菌的分离鉴定及其溶藻特性 [J]. 环境科学学报, 2005,25(6):796-802.
[26] 晋 利,刘兆普,赵耕毛,等.一株溶藻细菌对铜绿微囊藻生长的影响极其鉴定 [J]. 中国环境科学, 2010,30(2):222-227.
[27] Kim Min-Ju, Jeong Seong-Yun, Lee Sang-Joon.Isolation, identification, and algicidal activity of marine bacteria against Cochlodinium polykrikoides [J]. J. Appl. Phycol., 2008,20:1069-1078.
[28] 林 伟,刘秀云.海洋微藻除菌及除菌与自然带菌微藻生长特点比较 [J]. 海洋与湖沼, 2000,11(31):647-651.
[29] 汪 辉,刘兆普,魏 微,等.一株溶藻菌的分离鉴定及其溶藻物质的研究 [J]. 中国环境科学, 2008,28(5):461-465.
Characteristics study of lysis of Microcystis aeruginosa by Bacillus.
Z5. MA Hong-rui1*, ZHANG Xin1, WANG Xiao-rong2, GENG Jin-ju2, GU Xue-yuan2(1.College of Resource and Environment, Shaanxi University of Science and Technology, Xi'an 710021, China;2.Department of Environmental Science, Nanjing University, Nanjing 210046, China). China Environmental Science, 2011,31(5):828~833
One algae-lysing bacterium strain named Z5 was isolated from an active sludge microorganism system that was artificially domesticated using Microcystis aeruginosa (PCC 7806). The bacterium strain was identified as Bacillus. by the physiological and biochemical experiment and the sequence analysis of 16S rDNA. The capability of bacterial lysis of Microcystis aeruginosa by Bacillus. Z5 was studied and the influences of the bacteria-free filtrates of Bacillus. Z5 in different growth periods and the different adding volumes of the bacteria-free filtrates of Bacillus. Z5 on the growth of Microcystis aeruginosa were investigated as well.91.36% of Microcystis aeruginosa in stationary growth period had been removed in 6 days after addition of the bacteria-free filtrate of the stationary phase bacterium(Bacillus. Z5). In certain range of addition volumes, from 4% to 12%, a positive correlation was found between algicidal activity and addition volumes of the bacteria-free filtrates of Bacillus. Z5. Microcystis aeruginosa was lysed by Bacillus. Z5 through most of the active algicidal substances which have thermal stability.
Microcystis aeruginosa;algae-lysing;Bacillus.Z5
X172
A
1000-6923(2011)05-0828-06
2010-09-27
水体污染控制与治理科技重大专项(2008ZX07316-004);欧盟科技合作项目(0911)
* 责任作者, 教授, mahr@sust.edu.cn
致谢:感谢中国水利水电科学研究院洪宇宁博士对本文实验的大力指导.
马宏瑞(1963-),男,陕西西安人,教授,博士,从事污染物环境安全与修复技术教学研究工作.发表论文68篇.

