以羧酸为酰化试剂的Friedel-Crafts酰基化反应
白国义,韩捷,闫喜龙
(1.河北大学 化学与环境科学学院,药物化学与分子诊断教育部重点实验室,河北 保定 071002;2.天津大学 化工学院,天津 300072)
学科综述
以羧酸为酰化试剂的Friedel-Crafts酰基化反应
白国义1,韩捷1,闫喜龙2
(1.河北大学 化学与环境科学学院,药物化学与分子诊断教育部重点实验室,河北 保定 071002;2.天津大学 化工学院,天津 300072)
分别介绍了以脂肪族和芳香族羧酸为酰化试剂的Friedel-Crafts酰基化反应,重点比较了各种催化剂的优缺点,指出以羧酸为酰化试剂、以环境友好的固体酸为催化剂的Friedel-Crafts酰基化反应是今后芳香酮类化合物合成的发展方向.
羧酸;Friedel-Crafts酰基化反应;芳香酮类化合物;固体酸催化剂
芳香酮类化合物是一种十分重要的精细化工产品及中间体,在香料[1]、医药[2]等领域都有着极其广泛的应用,而Friedel-Crafts酰基化(F-C酰基化)[3-6]反应是制备芳香酮类化合物最重要的方法.经典的F-C酰基化反应是以酰氯或酸酐为酰化试剂,在Lewis酸(例如,无水AlCl3、无水FeCl3、无水ZnCl2)等催化剂作用下完成的亲电取代反应.该类反应一般具有温和、高效的优点,但也存在着催化剂回收困难、易污染环境等问题.例如无水AlCl3易与产物络合,反应结束后水解会产生3倍于自身量的HCl气体,所以人们一直致力于开发绿色高效的催化剂用于F-C酰基化反应.
为实现芳香酮类化合物的绿色合成,除了催化剂的影响,酰化试剂的选择也同样非常重要.以酰氯或酸酐作为酰化试剂,不但经济成本较高,反应生成的等摩尔HCl或羧酸在污染环境的同时也显著降低了原料的原子利用率.因此,羧酸作为一种廉价、低毒和易得的原料便成为目前最理想的酰化试剂,而且它的操作和处理相对简便,最为重要的是其酰化后的副产物只有水,对环境友好.本文系统介绍了分别以脂肪族和芳香族羧酸为酰化试剂的F-C酰基化反应的研究进展,重点比较了不同催化体系的影响,指出了此研究领域的发展方向.
1 脂肪族羧酸作为酰化试剂
1.1 传统Lewis/Brönsted酸催化剂
Naeimi等[7]考察了以不同链长的羧酸为酰化试剂,SnCl4,FeCl3,ZnCl2,BiCl3和 AlCl3等Lewis酸催化苯酚及其衍生物等的F-C酰基化反应.其中,以SnCl4为例研究了对甲苯酚等不同芳香族化合物在微波条件下的乙酰化反应.结果发现,大部分底物能在微波3min内得到较高收率的邻位酰化产物;对于邻位被占据或相应位置上带有强吸电子基的化合物则不能发生F-C酰基化反应;而羧酸的链长对反应的影响不大(表1).
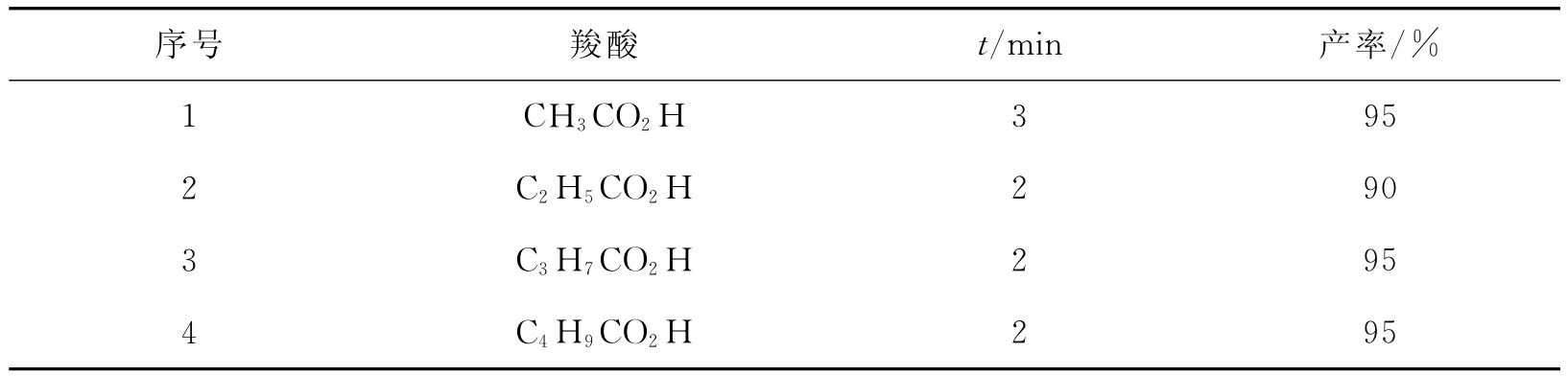
表1 SnCl4催化对甲苯酚(1mmol)与不同羧酸(1mmol)的邻位酰化Tab.1 o-Acylation of 1mmol p-cresol with 1mmol of various organic acids,in the presence of SnCl4
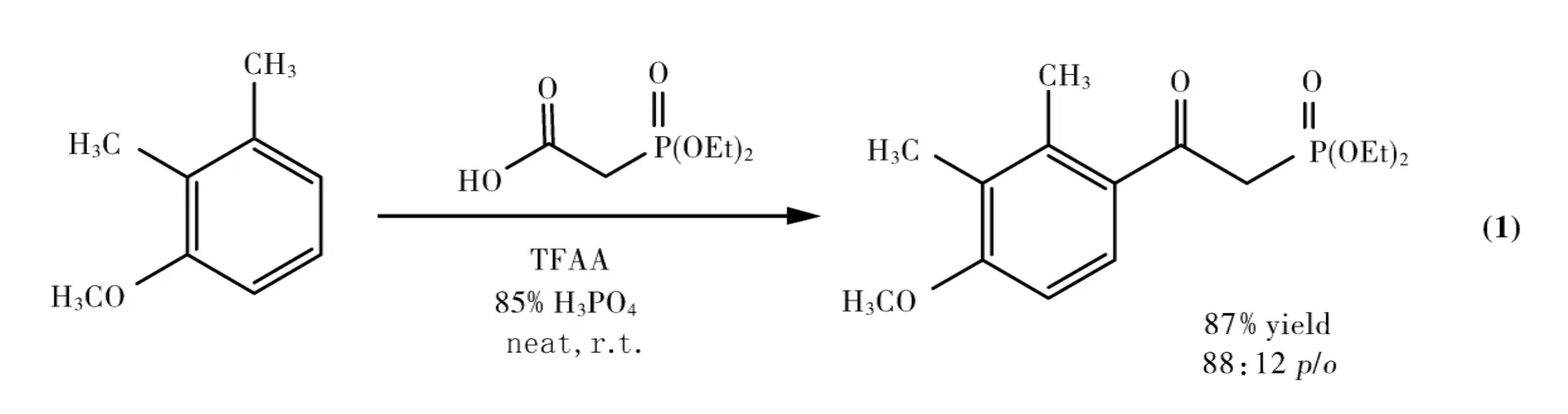
Smyth等[8]以磷酸为催化剂、乙酸为酰化试剂,在三氟乙酸酐(trifluoroacetic anhydride,TFAA)的作用下进行酰化反应.研究表明,芳环活化程度的不同对反应影响很大:苯甲醚与乙酸反应5min就能得到100%的酰化产物;而乙酸和1,2-二甲苯和甲苯的酰化反应在进行24h后分别只得到了70%和5%的产物.Luke等[9]也利用相同的催化体系成功在室温条件下合成了目标化合物(Eq.1).
1.2 固体酸催化剂
固体酸由于催化性能优良、稳定性好,已被广泛应用于F-C酰基化反应中[10].其中用于催化以羧酸为酰化试剂的F-C酰基化反应的固体酸主要有沸石分子筛、杂多酸及其盐和固体超强酸等[11-21].
1.2.1 沸石分子筛
早在20世纪80年代,Chiche等[11-12]就考察了CeNaY型沸石对甲苯和对二甲苯与脂肪族羧酸F-C酰化反应的催化作用,发现长链羧酸有利于催化酰化反应,正十二烷酸作为酰化试剂产物的收率可达96%,而乙酸几乎不能在此沸石催化下与甲苯发生酰化反应.同时,以甲苯和辛酸的酰化为模型反应,研究了不同金属改性Y型沸石的效果.结果表明,分子筛上的Brönsted酸位点是催化的活性中心;阳离子的改变对沸石酸中心的强度和分布都有重要影响,具体的活性顺序为Cr3+,Zr4+< Mg2+,Cu2+,Co2+≪ H+≪Pr3+,La3+,Gd3+,Yb3+,Ce3+.
Wang等[13-16]利用不同硅铝比的HY和HZSM-5沸石为催化剂对苯甲醚的F-C酰基化反应进行了系统研究.结果发现,催化剂上不同种类的酸中心对反应的影响很大,同时,温度也是影响反应选择性的原因之一,以HZSM-5催化剂为例:低温时O-酰化为主要反应;当温度大于150℃时,则有利于C-酰化的进行.而反应的转化率会随着碳链的增长呈先升后降的趋势,前者是因为短链羧酸沸点较低限制了反应温度,后者则是因为HZSM-5固有的孔径使形成复杂结构中间体的反应受到限制.
Wagholikar等[17]报道了长链脂肪酸(己酸、辛酸和癸酸)在BEA,FAU和 MOR 3种沸石催化下的F-C酰基化反应.以己酸酰化为例,研究人员考察了分子筛Si/Al的影响:对于BEA和FAU来说,随着Si/Al的上升,催化剂的酸度下降,酰化反应的转化率有不同程度的提高,对此,作者分析指出,由于催化剂脱铝过程而产生了一定的孔道结构,减小了反应物和产物扩散阻力,可能是反应转化率提高的原因.
Beers等[18-19]利用整体式催化反应器考察了苯甲醚和脂肪酸的F-C酰基化反应,重点研究了水热法和酸浸渍法对Hβ分子筛进行改性对酰化反应的影响.通过BET,XRF和27Al固体核磁(27Al MAS NMR)等表征说明,不同的改性方法对分子筛作用的机理不同,但是改性后更多活性位点的暴露是催化剂活性提高的根本原因.
利用微波辐射辅助的F-C酰基化反应在有机合成方法学的研究中已受到广泛重视[20].较之传统加热方式,能有效提高有机反应的效率.例如,Yamashita等[21]重点研究了以HY和Hβ(不同Si/Al)为催化剂,常规加热和微波辐射方法(190~230℃)对苯甲醚和己酸等的F-C酰基化反应的影响.结果表明,较之传统加热,微波能够大幅度提高反应收率,例如,以HY(Si/Al=30)为催化剂,在190℃下微波反应30min,苯甲醚的己酰化产物的收率为61.4%,而传统加热方法得到产物的收率仅为17.2%.
从上述研究可以看出,沸石分子筛的种类、结构、Si/Al等因素都有可能影响到其在F-C酰基化反应中的活性.沸石的酸强度有限,所以研究的反应底物一般集中在高度活化的芳环上[22].沸石独特的孔道结构,使其具有良好的催化选择性,与此同时也降低了它的普遍适用能力,但沸石种类的多样性能在一定程度上弥补这一不足.
1.2.2 杂多酸及其盐
杂多酸及其盐具有催化性能高、稳定性好、对环境无污染和“准液相”行为等特点,被广泛应用于F-C酰基化反应的研究中[23-31].
Bond等[23]详细比较了不同种类催化剂和加热方法(常规和微波)下苯甲醚和脂肪族羧酸的F-C酰基化反应.其中,H3PW12O40(HPW)的催化性能最好,在其作用下微波辐射180min,癸酸的转化率接近100%,与传统加热方式相比较提高了20%左右.然而,杂多酸比表面积小(约6m2/g)[24]和难以回收、循环利用的问题是限制其广泛应用的关键问题[25],而将其负载到载体上或制备成盐的方法是解决上述问题的有效途径.
Kaur等[26]以自制的Cs2.5H0.5PW12O40(CsPW)催化甲苯与直链羧酸的 F-C酰基化反应时发现,羧酸的疏水能力越强产物的收率越高.对此他们的解释是催化剂优先对短链羧酸的吸附阻碍了甲苯对反应活化中心的进攻.同时,CsPW的强酸性使其具有优异的催化能力.
Firouzabadi等[27-28]以AlPW12O40(AlPW)为催化剂研究了苯甲醚的酰化反应,反应1.5~10h能得到收率为85%~92%的芳香酮类化合物,并且随着羧酸链长的增加(C2~C12)反应的选择性逐渐提高(这与Kaur等[26]的研究结果相符),同时,AlPW回收套用5次催化效率没有明显的降低.此外,TFAA的加入能够大幅度提高酰化反应的效率,以苯甲醚的乙酰化为例,反应0.25h(之前3h)产物的收率就可达到94%(之前85%).
Shimizu等[29]制备了不同的磷钨酸盐 MPW(M=Ti4+,Fe3+,Sn4+,Bi3+,Ru3+)用于催化不同活化程度的芳环与直链羧酸(C6~C19)的F-C酰基化反应,相应芳酮的收率均在87%以上,但反应的时间很长,一般在24~96h之间.在这类催化剂中,FePW催化性能最佳,转化数高达2 500,并且重复套用3次,催化剂活性没有明显下降.
此外,Castro等人[30-31]比较了HPW,HPW/SiO2和CsPW催化巴豆酸等不饱和羧酸与不同程度活化芳环(甲苯、二甲苯和苯甲醚)的F-C酰基化反应.当既可以作为酰基化试剂又可以作为烷基化试剂的α,β不饱和酸作为反应物参与F-C反应时,催化剂对这组竞争反应的选择性催化和反应机理便成为研究的重点.通过对产物组成的分析发现,3种催化剂均优先催化F-C酰基化反应,并且相同条件下3种催化剂的催化活性比HY和Hβ的要高.而后续反应会因为芳环底物活化程度的不同而有所区别:甲苯和二甲苯等较为钝化的芳环生成的酰化产物会进一步发生分子内的烷基化反应;苯甲醚则会与已生成的酰化产物发生分子间的烷基化反应.
1.2.3 固体超强酸
早在20世纪70年代,人们就开始了对固体超强酸的研究,近年来固体超强酸催化剂已成功应用于以羧酸为酰化试剂的F-C酰基化反应中.例如,Kawamura等[32-33]分别讨论了不同三氟甲磺酸盐(M(OTf)x)和双(三氟甲黄酰)胺盐(M(NTf2)3)催化对二甲苯的F-C酰基化反应(Eq.2).发现在高温(250℃)下,较之Yb(NTf2)3和 Sc(NTf2)3更高的Lewis酸性,Eu(NTf2)3却表现出了最好的催化效果,相应产物的收率高达96%,这可能是由于前2个催化剂的选择性不及Eu(NTf2)3.同时,由于短链羧酸的沸点相对较低,导致反应体系的温度低,所以对二甲苯与脂肪族羧酸反应的收率会随着羧酸链长的缩短而有所降低(表2);对二甲苯对空间位阻效应十分敏感,使得带有支链的羧酸,尤其是支链占据α-位的羧酸的酰化产物的收率显著降低.
然而,溶剂的加入可以有效降低反应温度,例如Kobayashi[34]等发现以一定比例的甲苯和硝基甲烷为混合溶剂,Hf(OTf)4能在较温和的条件下催化萘酚等与脂肪族羧酸选择性的完成F-C酰基化反应(Eq.3),其中萘酚与乙酸反应的收率最高,为81%,而传统的无水AlCl3,BF3·Et2O等Lewis酸却不能催化此类酰化反应发生.
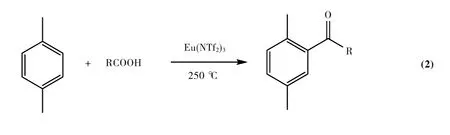
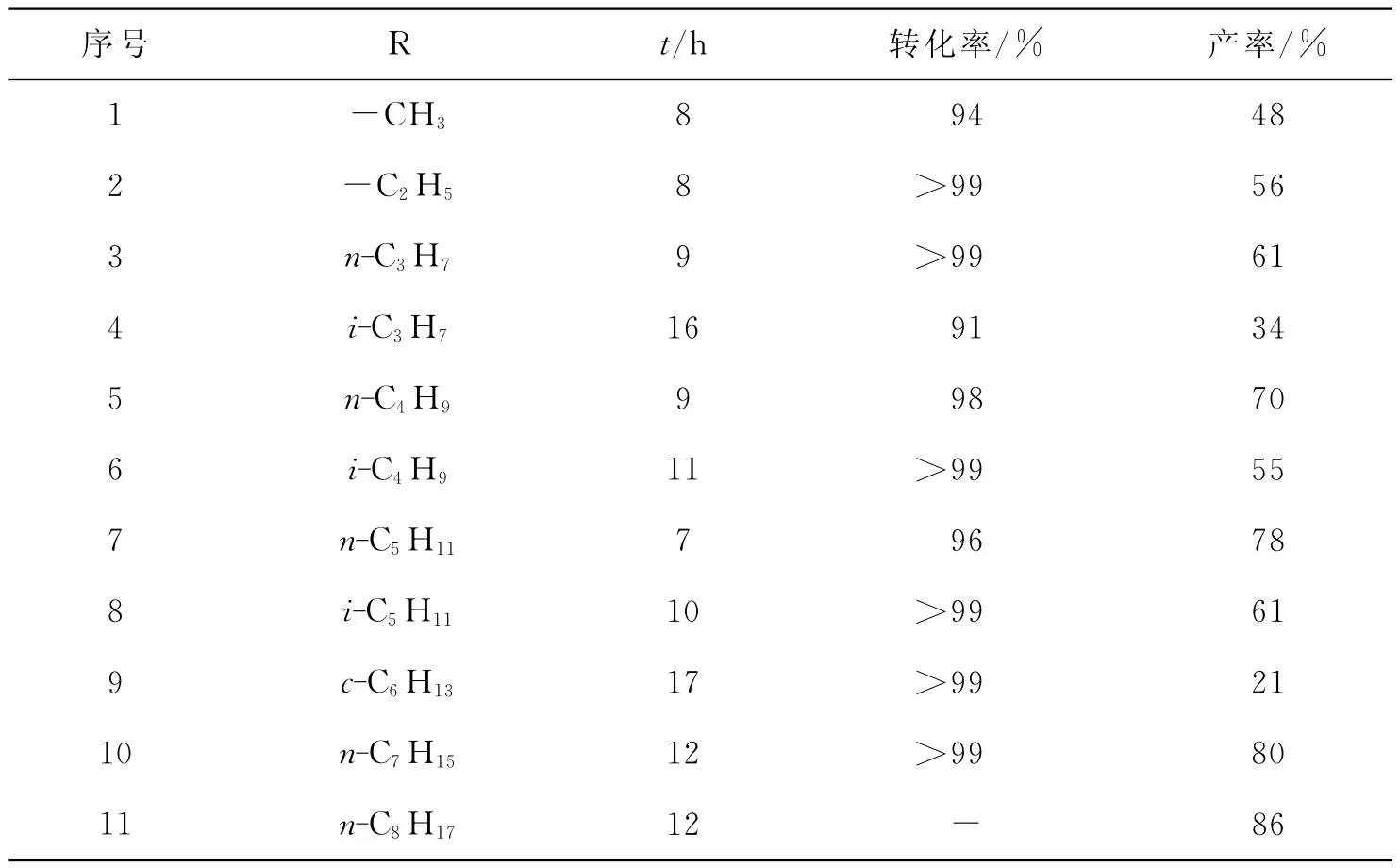
表2 Eu(NTf2)3催化下对二甲苯和脂肪族羧酸的F-C酰基化反应Tab.2 Eu(NTf2)3-catalyzed Friedel-Crafts acylation of p-xylene using various carboxylic acids

Hakala等[35]以具有高极性、高稳定性、环境友好等优点的离子液体为溶剂,以HNTf2等为催化剂,微波条件下催化合成了一系列多羟基脱氧安息香化合物(Eq.4).结果表明,在90℃下反应4min,就能得到70%~85%收率的目标产物.

同时,活化试剂的加入也能使反应在较温和条件下顺利完成.Matsushita等[36]首次以Bi(OTf)3或Sc(OTf)3为催化剂,利用乙酸与TFAA或七氟丁酸酐(Heptafluorobutyric anhydride,HFBA)原位生成混合酸酐的方法,重点考察了苯、甲苯和氯苯等不活泼芳环的F-C酰基化反应.Plaz·uk等[37-38]在TFAA的作用下,分别以TfOH,Yb(OTf)3和Hf(OTf)4为催化剂,在30℃下考察了二茂铁与不同羧酸的F-C酰基化反应,当以含有乙炔基的羧酸为酰化试剂时,产物的最高收率可达98%.
此外,Hinoa等[39]利用自制的Zr(OH)4与0.5mol/L H2SO4作用,并在650℃下焙烧得到SO42-/ZrO2固体超强酸,用以催化甲苯与乙酸的F-C酰基化反应.研究表明,在此气相(280℃)酰化反应中,乙酸的转化率随着甲苯用量的增加而升高,当n(乙酸)∶n(甲苯)=1∶32时,乙酸的转化率最高(67%),产物的选择性为82%;而适当降低温度,虽然乙酸的转化率会有所下降,但产物的选择性最高能达到100%.
2 芳香族羧酸作为酰化试剂
相对于以脂肪族羧酸为酰化试剂的F-C酰基化反应,对以芳香族羧酸为酰化试剂的F-C酰基化反应的报道较少.而文献报道的反应根据其特点可分为分子间与分子内F-C酰基化反应2种类型.
2.1 分子间F-C酰基化反应
2.1.1 传统Lewis酸催化剂
Kangani[40]等首次在室温条件下考察了以芳香族羧酸为酰化试剂的F-C酰基化反应.实验中加入的三聚氯氰(Cyanurylchloride,CYC)在活化羧酸的同时大大增强了催化剂AlCl3的催化效率,反应进行10~20min即可高选择性的以85%~95%的收率得到目标产物(Eq.5).

2.1.2 固体酸催化剂
用于催化芳香族羧酸分子间F-C酰基化反应的固体酸催化剂主要是沸石分子筛、杂多酸盐类和固体超强酸3种[21,29,36-37,41-43].Corma[41]在研究 HY 沸石催化苯乙酰氯与苯甲醚的实验中意外发现,反应生成的苯乙酸也会参与酰化反应,生成相应的芳香酮类化合物,而后他系统考察了以苯乙酸为酰化试剂,HY不同酸性和Si/Al对此F-C酰基化反应的影响,指出二者的提高均有利于对位产物的生成.Ma[42]报道了回流48h下,不同取代苯甲酸与苯甲醚在Y型沸石分子筛催化下的F-C酰基化反应(Eq.6),收率为8%~80%.通过分析不同取代基与产物收率之间的关系,认为在沸石催化剂作用下反应的机理与均相催化剂的类似:反应的速度控制步骤为亲电中间体对芳环的进攻.Yamashita等[21]报道了微波辐射下,HY(Si/Al=30)能够高效催化苯甲醚的苯甲酰化反应,在230℃下反应30min,即可得到49.1%的目标产物.

此外,Shimizu等[29]利用Ti3/4PW12O40催化甲苯与苯甲酸的F-C酰基化反应,酰化产物的收率为94%,邻/间/对位的产物比例为21∶5∶74,但是反应的时间很长,约为120h.在考察间二甲苯和苯甲酸的酰化反应时,Earle[43]分别使用Zn(NTf2)2和Co(NTf2)2为催化剂,以离子液体为反应溶剂.结果表明,反应在较低温度(140℃,与250℃[27]相比)下反应48h可分别得到40%和82%收率的产物.
2.1.3 负载型金属氧化物催化剂
Hajipour等[44-45]制备了负载型金属氧化物催化剂P2O5/Al2O3和P2O5/SiO2,高通量地完成了一系列芳香族羧酸(苯甲酸、对硝基苯甲酸、对甲基苯甲酸、对硝基苯乙酸、苯丙酸等)与多种芳环底物的F-C酰基化反应.其中苯丙酸与苯甲醚的反应,在2种催化体系下均高选择性地得到80%和86%对位酰化产物,没有分子内F-C酰基化反应的发生.进一步的研究表明:将P2O5负载于Al2O3或SiO2上之所以能够大幅提高P2O5的催化性能,是因为载体使得P2O5分散更均匀.这2种催化体系具有反应条件温和、高效、适用性广和易操作等优点,但生成的副产H3PO4可能会污染环境.
2.2 分子内F-C酰基化反应
分子内F-C酰基化反应一般指苯丙酸等含有3个及以上碳侧链的芳香族羧酸发生自身酰化成环的反应,文献报道的催化体系以固体酸催化剂为主[46-52].2.2.1 沸石分子筛
Badri[46]等介绍了一种在Ce3+交换的Y型沸石分子筛催化下,芳香族羧酸发生分子内F-C酰基化反应高效的合成二酮(Eq.7)的方法.这种方法反应条件相对温和,避免了以往制备二酮过程中高压釜等设备的使用.在实验过程中,作者首先尝试了Lewis酸(SnCl4,TiCl4,FeCl3,AlCl3等)和质子酸(聚磷酸,H2SO4,HF)等催化剂,但均以失败告终.对此,作者分析指出这些催化剂虽然是制备一元酮的良好催化剂,但由于一次酰化后生成的羰基使芳环活性降低,从而妨碍了其进一步生成二酮的反应.最终,作者以CeY为催化剂,在CHCl3回流下反应7~12h,以54%~72%的收率成功制备了二酮类化合物,并指出酰化试剂分子大小是这个反应的关键,在一定范围内,分子越大产物的收率越高.

Hiroki[47]等研究了以1,2-二氯苯为溶剂,微波辐射条件下不同芳香族羧酸为酰化试剂的分子内F-C酰基化反应,分别考察了不同种类催化剂、加热方式和溶剂对反应的影响,研究表明,以Hβ(Si/Al=37)为催化剂,在190~200℃下微波辐射5~10min就可以高通量的合成一系列芳香酮类化合物,收率最高可达95%.2.2.2 杂多酸
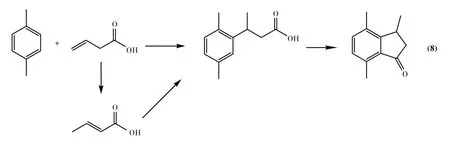
Kamiya等人[48]考察了不饱和羧酸——乙烯基乙酸与对二甲苯的反应,发现产物是经由F-C烷基化和酰基化串联反应的结果(Eq.8).在所考察的催化剂中,H4SiW12O40/SiO2的效果最好,并且H4SiW12O40的负载量对反应有着至关重要的影响,负载量由20%提高到40%时,芳酮的收率从19%提高到44%,而纯H4SiW12O40催化此反应时产物的收率仅为5%.
2.2.3 固体超强酸
1991年Yamato[49]等人报道了固体超强酸Nafion-H(质量分数为30%)催化多种芳香族羧酸进行分子内F-C酰基化反应的研究结果,以二甲苯为溶剂回流反应6~12h,可以7%~88%的收率得到一系列环合产物,只有苯丙酸在此条件下反应没有得到目标产物.
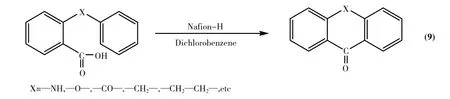
Olah[50]等人考察了邻位带有不同芳基取代基的苯甲酸在Nafion-H催化下的环合反应(Eq.9).发现以邻间-二氯苯为溶剂时具有无副反应、高收率(82%~95%)、催化剂易于回收、应用范围广和反应时间短(1~3h)等优点.在研究不同链长的苯基脂肪酸的影响时发现,相对于以苯丁酸和苯戊酸为酰化试剂时90%和83%的收率,苯丙酸的环合反应最困难,仅能生成大约5%的产物.
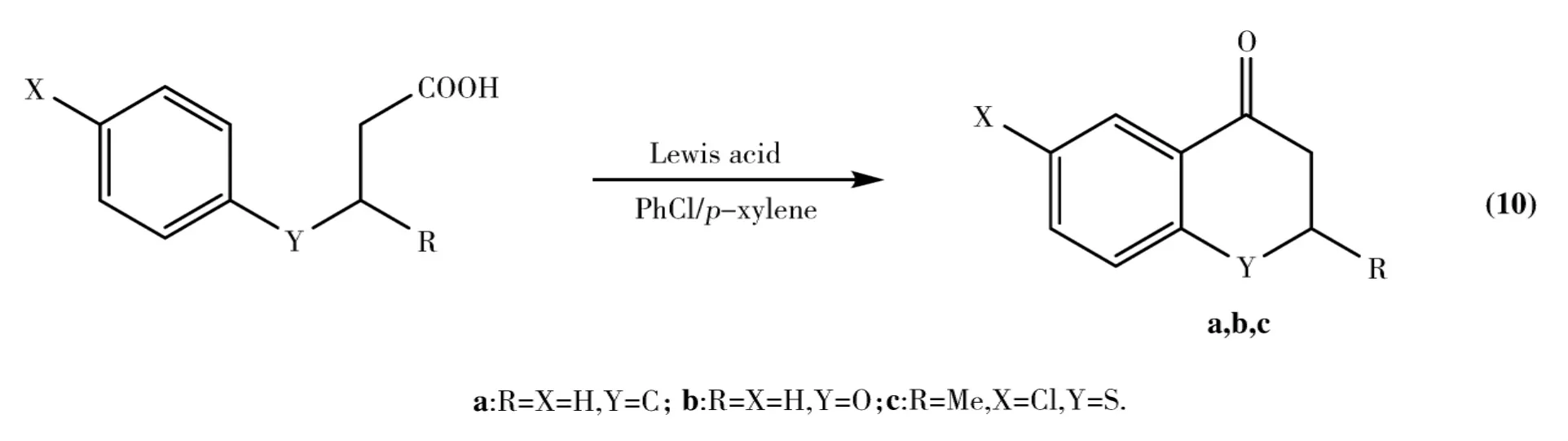
从上面2个实例中可以看出,利用分子内F-C酰基化反应制备含有五元环的化合物远比制备含有六元环的化合物困难得多.因此,Cui[51-52]研究小组利用不同的催化剂,对含有六元环和五元环化合物的制备进行了系统地研究.他们考察了不同 M(OTf)x(M=Bi,Ga,In和稀土金属)和Bi(NTf2)3作用下苯丁酸及相关化合物的分子内F-C酰基化反应(Eq.10).实验表明,在180~200℃下Bi(NTf2)3表现出了优异的活性,对于带有甲氧基等活泼基团的反应底物,环合产物的收率为84%~99%;即使是带有致钝基团(如三氟甲基等)的反应底物,产物收率也不低于46%.此外,Bi(NTf2)3在催化合成化合物b和c时,分别得到了80%和87%的收率.
3 总结与展望
综上所述,以羧酸为酰化试剂的F-C酰基化反应是制备芳香酮类化合物的一种非常有前途的合成方法.一系列的催化剂已经被开发并应用于此反应,其中,对固体酸催化剂的研究较为广泛,该类催化剂具有较高的催化活性和选择性,产物易于分离,而且清洁无污染,属于绿色化学化工,是该领域的发展方向.但由于羧酸自身的反应活性较低,当前的研究仍存在着反应时间较长、反应温度较高和催化剂适用范围小等问题,距离实际应用仍存在着一定的差距.
因此,通过对反应机理的深入研究,开发出新型、高效的固体酸催化剂,并结合能够循环利用的绿色活化试剂,以增强羧酸在F-C酰基化反应中的活性,提高原料的转化率和目标产物的选择性,并加强对催化剂稳定性的研究,从而建立一种芳香酮类化合物的绿色合成方法并将其应用于工业化生产,无疑具有重要的理论和实际意义.
[1]BEJBLOVÁM,PROCHÁZKOVÁD,EJKA J.Acylation reactions over zeolites and mesoporous catalysts[J].Chem-SusChem,2009,2(6):486-499.
[2]戴立言,王晓钟,陈奇英.异黄酮类化合物的合成新方法[J].有机化学,2008,28(12):2126-2131.
[3]白国义,杨永会,王磊.酸改性的Hβ分子筛催化合成乙酰基吡咯[J].河北大学学报:自然科学版,2011,31(2):48-52.
[4]BAI Guoyi,DOU Haiyang,QIU Mande,et al.Friedel-Crafts hydroxyalkylation of anisole over oxalic acid modified Hβzeolite[J].Catalysis Letters,2010,138(3-4):187-193.
[5]FILLION E,FISHLOCK D.Total synthesis of(+/-)-taiwaniaquinol B via a domino intramolecular Friedel-Crafts acylation/carbo-nyl alpha-tert-alkylation reaction[J].Journal of the American Chemical Society,2005,127(38):13144-13145.
[6]BEJBLOVÁM,PROCHÁZKOVÁD,CˇEJKA J.Acylation reactions over zeolites and mesoporous catalysts[J].Chem-SusChem,2009,2(6):486-499.
[7]NAEIMI H,MORADI L.Facile,convenient and regioselective direct ortho-acylation of phenols and naphthols catalyzed by Lewis acids under free solvent and microwave conditions[J].Journal of Molecular Catalysis A:Chemical,2006,256(1-2):242-246.
[8]SMYTH T P,CORBY B W.Toward a clean alternative to Friedel-Crafts acylation:in situ formation,observation,and reaction of an acyl bis(trifluoroacetyl)phosphate and related structures[J].Journal of Organic Chemistry,1998,63(24):8946-8951.
[9]LUKE G P,SEEKAMP C K,WANG Z Q,et al.An efficient preparation ofβ-aryl-β-ketophosphonates by the TFAA/H3PO4-mediated acylation of arenes with phosphonoacetic acids[J].Journal of Organic Chemistry,2008,73(16):6397-6400.
[10]SARTORI G,MAGGI R.Use of solid catalysts in Friedel-Crafts acylation reactions[J].Chemical Reviews,2006,106:1077-1104.
[11]CHICHE B,FINIELS A,GAUTHIER C,et al.Friedel-Crafts acylation of toluene andp-xylene with carboxylic acids catalyzed by zeolites[J].Journal of Organic Chemistry,1986,51(11):2128-2130.
[12]GAUTHIER C,CHICHE B,FINIELS A,et al.Influence of acidity in Friedel-Crafts acylation catalyzed by zeolites[J].Journal of Molecular Catalysis,1989,50(2):219-229.
[13]WANG Qilong,MA Yudao,JI Xingdong,et al.Regioselective acylation of anisole with carboxylic acids over HZSM-5 catalyst[J].Journal of the Chemical Society,Chemical Communications,1995,22:2307-2308.
[14]MA Yudao,WANG Qilong,JIANG Wei,et al.Friedal-Crafts acylation of anisole over zeolite catalysts[J].Applied Catalysis A:General,1997,165(1-2):199-206.
[15]WANG Qilong,MA Yudao,ZUO Bojun.Zeolite-catalyzed Friedel-Crafts reaction of anisole with carboxylic acids[J].Chinese Journal of Catalysis,1996,17(5):425-428.
[16]WANG Qilong,MA Yudao,JI Xingdong,et al.Zeolite-catalyzed Friedel-Crafts acylation of aromatic:I.synthsis of 4-acyl anisole with a HY catalyst[J].Chinese Chemical Letters,1996,7:99-102.
[17]WAGHOLIKAR S G,NIPHADKAR P S,MAYADEVI S,et al.Acylation of anisole with long-chain carboxylic acids over widepore zeolites[J].Applied Catalysis A:General,2007,317(2):250-257.
[18]BEERS A E W,NIJHUIS T A,KAPTEIJN F,et al.Zeolite coated structures for the acylation of aromatics[J].Microporous and Mesoporous Materials,2001,48(1-3):279-284.
[19]BEERS A E W,BOKHOVEN J A,LATHOUDER K M,et al.Optimization of zeolite Beta by steaming and acid leaching for the acylation of anisole with octanoic acid:a structure-activity relation[J].Journal of Catalysis,2003,218(2):239-248.
[20]张祯,麻远,赵玉芬.微波辅助的Friedel-Crafts反应[J].化学进展,2008,20(2-3):312-317.
[21]YAMASHITA H,MITSUKURA Y,KOBASHI H.Microwave-assisted acylation of aromatic compounds using carboxylic acids and zeolite catalysts[J].Journal of Molecular Catalysis A:Chemical,2010,327(1-2):80-86.
[22]袁冰,乔卫红,李宗石,等.沸石分子筛在Friedel-Crafts酰基化反应中的应用[J].化学进展,2005,17(4):686-691.
[23]BOND G,GARDNER J A,MCCABE R W,et al.Friedel-Crafts acylation reactions using heterogeneous catalysts stimulated by conventional and microwave heating[J].Journal of Molecular Catalysis A:Chemical,2007,278(1-2):1-5.
[24]OKUHARA T,MIZUNO N,MISONO M.Catalytic chemistry of heteropoly compounds[J].Advances in Catalysis,1996,41:113-252.
[25]KOZHEVNIKOV I V.Friedel-Crafts acylation and related reactions catalysed by heteropoly acids[J].Applied Catalysis A:General,2003,256(1):3-18.
[26]KAUR J,KOZHEVNIKOV I V.Efficient acylation of toluene and anisole with aliphatic carboxylic acids catalyzed by heteropoly salt Cs2.5H0.5PW12O40[J].Chemical Communications,2002(21):2508-2509.
[27]FIROUZABADI H,IRANPOOR N,NOWROUZI F.Solvent-free Friedel-Crafts acylation of aromatic compounds with carboxylic acids in the presence of trifluoroacetic anhydride and aluminum dodecatungstophosphate[J].Tetrahedron Letters,2003,44(28):5343-5345.
[28]FIROUZABADI H,IRANPOOR N,NOWROUZI F.Aluminum dodecatungstophosphate(AlPW12O40)as a non-hygroscopicLewis acid catalyst for the efficient Friedel-Crafts acylation of aromatic compounds under solvent-less conditions[J].Tetrahedron,2004,60(48):10843-10850.
[29]SHIMIZU K,NIIMI K,SATSUMA A.Polyvalent-metal salts of heteropolyacid as efficient heterogeneous catalysts for Friedel-Crafts acylation of arenes with carboxylic acids[J].Catalysis Communications,2008,9(6):980-983.
[30]CASTRO C,PRIMO J,CORMA A.Heteropolyacids and large-pore zeolites as catalysts in acylation reactions usingα,β-unsaturated organic acids as acylating agents[J].Journal of Molecular Catalysis A:Chemical,1998,134(1-3):215-222.
[31]CASTRO C,CORMA A,PRIMO J.On the acylation reactions of anisole usingα,β-unsaturated organic acids as acylat-ing agents and solid acids as catalysts:a mechanistic overview[J].Journal of Molecular Catalysis A:Chemical,2002,177(2):273-280.
[32]KAWAMURA M,CUI D M,HAYASHI T,et al.Lewis acid-catalyzed Friedel-Crafts acylation reaction using carboxylic acids as acylating agents[J].Tetrahedron Letters,2003,44(42):7715-7717.
[33]KAWAMURA M,CUI D M,SHIMADA S.Friedel-Crafts acylation reaction using carboxylic acids as acylating agents[J].Tetrahedron,2006,62(39):9201-9209.
[34]KOBAYASHI S,MORIWAKI M,HACHIYA I.Catalytic direct C-acylation of phenol and naphthol derivatives using carboxylic acids as acylating reagents[J].Tetrahedron Letters,1996,37(24):4183-4186.
[36]MATSUSHITA Y,SUGAMOTO K,MATSUI T.The Friedel-Crafts acylation of aromatic compounds with carboxylic acids by the combined use of perfluoroalkanoic anhydride and bismuth or scandium triflate[J].Tetrahedron Letters,2004,45(24):4723-4727.
[39]HINOA M,ARATAB K.Acylation of toluene with acetic and benzoic acids catalysed by a solid superacid in a heterogeneous system[J].Journal of the Chemical Society,Chemical Communications,1985(3):122-123.
[40]KANGANI C O,DAY B W.Mild,efficient Friedel-Crafts acylations from carboxylic acids using cyanuric chloride and AlCl3[J].Organic Letters,2008,10(13):2645-2648.
[41]CORMA A.Acylation of anisole by acyl chlorides or carboxylic acids over acid zeolites[J].Applied Catalysis,1989,49(1):109-123.
[42]MA Y D,WANG Q L,JIANG W,et al.Friedal-Crafts acylation of anisole over zeolite catalysts[J].Applied Catalysis A:General,1997,165(1-2):199-206.
[43]EARLE M J,HAKALA U,MCAULEY B J,et al.Metal bis{(trifluoromethyl)sulfonyl}amide complexes:highly efficient Friedel-Crafts acylation catalysts[J].Chemical Communications,2004(12):1368-1369.
[44]ZAREII A,HAJIPOUR A R,KHAZDOOZ L.Friedel-Crafts acylation of aromatic compounds with carboxylic acids in the presence of P2O5/SiO2under heterogeneous conditions[J].Tetrahedron Letters,2008,49(47):6715-6719.
[45]HAJIPOUR A R,ZAREII A,KHAZDOOZ L,et al.Simple and efficient procedure for the Friedel-Crafts acylation of aromatic compounds with carboxylic acids in the presence of P2O5/Al2O3under heterogeneous conditions[J].Synthetic Communications,2009,39(15):2702-2722.
[46]BADRI R,TAVAKOLI L.Friedel-Crafts acylation of aryl-substituted carboxylic acids catalyzed by zeolite[J].Journal of Inclusion Phenomena and Macrocyclic Chemistry,2003,45(1-2):41-43.
[47]HIROKI K,HATORI M,YAMASHITA H,et al.Efficient synthesis of 1-tetralones from 4-arylbutyric acids by combined use of solid acid catalysts and microwave irradiation[J].Chemistry Letters,2008,37(3):320-321.
[48]KAMIYA Y,OOKA Y,OBARA C,et al.Alkylation-acylation ofp-xylene withγ-butyrolactone or vinylacetic acid catalyzed by heteropolyacid supported on silica[J].Journal of Molecular Catalysis A:Chemical,2007,262(1-2):77-85.
[49]YAMATO T,HIDESHIMA C,PRAKASH G K S,et al.Organic reactions catalyzed by solid superacids.5.Perfluorinatedsulfonic acid resin(Nafion-H)catalyzed intramolecular Friedel-Crafts Acylation[J].Journal of Organic Chemistry,1991,56(12):3955-3957.
[50]OLAH G A,MATHEW T,FARNIA M,et al.Nafion-H catalysed intramolecular Friedel-Crafts acylation:formation of cyclic ketones and related heterocycles[J].Synlett,1999,7:1067-1068.
[51]CUI Dongmei,ZHANG Chen,KAWAMURA M,et al.Synthesis of 1-indanones by intramolecular Friedel-Crafts reaction of 3-arylpropionic acids catalyzed by Tb(OTf)3[J].Tetrahedron Letters,2004,45(8):1741-1745.
[52]CUI Dongmei,KAWAMURA M,SHIMADA S,et al.Synthesis of 1-tetralones by intramolecular Friedel-Crafts reaction of 4-arylbutyric acids using Lewis acid catalysts[J].Tetrahedron Letters,2003,44(21):4007-4010.
Friedel-Crafts Acylation of Aromatic Compounds with Carboxylic Acids as Acylating Agents
BAI Guo-yi1,HAN Jie1,YAN Xi-long2
(1.Key Laboratory of Medicinal Chemistry and Molecular Diagnosis of Ministry of Education,College of Chemistry and Environmental Science,Hebei University,Baoding 071002,China;2.School of Chemical Engineering and Technology,Tianjin University,Tianjin 300072,China)
Friedel-Crafts acylation with both aliphatic and aromatic carboxylic acids as acylating agents are reviewed and the characters of different catalysts are emphatically compared.Friedel-Crafts acylation with carboxylic acids as acylating agents and solid acids as catalysts are believed as the trend for the green synthesis of aromatic ketones.
carboxylic acids;Friedel-Crafts acylation;aromatic ketones;solid acids catalysts
O 625.42
A
1000-1565(2011)06-0658-10
2011-08-30
国家自然科学基金资助项目(20806018);河北省自然科学基金资助项目(B2011201017);河北省教育厅自然科学研究重点计划资助项目(ZD200910)
白国义(1975- ),男,回族,河北沧州人,博士,河北大学教授,博士生导师,主要从事精细化工和催化领域的研究.
E-mail:gybai@hbu.edu.cn
梁俊红)

