非均相Fenton反应催化剂的制备及其催化性能
杨春维,王 栋,王 坤,王 丹,高 尚
(1.大连理工大学 环境学院,辽宁 大连 116024;2.吉林师范大学 环境工程学院,吉林 四平 136000)
非均相Fenton反应催化剂的制备及其催化性能
杨春维1,2,王 栋1,王 坤2,王 丹2,高 尚2
(1.大连理工大学 环境学院,辽宁 大连 116024;2.吉林师范大学 环境工程学院,吉林 四平 136000)
以柱状颗粒活性炭为催化剂载体,采用浸渍法负载Fe2+,制备了非均相Fenton反应催化剂,并将其用于催化亚甲基蓝溶液脱色反应。实验结果表明:制备催化剂时最佳FeSO4浓度为16.7 mmol/L;在非均相Fenton反应催化剂加入量为4 g、亚甲基蓝溶液初始浓度为0.028 mmol/L、亚甲基蓝溶液体积为250 mL、体系pH为3、H2O2溶液浓度为46.6 mmol/L、反应温度为20℃、搅拌转速为75 r/min、反应时间为30 min的条件下,亚甲基蓝溶液脱色率可达96.0%;反应过程中Fe2+浓度稳定维持在1.5 mmol/L左右;重复使用4次的催化剂仍具有很好的催化活性,亚甲基蓝溶液脱色率仍可达到94.0%。
芬顿试剂;非均相催化剂;活性炭;亚甲基蓝;脱色;废水处理
Fenton试剂高级氧化技术因其高效、选择性低、工艺相对成熟、具有经济优势等引起国内外学者的广泛重视[1-7]。但投加Fe2+后会增大处理后废水的色度,且系统pH升高后还会产生大量的铁污泥,增加处理成本。近年来,有很多关于类Fenton试剂高级氧化技术的报道[8-11],如何将 Fenton反应中的Fe2+固定化,以非均相催化剂的形式参与反应,成为该工艺研究和应用的重点之一。非均相Fenton反应催化剂与传统的均相Fe2+相比具有催化剂易分离、易回收、能循环利用、Fe2+持续释放维持反应速率稳定等优点,可以节约运行成本,同时也防止了大量铁污泥的产生。虽然目前已有许多关于非均相Fenton反应催化剂的制备和应用的报道[12-15],但由于存在催化剂制备方法复杂、催化活性低、粒径小且不易分离、回收率低、机械强度低、铁溶出较多等缺点,因此非均相Fenton反应催化剂仍有待进一步深入研究。
本工作以柱状颗粒活性炭(简称活性炭)为催化剂载体,采用浸渍法负载Fe2+,制得非均相Fenton反应催化剂,并将其用于催化甲基蓝溶液脱色反应。该制备方法简单易行,催化活性较高,是非均相Fenton反应催化剂制备和应用的一条新途径。
1 实验部分
1.1 试剂和仪器
活性炭:直径2 mm,长2~10 mm;FeSO4·7H2O、NaOH、邻菲啰啉、亚甲基蓝、H2O2(质量分数30%)、HCl、浓H2SO4(质量分数98%)均为分析纯;去离子水。
BP210s型电子天平:上海精天电子仪器有限公司;PHS-3C型酸度计:江苏江分电分析仪器有限公司;UV-265型紫外分光光度计:日本岛津公司;78-1型恒温磁力搅拌器:江苏省金坛市宏华仪器厂;KQ-200KDE型超声波清洗器:广东昆山超声仪器有限公司。
1.2 催化剂的制备
活性炭预处理:向装有活性炭的烧杯中加入HCl溶液(质量分数10%),放入超声波清洗器中超声清洗30 min,用去离子水清洗至中性,放入烘箱在105~108℃条件下烘干备用。
称取一定量的预处理后的活性炭置于烧杯中,加入一定浓度的FeSO4溶液,用NaOH溶液调节溶液pH为7,在20℃条件下于磁力搅拌器上以75 r/min的转速搅拌2 h,过滤后置于烘箱中,于105~108℃条件下烘干,得到非均相Fenton反应催化剂。
1.3 实验方法
将非均相Fenton反应催化剂在1 mmol/L的亚甲基蓝溶液中浸泡至吸附平衡,然后将4 g吸附饱和的催化剂加入到250 mL初始质量浓度为0.028 mmol/L的亚甲基蓝溶液中,用质量分数10%的H2SO4溶液和质量分数10%的NaOH溶液调节溶液pH,在磁力搅拌器上以75 r/min的转速搅拌,在一定温度条件下连续滴加一定浓度的H2O2溶液,开始计时,每隔2.5 min取样测定溶液亚甲基蓝的浓度和Fe2+的浓度,计算亚甲基蓝溶液脱色率。
用非均相Fenton反应催化剂催化降解亚甲基蓝30 min后,将催化剂滤出,在105~108℃条件下烘干,不做其他处理再次加入亚甲基蓝溶液中进行Fenton反应,考察其重复利用的可行性。
1.4 分析方法
采用邻菲啰啉分光光度法测定Fe2+浓度;采用分光光度法测定亚甲基蓝溶液浓度[16]。
2 结果与讨论
2.1 FeSO4溶液浓度对亚甲基蓝溶液脱色率的影响
在溶液pH为3、H2O2溶液浓度为46.6 mmol/L、反应温度为20℃的条件下,FeSO4溶液浓度对亚甲基蓝溶液脱色率的影响见图1。由图1可见,亚甲基蓝在反应2.5 min时已迅速降解,表明非均相Fenton反应催化剂具有较高的催化活性。由图1还可见:随制备催化剂时FeSO4溶液浓度增大,亚甲基蓝溶液的脱色率增加;当 FeSO4溶液浓度从4.8 mmol/L增至16.7 mmol/L时,反应10 min时亚甲基蓝溶液的脱色率从83.6%增加到93.4%;继续增加FeSO4溶液浓度时,亚甲基蓝溶液的脱色率反而下降。这是因为过多的Fe2+会使生成的羟基自由基湮灭。故本实验制备催化剂时最佳FeSO4溶液浓度为16.7 mmol/L。
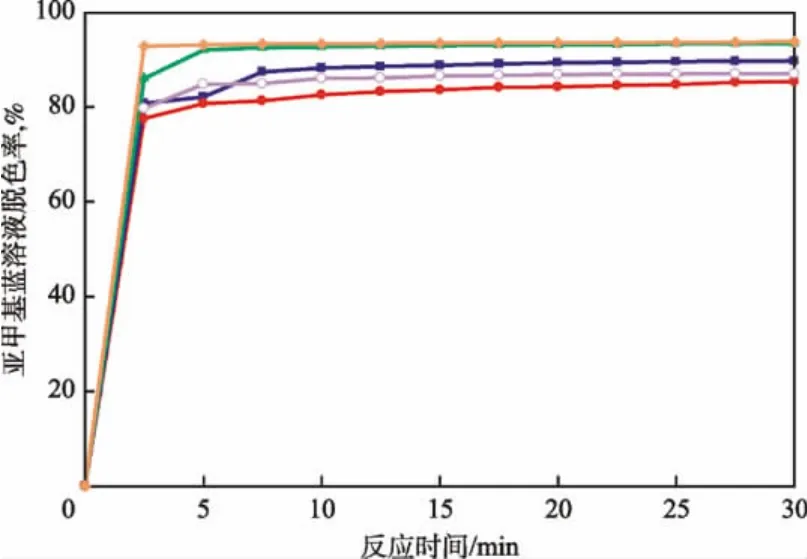
图1 FeSO4溶液浓度对亚甲基蓝溶液脱色率的影响
2.2 H2O2溶液浓度对亚甲基蓝溶液脱色率的影响
在溶液pH为3、反应温度为20℃、反应时间为30 min的条件下,H2O2溶液浓度对亚甲基蓝溶液脱色率的影响见图2。
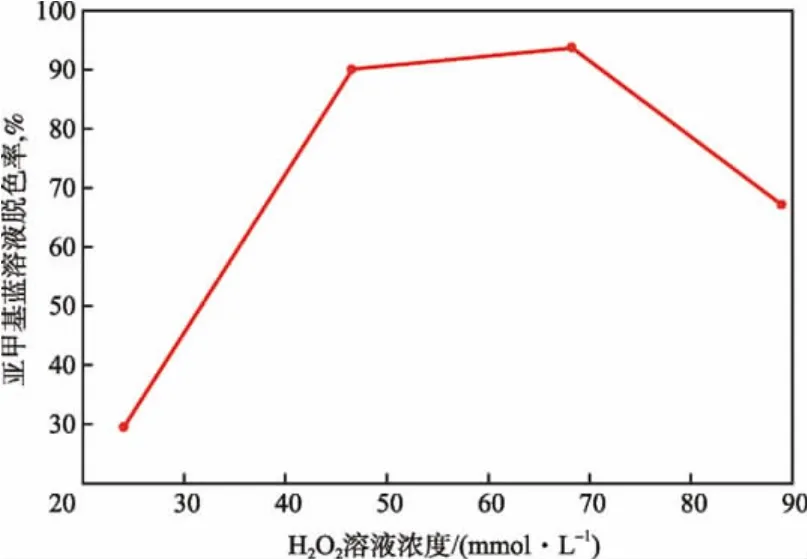
图2 H2O2溶液浓度对亚甲基蓝溶液脱色率的影响
由图2可见:随H2O2溶液浓度增大,亚甲基蓝溶液的脱色率呈现先升高后降低的趋势;当H2O2溶液浓度从24.1 mmol/L增加到68.3 mmol/L时,亚甲基蓝溶液脱色率从 29.1%增加到 93.6%;当H2O2溶液浓度继续增加至89.0 mmol/L时,亚甲基蓝溶液脱色率降至66.9%。这是因为过量的H2O2也会使羟基自由基发生无效反应,生成氧化活性较低的·HO2自由基。本实验最佳H2O2溶液浓度为68.3 mmol/L。
2.3 溶液pH对亚甲基蓝溶液脱色率的影响
在H2O2溶液浓度为68.3 mmol/L、反应温度为20℃、反应时间为30 min的条件下,溶液pH对亚甲基蓝溶液脱色率的影响见图3。由图3可见:当溶液pH由2升至3时,亚甲基蓝溶液脱色率从93.9%增加到96.0%;当溶液pH由3升至5时,亚甲基蓝溶液脱色率逐渐下降至91.0%。显然,酸性条件下有利于亚甲基蓝降解,因为酸性条件下,Fe2+以离子形态存在,更容易催化H2O2迅速转化为·OH[17-18]。虽然溶液 pH 为 3时,亚甲基蓝溶液脱色率最高,但溶液pH在2~5范围内,亚甲基蓝溶液脱色率均可达到91.0%以上,这表明非均相Fenton反应催化剂催化亚甲基蓝溶液脱色时可在较宽的pH范围内适用,溶液pH的调节不必过于苛刻。

图3 溶液pH对亚甲基蓝溶液脱色率的影响
2.4 反应温度对亚甲基蓝溶液脱色率的影响
在H2O2溶液浓度为68.3 mmol/L、溶液 pH为3、反应时间为30 min的条件下,反应温度对亚甲基蓝溶液脱色率的影响见图4。由图4可见,反应温度从20℃提高到60℃,亚甲基蓝溶液脱色率变化并不明显,仅从96.0%提高到98.0%。因此,反应温度可以不作为实验调节参数加以考虑。
2.5 反应过程中Fe2+浓度的变化
Fenton反应要求水相中有一定的Fe2+浓度,而传统均相Fenton反应过程中Fe2+的浓度下降很快[19],生成的Fe3+浓度较高,最终会形成大量的铁污泥。本实验通过测定最佳条件下溶液中Fe2+浓度的变化,考察了非均相Fenton反应催化剂在反应过程中持续供给Fe2+的能力。

图4 反应温度对亚甲基蓝溶液脱色率的影响
在 FeSO4溶液浓度为 16.7 mmol/L、H2O2溶液浓度为68.3 mmol/L、溶液 pH为3、反应温度为20℃的条件下,反应过程中Fe2+浓度的变化见图5。由图5可见,Fe2+浓度随反应的进行发生波动,总体趋势是逐渐下降,因为有部分Fe2+转化成了Fe3+。反应 30 min后,Fe2+浓度仍维持在 1.5 mmol/L左右,表明本非均相Fenton反应催化剂有被持续循环利用的可能性。

图5 反应过程中Fe2+浓度的变化
2.6 催化剂重复使用次数对亚甲基蓝溶液脱色率的影响
在 FeSO4溶液浓度为 16.7 mmol/L、H2O2溶液浓度为68.3 mmol/L、溶液 pH为3、反应温度为20℃、反应时间为30 min的条件下,催化剂重复使用次数对亚甲基蓝溶液脱色率的影响见图6。由图6可见,重复使用4次的催化剂仍具有很好的催化效果,亚甲基蓝溶液脱色率仍可达到94.0%。可见本实验制备的非均相Fenton反应催化剂可多次重复使用。

图6 催化剂重复使用次数对亚甲基蓝溶液脱色率的影响
3 结论
a)采用FeSO4溶液浸渍颗粒活性炭制备了非均相Fenton反应催化剂,制备催化剂时最佳FeSO4溶液浓度为16.7 mmol/L。
b)非均相Fenton反应催化剂催化亚甲基蓝溶液脱色反应的最佳工艺条件为:H2O2溶液浓度68.3 mmol/L,溶液 pH 3,反应时间30 min。
c)反应过程中Fe2+浓度一直稳定在1.5 mmol/L左右,表明非均相Fenton反应催化剂在反应过程中能持续供给Fe2+。
d)重复使用4次的催化剂仍具有很好的催化效果,亚甲基蓝溶液脱色率仍可达到94.0%。非均相Fenton反应催化剂可多次重复使用。
[1] 陈文松,韦朝海.Fenton氧化—混凝法处理印染废水的研究[J].工业水处理,2004,24(4):39-41.
[2] Lin Hongsheng,Jiang Dechang.Fenton oxidation and sequencing batch reactor(SBR)treatments of highstrength semiconductor[J].Wastewater Desalination,2003,154(3):107 -116.
[3] Montserrat P,Francesc T,Xavier D,et al.Fenton and photo-Fenton oxidation of textile effluents[J].Water Res,2002,36(11):2703 -2710.
[4] 陈传好,谢波,任源,等.Fenton试剂处理废水中各影响因子的作用机制[J].环境科学,2000,21(3):93 -96.
[5] 翟建,姜春华.ASBR—SBR—Fenton氧化工艺处理均苯四甲酸生产废水[J].化工环保,2011,31(2):144-147.
[6] 王喜全,胡筱敏,马英群,等.内电解—Fenton氧化法降解活性艳蓝 X-BR机理[J].化工环保,2010,30(6):482-486.
[7] 丁巍,尚艳.光助Fenton氧化法降解水中的活性艳蓝KN -R[J].化工环保,2009,29(3):212 -215.
[8] Engwall M A,Pignatello J J.Degradation and detoxification of wood preservatives creosote and pentachlorophenol in water by the photo-Fenton reaction[J].Water Res,1999,33(5):1751 -1758.
[9] 雷乐成.光助Fenton氧化处理PVA退浆废水的研究[J].环境科学学报,2000,20(2):210 -215.
[10] 陈琳,杜瑛,雷乐成.UV/H2O2光化学氧化降解对氯苯酚废水的反应动力学[J].环境科学,2003,24(5):106-109.
[11] Zhou Minghua,Yu Qinghong.Electro-Fenton method for the removal of methyl red in an efficient electrochemical system[J].Sep Purif Technol,2007,57(2):380-387.
[12] Sabhi S,Kiwi J.Degradation of 2,4-dichlorophenol by immobilized iron catalysts[J].Water Res,2001,35(8):1994-2002.
[13] He Ju,Tao Xia,Ma Wanghong,et al.Heterogeneous photo-Fenton degradation of an azo dye in aqueous H2O2/iron oxide dispersions at neutral pH[J].Chem Lett,2002,(1):86 -87.
[14] 陈芳艳,倪建玲,唐玉斌.非均相UV/Fenton氧化法降解水中六氯苯的研究[J].环境工程学报,2008,2(6):765-770.
[15] Kasiri M B,Aleboyeh H,Aleboyeh A.Degradation of acid Blue 74 using Fe-ZSM zeolite as a heterogeneous photo-Fenton catalyst[J].Appl Catal B:Environ,2008,84(1 -2):9 -15.
[16] 杨春维,王栋.Fenton试剂对亚甲基蓝氧化褪色的反应动力学实验研究[J].环境技术,2004.22(6):24-29.
[17] Lin Shenghai.Fenton process for treatment of desizing wastewater[J].Water Res,1997,31(8):2050 -2056.
[18] Feng Jiyun,Hu Xiaojun,Yue Po Lock.Effect of initial solution pH on the degradation of OrangeⅡusing clay-based Fe nanocomposites as heterogeneous photo-Fenton catalyst[J].Water Res,2006,40(4):641 -646.
[19] 杨春维,翟文慧,才杨,等.Fenton高级氧化工艺降解苯酚模拟废水的动力学实验研究[J].黑龙江环境通报,2009,33(3):70 -74.
Preparation and Activity of Heterogeneous Catalyst for Fenton Reaction
Yang Chunwei1,2,Wang Dong1,Wang Kun2,Wang Dan2,Gao Shang2
(1.School of Environmental Science and Technology,Dalian University of Technology,Dalian Liaoning 116024,China;
2.College of Environmental Engineering,Jilin Normal University,Siping Jilin 136000,China)
The heterogeneous catalyst for Fenton reaction was prepared by loading columnar granular activated carbon with Fe2+by dipping method,and was used to catalyze the decolorization reaction of methylene blue solution.The experimental results show that:The optimum FeSO4concentration for catalyst preparation is 16.7 mmol/L;Under the conditions of heterogeneous catalyst dosage 4 g,initial methylene blue concentration 0.028 mmol/L,methylene blue solution volume 250 mL,system pH 3,H2O2solution concentration 46.6 mmol/L,reaction temperature 20 ℃,stirring speed 75 r/min and reaction time 30 min,the decolorization rate of the methylene blue solution can reach 96.0%;The Fe2+concentration remains 1.5mmol/L approximately during the reaction process;The activity of the catalyst after 4 times of reuse is still good with 94.0%of decolorization efficiency.
Fenton reagent;heterogeneous catalyst;activated carbon;methylene blue;decolorization;wastewater treatment
X703
A
1006-1878(2011)06-0557-04
2011-06-08;
2011-07-20。
杨春维(1976—),男,辽宁省辽阳市人,博士生,讲师,主要研究方向为废水治理技术开发与机理研究。电话 13694001403,电邮 chunwei_yang@jlnu.edu.cn。
吉林省教育厅“十二五”科学技术研究项目(吉教科合字[2011]第417号)。
(编辑 祖国红)

