高密度LiFePO4 的前躯体FePO4 的制备及性能测试
常建勇,张金玉,冯 婷
(1.河南省医药学校,河南 开封 475001;2.南阳经济贸易学校,河南 南阳 472000;3.河南师范大学 化学与环境学院,河南 新乡 453007)
0 引言
锂离子电池作为一种高性能的可充绿色电源,近年来已在各种便携式电子产品和通讯工具中得到广泛应用[1-5]。 其中,新型电极材料特别是正极材料的研制极为关键。 橄榄石结构的LiFePO4来源广泛、价格低廉、无环境污染、材料热稳定性好,且理论比容量高,因而成为最具开发和应用潜力的新一代锂离子电池正极材料[6-7]。
然而,LiFePO4正极材料有两个明显的缺点:一是电导率低(10-9S/m),锂离子迁移速率慢。 二是堆积密度低, 目前商业化产品的振实密度低只有约1.2g/cm3左右,导致体积比容量低。 这两个缺点阻碍了该材料的实际应用[8-9]。 因此,提高橄榄石结构LiFePO4的电导率和它的体积比容量,对其实际应用具有决定意义。 导电性差,可借助体相掺杂高价金属阳离子[10]或表面包覆导电材料[11-12]予以补救,然而,堆积密度低的缺点却至今未能解决。
本试验以3 价铁为铁源,尝试不同铁盐和合成工艺来制备FePO4前驱体。 对终点pH 值及干燥方式等因素对振实密度的影响进行了分析,得出了最佳工艺合成条件。 接着,以自制的FePO4为原料在N2和H2的保护下,采用Li2CO3作为锂元素的供给体,同时添加葡萄糖,作为碳源和还原源,与自制的FePO4进行高温固相反应,以制得高密度的LiFePO4。
1 实验过程
1.1 前驱体FePO4 的制备
将3 价铁盐和H3PO4按一定比例配制成混合溶液,在水浴温度50℃和一定的搅拌速度下,通过恒流泵将一定浓度的氨水浓液以一定的速度滴入混合溶液中,在滴加过程中控制pH 值。 滴加完成后,继续搅拌30 分钟,反应完后,得到FePO4胶体溶液,经过抽滤、压滤、干燥、水洗、二次干燥、过筛,最后得到FePO4前驱体。
1.2 LiFePO4 的制备
将自制的FePO4前驱体与Li2CO3按一定的摩尔比例混合(1∶1.05),按照LiFePO4的化学计量比加蔗糖(质量分数过量5%),把混合物放进氧化铝坩埚内, 在箱式51 段程序控温炉(合肥科晶GS1300程序控温管式炉)内,采用分段式控温方式,制备锂离子电池正极材料LiFePO4。
1.3 振实密度的测量
将少量待测的FePO4或LiFePO4粉末倒入校准过的容量为5ml 的小量筒中,将量筒在桌面上轻轻振动,直到样品体积不再减少为止,记下毫升数。 将粉末倒出,在电子天平上称其质量。 振实密度即为其质量与体积比。
1.4 性能表征
采用D-8 型X 射线衍射仪(德国布鲁克公司),采集条件为:Cu 靶辐射,石墨单色器,工作电压35KV,工作电流30mA,采用步进扫描方式,扫描速度为0.02°/s,步进时间为0.4s,扫描范围为10°-80°。 在此条件下, 对FePO4或LiFePO4粉末样品进行物相分析。 采用KYKY——2800 型扫描电子显微镜,观察正极材料的表观形貌。
1.5 电性能测试
将LiFePO4粉末、乙炔黑和PVDF 以质量比80∶10∶10 混合,加入一定量的溶剂NMP,充分混匀,均匀涂抹到铝箔上,经干燥后,冲压成圆形正极片,真空干燥后,于充满氩气的手套箱内,以金属锂做负极材料,Celgard2400 聚丙烯为孔隔膜,1mol/LLiPF6/DEC+DMC+EC(体积比1∶1∶1)为电解液,组装成CR 2016 型扣式模拟电池。 使用LAND 电池测试系统进行电性能测试,电压范围为2.5V~4.2V。
2 结果分析
2.1 影响前驱体振实密度的因素
2.1.1 不同三价铁盐对FePO4振实密度的影响
在其他条件相同的情况下,采用不同的三价铁盐和H3PO4混合溶液进行实验,结果如表1 所示。
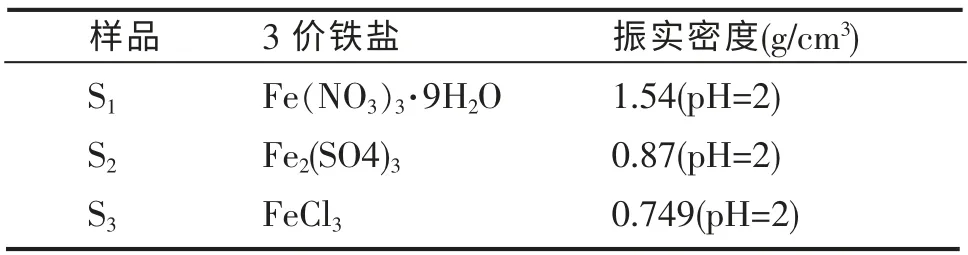
表1 不同3 价铁盐样品的振实密度Table 1 Tap density of 3 different Fe(Ⅲ) solution samples
从表1 可以看出,以Fe(NO3)3·9H2O 为铁源合成的FePO4前驱体密度最高,而Fe2(SO4)3和Fe2(SO4)3密度较低。 这可能是由于FePO4胶体在溶液中的生成受到阴离子大小和浓度的影响。
2.1.2 浓度对FePO4振实密度的影响
在其他条件相同的情况下,采用不同浓度的Fe(NO3)3·9H2O 和H3PO4混 合 溶 液 进 行 实验,浓度以Fe3+为标准,结果如下:
什么叫回归分析?它研究的是什么问题?选修2-3对回归的来历做了简单介绍,但对于第二个问题的本质语焉不详,教师在课堂上最好做适当的补充.
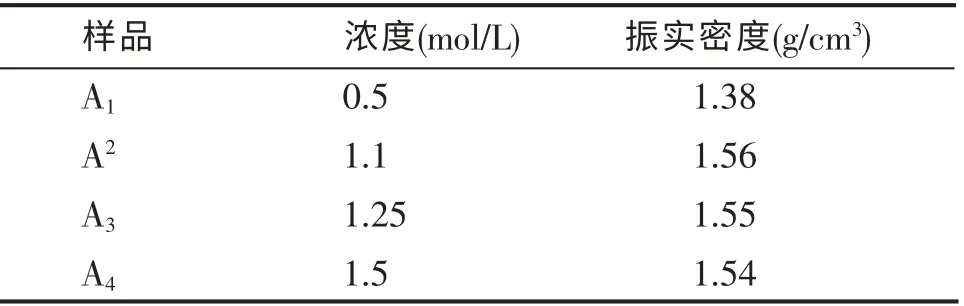
表2 不同浓度样品的振实密度Table 2 Tap density of different concentration samples
从表2 可以看出,随着Fe3+的浓度的增大,振实密度有增大的趋势,但当浓度大于1.25mol/L 时,对于振实密度的提高并没有太大的影响,Fe3+浓度为1.1mol/L 时,振实密度最高。这可能是因为胶体成核速度与生长速度的关系对振实密度影响很大。 当浓液浓度大时,浓液的过饱和程度较大,Fe3+会立即与PO43-生成FePO4胶体,生成的晶核较多。 此时晶体的成核速度大于生长速度,晶核生长被抑制,生成的晶粒细小,晶格缺陷增多,造成无序堆积,因此生成的FePO4振实密度低。 而当浓度较小时,成核速度远远小于生长速度,单位体积的晶核较少,使晶粒过于粗大,晶粒之间堆积不致密,振实密度也低。 只有在适当的浓度范围内提高晶体的生长速度,使成核速度与生长速度协调一致,有效控制FePO4的结晶速度和结晶度,才能生成结构、形貌较好、振实密度高的FePO4。
2.1.3 终点pH 值对FePO4振实密度的影响
终点pH 值对FePO4振实密度影响最大。 当pH>2.2 时,会生成Fe(OH)3红褐色杂质[13-14];pH 过低,又容易使Fe 不能完全沉淀,使产量较低,因此选择终点范围应为1.2~2.0。 在其他条件相同的情况下,使用相同浓度的Fe(NO3)3·9H2O 和H3PO4混合溶液进行实验,选择不同终点pH 值,结果如表3 所示。
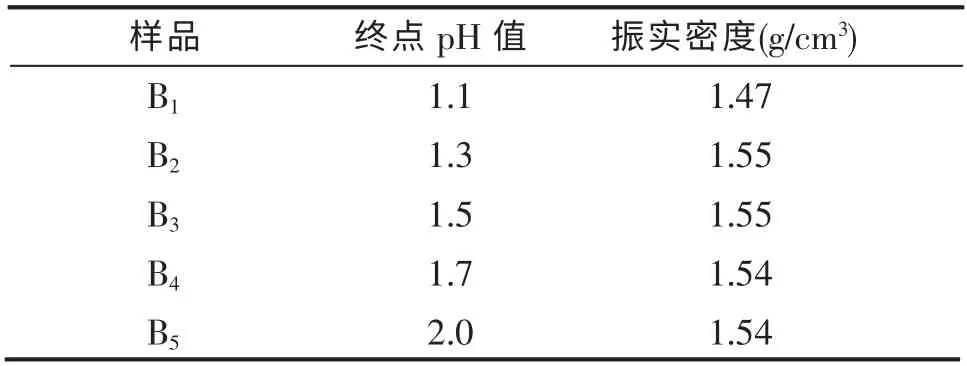
表3 不同pH 样品的振实密度Table 3 Tap density of different pH value samples
从表3 可以看出,随着pH 值的增大,振实密度有增大的趋势,但当pH 大于1.3 时,对于振实密度的提高没有太大的影响。
3.1.4 烘干方式对FePO4振实密度的影响
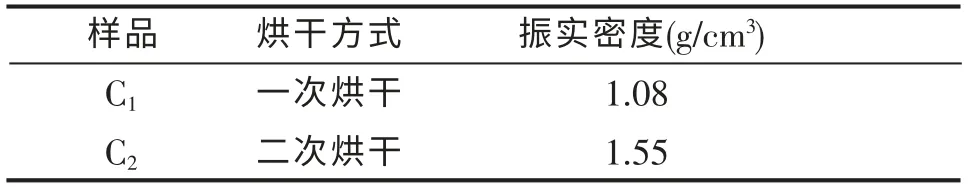
表4 不同烘干方式样品的振实密度Table 4 Tap density of different drying method samples
由表4 可以看出,二次烘干比一次烘干制备出的产品振实密度高。 原因是采用一次烘干化学沉淀法,在制备FePO4的过程中,生成的FePO4胶体难以抽滤,烘干后胶体微粒团聚严重、结构松散,使其振实密度降低。 而第二次烘干法可以使其紧结,在残余母液的环境下进一步晶化,同时,第二次烘干破坏了胶体结构,便于形成更好的晶体,因而提高了振实密度。
2.1.5 XRD 分析
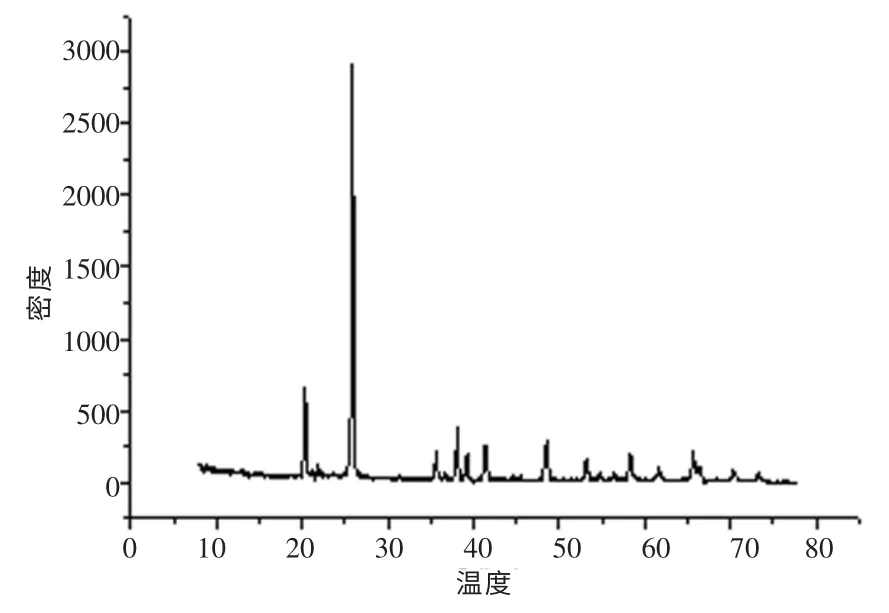
图1 FePO4 的XRD 图Fig.1 XRD sketch of FePO4
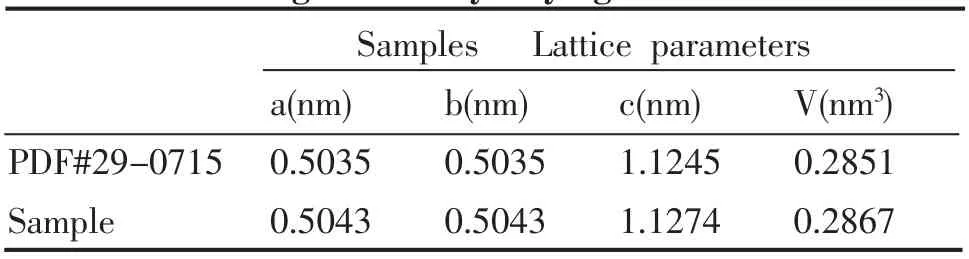
表5 采用二次干燥法制得的样品FePO4 的XRD 参数Table 5 Sample FePO4’s XRD parameters of using secondary drying method
2.1.6 扫描电镜
图2 为前驱体FePO4的扫描电镜图。 由图2 可知,样品粒径较小且颗粒分布均匀,有助于振实密度的提高。

图2 前驱体FePO4 粉末的扫描电镜图Fig.2 Scanning electron micrograph of FePO4 powder
总之,通过二次干燥的化学沉淀法,可以制备出锂离子正极材料前躯体FePO4。 当温度保持在50℃、浓度为1.1mol/L,并且控制pH=1.3 时,可得到密度为1.55g/cm3的锂离子正极材料前躯体FePO4。
2.2 LiFePO4 的合成与性能
将Li2CO3、葡萄糖与自制的FePO4前驱体按一定的摩尔比例混合研磨,在Ar2(95%)和H2(5%)的气氛下,经两个恒温阶段烧结(500℃恒温6h、750℃恒温18h), 得到含碳量3.0wt%的LiFePO4/C 样品。图3 为LiFePO4的XRD 图谱。
通过掺碳,用自制的高密度FePO4前躯体合成出了高密度的LiFePO4/C 复合材料。 通过实验,可以看出,LiFePO4/C 的振实密度与含C 量成反比。 而材料的比容量和导电性与含C 量成正比。 这就需要一个平衡点,能够同时兼顾材料的比容量、导电性和振实密度。
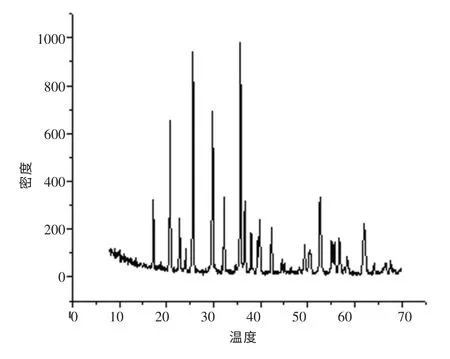
图3 LiFePO4 的XRD 图谱Fig.3 XRD maps of LiFePO4
实验结果表明,合成出的产品(3wt%)的振实密度高达2.14g/cm3,在2.5~4.2V 范围内,以0.1C 的电流放电,首次放电容量为121.5mAh/g,体积比容量达到260.0mAh/V,并表现出较好的高倍率放电性能。说明掺入适量的C,能很好地提高物质的导电系数,有利于减少电极极化,提高倍率性能。
3 结论
采用二次烘干工艺,可以制备出振实密度高的FePO4。 前躯体的密度对于最终产物LiFePO4/C 的振实密度影响很大。 高密度前驱体合成出的LiFePO4/C 的振实密度高达2.14g·cm-3,大大超出了文献报道的LiFePO4/C 的振实密度(一般仅为1.0~1.5g·cm-3)。样品的振实密度大小对于提高电池比体积容量影响较大。 而同样的活性物质利用率,振实密度越大,电池的体积比容量就越大。
[1] T N agaura, K T ozawak. Lithium ion rechargeable battery[J]. Prag. Batts.Sol. Cells, 1990, 9:209-210.
[2] J R Dahn , U V Sacken , A H Juzkow. Electrochemical science and technology rechargeable LiNiO2/Carbon cells[J]. J Elctrochem Soc 1991,138(8):2207-2211.
[3] A K Padhi, K S Nanjundawamy, J B Goodenough.Phospho -olivine as positive electrodematerials for rechargeable lithium batteries [J]. J Electrochem Soc,1997,144(4):1188-1194.
[4] A K Padhi, K S Nanjundawamy, C Masquelier, et al.Effect of structure on the redox couple in iron phosphates [J]. J Electrochem Soc, 1997, 144 (5): 1609-1613.
[5] Akahashi M, Tobishima S, Takei K, et al. Reaction behavior of LiFePO4as a cathode material for rechargeable lithium batteries [J]. Solid State Ionics,2002,148(3-4):A 283-A289.
[6] Macneil D D, Zhonghu L, Zhaohui C et al.A comparison of the electrode / electrolyte reaction at elevated temperatures for various lithium ion battery cathodes[J].Power Sources,2002,108(1-2):A8-A14.
[7] Shoufeng Y,Peter Y Z,Whittingham M S,et al.Hydrothermal .synthesis of lithium ion phosphate cathodes[J] .Electrochem Commut, 2001,3(9):A505-A508.
[8] Takahashi M, Ohtsuka H, Akuto K, et al. Conflrmation of long-term cyclability and high thermal stability of LiFePO4 in prismatic lithium-ion cells[J]. Electrochem.Soc,2005,152:A899-A904.
[9] A K Padhi, K S Nanjundawamy, J B Goodenough.Phospho -olivine as positive electrode materials for rechargeable lithium batteries[J]. J Electrochem Soc,1997,144(4):1188-1194.
[10] Chung S Y, Bloking J T, Chiang Y M. Electronically conductive phospho-olivine as lithium storage electrode[J]. Nature Materials,2002:1123-1128.
[11] Chen Z H, Dahn J R. Reducing carbon in LiFePO4/C composite electrodes to maximize specific energy,volumetric energy, and tap density[J]. Electrochem Soc.2002,149(9):A1184-A1189.
[12] Park K S, Son J T, Chung H T, et al. Surface modification by silver coating for improving electrochemi cal properties of LiFePO4[J]. Solid State Communications,2004,129:311-314.
[13] 朱元保, 张传福. 电化学数据手册[M]. 长沙: 湖南科学技术出版社,2001:273-274.
[14] 于春洋,夏定国,赵煜娟等. 球形的制备及电化学性能[J]. 电池,2006,36(6):432-434.
[15] 苏元智,徐徽,陈白珍等. 微波法合成LiFePO4的研究[J]. 电池,2006,36(1):43-44.

