一种简单的人脐带间充质干细胞分离培养方法
庞荣清 何洁 李福兵 赵晶 阮光萍 王桂华 瞿良 李黎 蔡学敏 潘兴华
自从Friedenstein等[1]首次从骨髓中分离和描述了成纤维细胞样细胞(即间充质干细胞)以来,骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMMSC)成为研究最多的成体干细胞之一。但BMMSC存在采集骨髓数量有限、捐献者需要承受一定的痛苦,且细胞活性受捐献者年龄影响等局限性[2-3]。随着干细胞研究的不断深入,需要寻找间充质干细胞的更好来源。McElreavey等[4]首次发现人脐带组织中存在大量间充质干细胞以来,人们采用组织贴块法和酶消化法分离到了大量脐带间充质干细胞(umbilical cord mesenchymal stem cell,UCMSC),大大促进了UCMSC的研究,但这些方法还需进一步改进完善。本研究尝试建立一种更加简单的分离方法,更方便地获得UCMSC。
材料与方法
一、主要试剂和设备
含2 m mol/L的Glutamine的DMEM/F12培养液、胎牛血清(fetal bovine serum,FBS)和0.25﹪trypsin-EDTA均为美国Gibco公司生产;流式单抗CD29-FITC、CD34-FITC、CD44-FITC、CD90-FITC和CD105-FITC均为美国NeoMarkers公司生产;成脂、成骨和成软骨分化诱导试剂盒均是美国Cyagen公司产品;倒置相差显微镜下为日本NIKON公司生产;流式细胞仪为美国BD公司生产。
二、细胞培养
经医院伦理委员会的批准,在征得产妇和家属知情同意的情况下,在解放军昆明总医院妇产科产房取健康足月生产的新生儿脐带(乙型肝炎病毒、丙肝病毒感染、人类免疫缺陷病毒、TP-SX、巨细胞病毒检测阴性),放入盛有100ml生理盐水的洁净玻璃瓶中,于1h之内送至细胞工程实验室,在无菌条件下参照Bruyn等[5]报道的方法分离培养UCMSC。即用含双抗的生理盐水反复冲洗脐带以弃除血渍,先将脐带剪断为5 cm长的小段,用小剪刀反复剪碎脐带为糊状,并转移至细胞培养瓶中,加入少许含有10﹪FBS的DMEM/F12使其均匀分布,于5﹪CO2、37℃的培养箱中静置培养,2 d后小心吸弃培养液,加入新鲜培养液继续培养。在显微镜下观察细胞生长增殖情况并拍照。待细胞生长至80﹪~90﹪融合状态时,用0.25﹪trypsin-EDTA消化传代细胞,记为第一代细胞(P1)。
三、细胞免疫表型的流式细胞分析
消化收集生长良好的第二代细胞(P2),生理盐水洗涤2次,分成每管含5×105细胞,分别加入 CD29-FITC、CD34-FITC、CD44-FITC、CD90-FITC、CD105-FITC 和同型对照10μl,4℃避光孵育30min,磷酸盐缓冲液洗涤后,用流式细胞仪检测分析抗原标志的表达。
四、细胞分化潜能的鉴定
根据成脂、成骨和成软骨分化诱导试剂盒说明书介绍的方法,消化收集生长良好的P2细胞进行体外分化实验,然后分别进行油红O染色、茜素红染色和阿新蓝染色鉴定。
结 果
一、UCMSC的分离培养
采用剪碎脐带为糊状直接加入含10﹪FBS的DMEM/F12贴壁培养的方法,7 d以后可以在光镜下观察到少数长梭形贴壁生长的细胞或从小组织块周围长出少许贴壁生长的细胞,15 d可见大量长梭形细胞散开分布或围绕组织块呈克隆状生长。Trypsin-EDTA消化传代后大量细胞均匀分布生长至大部分融合状态时,可见大量成纤维细胞样细胞呈漩涡状生长,呈现明显的方向性,显示与BMMSC类似的典型形态特征(图1),初步判断这些贴壁生长的成纤维细胞样细胞就是间充质干细胞,即UCMSC。
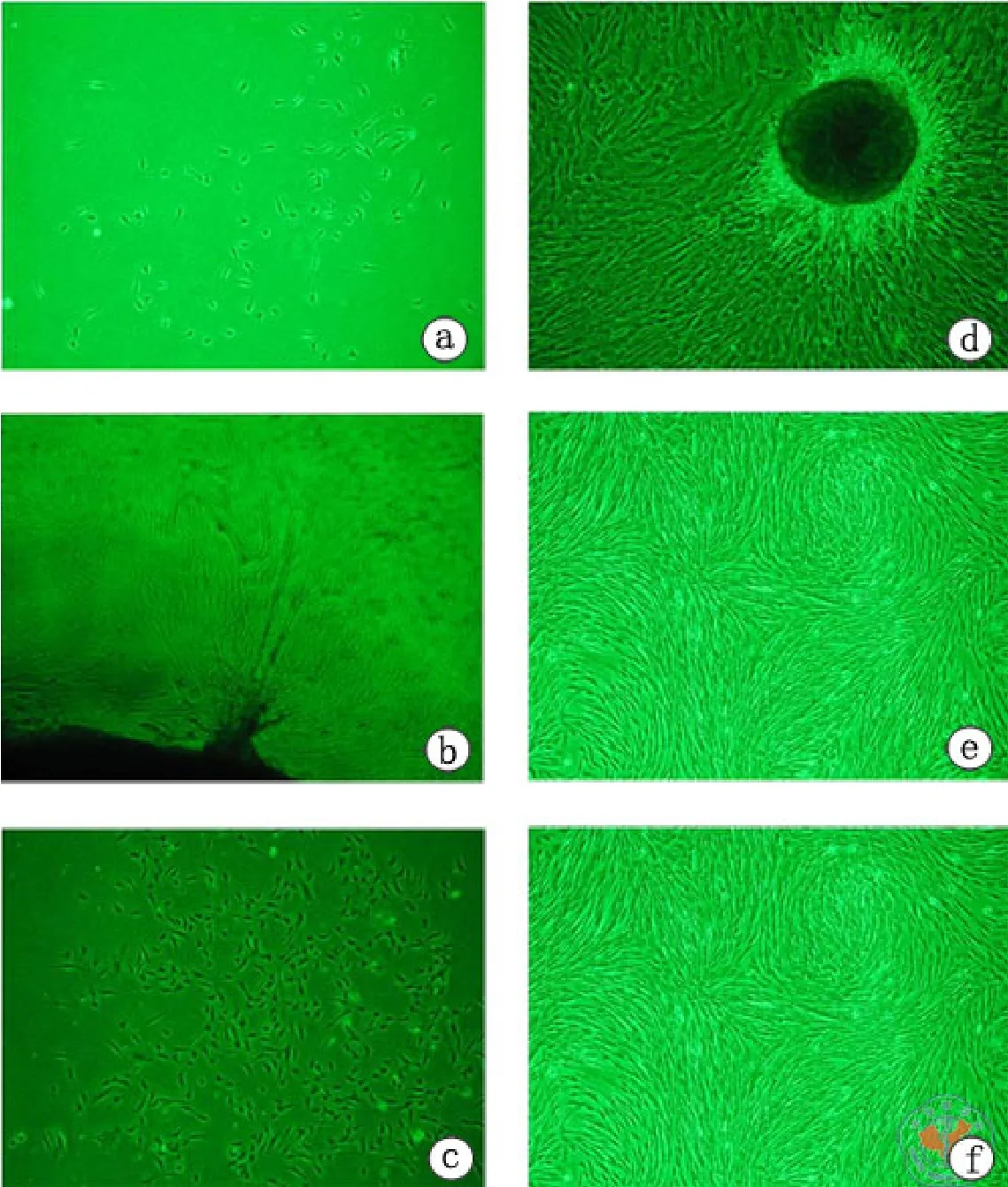
图1 UCMSC在光镜下的形态特征
二、细胞免疫表型分析
为了明确脐带来源贴壁生长细胞是否与BMMSC 具有相同的抗原标志表达,将上述原代培养细胞消化传代 2次,扩增培养至足够数量的P2细胞,收集后加入CD29、CD34、CD44、CD90和CD105流式单抗进行染色,并用流式细胞仪检测。结果显示,上述细胞不表达CD34,而高表达CD29、CD44、CD90和CD105(图2),即表达了BMMSC的常见抗原标志。
三、分化潜能鉴定
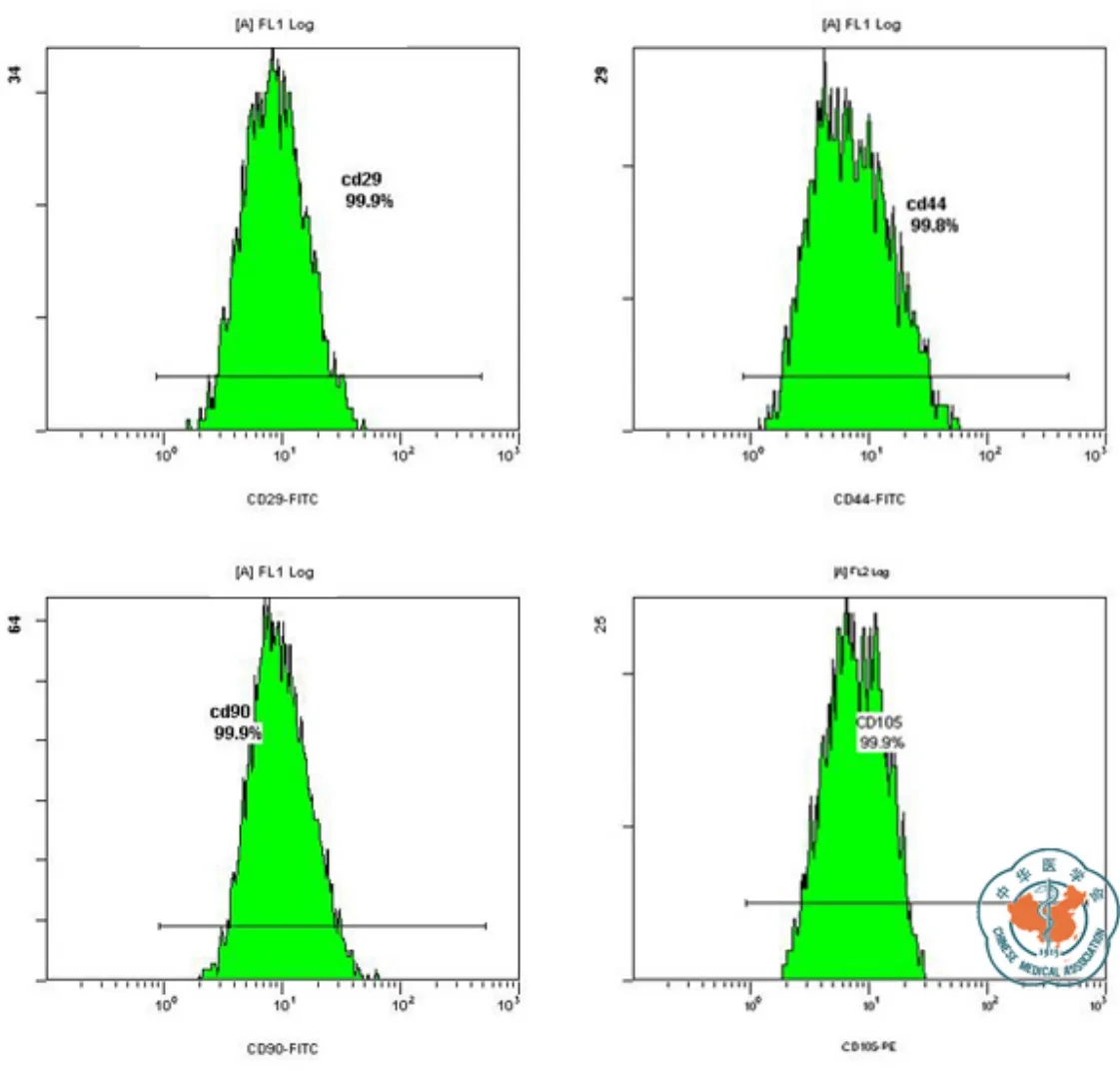
图2 UCMSC的免疫表型分析

图3 UCMSC的诱导分化鉴定
为了鉴定来源于脐带的这些贴壁生长的成纤维细胞样细胞的体外分化能力,取P2细胞,做成细胞爬片,加入成脂分化诱导液培养28 d后,可在光镜下观察到大量脂滴的分泌,小心吸弃油培养液并用4﹪多聚甲醛固定后加入油红O染色,可见脂滴被染成红色(图3a),即成脂分化阳性;同样,做成细胞爬片,加入成骨分化诱导液培养21d后,可在光镜下观察到白色结节,即钙质沉积结节,吸弃培养液后加入茜素红染色,可见钙质结节被染成红色(图3b),即成骨分化阳性;采用细胞团块培养方法,加入成软骨分化诱导液培养14 d后,吸弃培养液并用4﹪多聚甲醛固定后,石蜡包埋做病理切片,脱蜡后加入阿新蓝染色,可见大量氨基葡聚糖被染成蓝色(图3c),即成软骨分化阳性。这些结果表明来源于脐带的这些贴壁生长的细胞具备向脂肪、骨、软骨分化的能力,即具有类似于BMMSC的体外分化潜能。
讨 论
脐带是连接胎儿脐部与胎盘之间的索状结构组织,在胎儿正常分娩时被当作废弃物丢弃。利用脐带来分离扩增间充质干细胞属于变废为宝,几乎不涉及伦理道德问题,取材十分方便,可以在短时间内获得足够数量的细胞;其次,UCMSC比较原始,增殖分化能力强,不像BMMSC那样容易受到供体年龄的限制[3,6];此外,由于胎盘屏障的存在,使得脐带受到各种病原微生物感染的机会较低。因此,UCMSC是一种来源充足、活性好、相对比较安全和容易标准化生产的种子细胞,必将成为干细胞研究的热点,但是UCMSC分离扩增的技术标准值得深入研究。
自从人们发现UCMSC以来,主要以酶消化法和组织贴块法分离培养UCMSC,但酶消化法存在酶的浓度和消化时间控制不好可能会损伤细胞膜、降低细胞活性甚至改变细胞功能,而且操作繁琐,不符合组织培养的基本原则,因为操作越繁琐,污染的机会就越多,细胞突变的几率也越大。组织贴块法是目前国内外一些实验室分离UCMSC的基本方法,通常将脐带切为数个立方毫米大小的小块,然后转移至含有多种生长因子的培养液中培养[7],或用酶消化几个立方毫米的小块后再直接用含20﹪FBS的培养液培养[8],就可分离到UCMSC。本研究认为从简单、方便的组织培养原则出发,上述这些组织贴块法还可以进一步改进完善。
本研究结果表明,将新鲜脐带直接剪碎为糊状后转移到培养瓶中,加入仅含10﹪FBS的DMEM/F12培养液,就可分离到大量贴壁生长的成纤维细胞样细胞,免疫表型分析结果显示这些细胞高表达了BMMSC常见的抗原标志CD29、CD44、CD90、CD105,而且体外诱导分化实验证实这些细胞至少具有向脂肪、骨和软骨分化的能力,即具有多向分化潜能,这些结果与Bruyn等[5]报道的结果一致。根据间充质干细胞的鉴定标准[9],可以判定这些贴壁生长的细胞就是UCMSC。本研究的分离方法具有以下优点:(1)方法简单:洗净血渍后,直接剪碎脐带为糊状,加入少许含10﹪FBS的DMEM/F12直接培养,操作步骤少,大大缩短了实验室处理的时间,而且分离方法容易标准化;(2)经济实用:分离培养UCMSC的过程中不使用胶原酶,也不使用价格昂贵的各种细胞因子,胎牛血清的比例也仅为10﹪,分离成本低;(3)成功率高:从本质上而言,本研究建立的方法也属于组织贴块法,但将脐带剪碎为糊状,组织块更小,组织块接触培养瓶的面积增大,有利于UCMSC的贴壁生长,分离UCMSC的成功率更高;(4)安全性好:由于UCMSC具有比骨髓等其它来源的间充质干细胞更多的优势,UCMSC很快就成为人们关注的重点,很自然其安全性也更受人们关注。
与所有干细胞一样,如何防范UCMSC的污染和变异就是人们关注的一个重点。怎样才能最大限度地降低干细胞污染和变异的风险呢?本研究认为尽量减少对干细胞的干预处理是最大限度地降低干细胞污染和变异的根本方法,比如简化体外分离操作环节,就可大大降低污染的几率,减少各种“外来物质”的接触,这也是国家卫生部《人的体细胞治疗申报临床试验指导原则》的基本要求——尽量避免异体血清、细胞因子和抗生素等“外来物质”的使用,当然酶消化法中常用的各种酶也属于“外来物质”的范畴,减少这些“外来物质”的使用和接触,既可降低细胞变异的几率,又可有效防止各种病原微生物的传播。因此,本研究采用直接剪碎脐带分离UCMSC的方法对细胞干预处理最少,安全性更高。
不剥离血管组织直接贴壁培养获得的细胞纯度如何呢?细胞免疫表型分析结果表明,本研究获得的P2细胞纯度很高,原因在于传代培养一直是纯化BMMSC的重要手段,传代培养可以淘汰杂细胞,传代也可达到纯化UCMSC的目的,这一解释被Bruyn等[5]研究证实,采用不剥离血管组织直接贴壁培养获得的原代UCMSC的确中存在大约20﹪的CD31阳性表达的内皮祖细胞,但传代2代后这些细胞就完全消失了。Bruyn等还认为,剥离血管组织再培养的方法会丢失血管组织中的间充质干细胞,因为脐带血管组织中原本就存在间充质干细胞[10],从脐静脉内皮下膜分离间充质干细胞本身就是可行的方法[11]。此外,我们认为就算获得的UCMSC中残留一些血管内皮祖细胞,在用于临床治疗某些缺血性疾病时或许效果更佳,因为血管再生机制是干细胞发挥治疗效果的重要途径之一,而内皮祖细胞正是血管再生的执行者[12]。综上所述,本研究建立的不剥离血管组织直接贴壁培养获得UCMSC的方法,具有简单易行的特点,适于推广使用。
1 Friedenstein AJ,Deriglasova UF,Kulagina NN,et al.Precursors for fibroblasts in different populations of hematopoietic cells as detected by the in vitro colony assay method[J].Exp Hematol.1974,2(2):83-92.
2 Rao MS,Matton MP.Stem cells and aging: expanding the possibilities[J].Mech Ageing Dev,2001,122(7):713-734.
3 Baksh D,Yao R,Tuan RS.Comparison of proliferative and multilineage differentiation potential of human mesenchymal stem cells derived from umbilical cord and bone marrow[J].Stem Cells,2007,25(6):1384-1392.
4 McElreavey KD,Irvine AI,Ennis KT,et al.Isolation,culture and characterization offibroblast-like cells derived from the Wharton’s jelly portion of human umbilical cord[J].Biochem Soc Trans,1991,19(1):29-33.
5 Bruyn CD,Najar M,Raicevic G,et al.A rapid,simple,and reproducible method for the isolation of mesenchymal stromal cells from Wharton’s jelly without enzymatic treatment[J].Stem Cells Dev,2011,20(3):547-557.
6 Wang L,Tran I,Seshareddy K,et al.A comparison of human bone marrow-derived mesenchymal stem cells and human umbilical cord-derived mesenchymal stromal cells for cartilage tissue engineering[J].Tissue Eng Part A,2009,15(8):2259-2266.
7 徐燕,李长虹,孟恒星,等.人脐带间充质干细胞分离培养条件的优化及其生物学特性[J].中国组织工程研究与临床康复,2009,13(32):6289-6294.
8 毛希宏,杨智勇,孟明耀,等.人脐带间充质干细胞的培养鉴定及其向神经元细胞分化的研究[J].昆明医学院学报,2011,(1):41-47.
9 Jones BJ,McTaggart SJ.Immunosuppression by mesenchymal stromal cells:from culture to clinic[J].Exp Hematol,2008,36(6):733-741.
10 Ishige I,Nagamura IT,Honda MJ,et al.Comparison of mesenchymal stem cells derived from arterial,venous,and Wharton’s jelly explants of human umbilical cord[J].Int J Hematol,2009,90:261–269.
11 Romanov YA,Svintsitskaya VA,Smirnov VN.Searching for alternative sources of postnatal human mesenchymal stem cells: candidate MSC-like cells from umbilical cord[J].Stem Cells,2003,21:105-110.
12 Pelliccia F,Cianfrocca C,Rosano G,et al.Role of endothelial progenitor cells in restenosis and progression of coronary atherosclerosis after percutaneous coronary intervention: a prospective study[J].JACC Cardiovasc Interv,2010,3(1):78-86.

