氟改性纳米TiO2的制备及其光催化降解甲基橙机理
蒋晶晶 龙明策 吴德勇 蔡伟民
(上海交通大学环境科学与工程学院,上海200240)
氟改性纳米TiO2的制备及其光催化降解甲基橙机理
蒋晶晶 龙明策*吴德勇 蔡伟民
(上海交通大学环境科学与工程学院,上海200240)
采用简易的沉淀-氟化-回流晶化法在低温下制备了氟改性纳米TiO2(F-TiO2),并通过透射电镜(TEM),X射线衍射(XRD),傅里叶变换红外(FTIR)光谱,X射线光电子能谱(XPS)和漫反射光谱(DRS)等表征手段研究了粉末的形貌、晶型、元素形态和光吸收性质.结果表明:实验制得的F-TiO2为椭圆形纳米颗粒,粒径为5-8 nm;氟离子能够有效抑制板钛矿相TiO2的生成,并同时提高锐钛矿相TiO2的晶化度;修饰的氟主要分布在TiO2表面,以化学吸附态为主,并伴有少量的间隙氟.光催化降解甲基橙的实验表明,氟离子改性的TiO2同时具有较高的全谱和可见光催化活性.通过碱洗和焙烧的对照实验分析可知,F-TiO2在可见光下降解甲基橙的机理是源于一种由TiO2表面吸附氟和间隙氟共同增强的染料敏化降解作用.
氟改性;二氧化钛;回流;可见光活性;染料敏化
1 引言
自1972年首次观察到光照TiO2阳极出现光电化学分解水的现象以来,TiO2逐渐成为非均相光催化研究的热点.TiO2光催化剂中存在两个影响其实际应用的主要瓶颈:一是催化剂量子产率较低;二是带隙宽度过高,导致其光学响应范围较窄.1近年来人们发现,氟离子的修饰能大大改善TiO2在紫外光下的催化性能,其原因主要包括:抑制颗粒生长,增强表面酸度,提高锐钛矿相晶化度,促进紫外光照射下Ti3+和羟基自由基的生成等.2-4
虽然理论研究表明,氟掺杂形成的杂质能级位于TiO2的价带下方,不能降低TiO2的带隙宽度,5但也有一些实验证明,氟的修饰确实引发了TiO2的可见光催化活性;6-9对此,Li等6认为晶格氟的引入能促进TiO2表面氧空位的形成,而氧空位上的电子可以被能量较低的可见光激发,并由此产生一系列的表面化学反应;而Wang等9则发现,当降解底物为阳离子染料时,在TiO2表面形成的Ti―F配位基团能有效促进染料分子在可见光作用下的自身降解.关于制备可见光响应型氟改性TiO2的研究较少,目前报道氟改性TiO2的制备方法主要有喷雾热解法、水热法等原位改性法,6-8以及通过高活性TiO2浸渍氟化物的表面改性方法.9本文以钛酸四丁酯(Ti(OBu)4)为钛源,在低温下通过简易的回流晶化法制备了分散良好的氟改性纳米TiO2(F-TiO2),采用TEM,XRD,FTIR,XPS,DRS等技术对催化剂进行表征,并进一步讨论了氟改性TiO2在可见光下催化降解甲基橙的机理.
2 实验部分
2.1 催化剂的制备
氟改性的TiO2催化剂粉末通过沉淀-氟化-回流晶化法在低温下制备而成.具体步骤如下:(1)沉淀,将5 mL Ti(OBu)4(纯度>98%,国药集团化学有限公司)在搅拌状态下逐滴加入35 mL去离子水中,持续搅拌12 h使前驱体充分水解,将所得沉淀用去离子水洗涤数次以除去水解产物;(2)氟化,称取不同量的NaF(分析纯,国药集团化学有限公司)粉末,F和Ti的摩尔比分别为0、0.1、0.2、0.5、1.0和2.0,与上述沉淀一起投加到60 mL去离子水中,持续搅拌12 h使氟离子充分吸附于沉淀表面;(3)回流晶化,氟化后的沉淀经洗涤后重新分散于40 mL 0.2 mol·L-1的HNO3溶液中,在120°C下回流晶化12 h,得到乳白色胶状沉淀.该沉淀在80°C下烘干后,形成了淡黄色的TiO2干凝胶.将所得的凝胶粉末用去离子水洗涤数次以去除表面杂质,再经过干燥、研磨等工序得到氟改性纳米TiO2粉体.不同F/Ti摩尔比的F-TiO2样品记为TFx,其中x为氟化过程中F和Ti的摩尔比.
2.2 催化剂的表征
采用日本JEM-2010型透射电镜对样品的形貌和颗粒大小进行分析,制样方法为:将回流所得的F-TiO2沉淀烘干后直接用二次蒸馏水分散、稀释并滴至铜网上.采用日本Rigaku D/Max2200/PC型X射线衍射仪研究了样品的晶型和晶化度,具体条件为:Cu Kα线(λ=0.154 nm),管电压40 kV,管电流20 mA,扫描范围20°-80°,扫描速率6(°)·min-1.样品的红外吸收谱在德国EQUINOX 55型红外光谱仪上测定,扫描范围4000-370 cm-1.样品的元素分析在美国PHI-5000C ESCA system型X射线光电子能谱仪上进行,采用Al/Mg靶,高电压14.0 kV,功率250 W,以C 1s(Eb=284.6 eV)为基准进行校正,用AugerScan 3.21软件进行数据分析.样品的DRS谱在Lambda 950型紫外-可见分光光度计上测得,扫描范围300-600 nm,并由Kubelka-Munk函数转化为等价的吸收光谱.
2.3 光催化活性测试
采用1000 W氙灯作为光源,可见光反应测试时,使用滤光片以隔离波长小于400 nm的入射光.粉末的光催化活性通过光照下对甲基橙的降解效率来评价:以100 mL烧杯作为反应器,将0.05 g催化剂样品分散于50 mL一定质量浓度(可见光:10 mg·L-1;紫外光:20 mg·L-1)的甲基橙水溶液中.光照前,样品先在避光条件下搅拌30 min以达到吸附平衡;通过UV-759S型紫外-可见分光光度计对初始甲基橙溶液进行全波长扫描,可知其最大吸收波长为464 nm.光照开始后,每隔30 min抽取反应液样品5 mL,离心分离后,上清液中的甲基橙浓度通过分光光度计在464 nm处检测得到.
3 结果与讨论
3.1 TEM分析
F-TiO2沉淀干燥后直接加水稀释得到样品的TEM照片见图1.从图中可以看出,F-TiO2纳米粒子呈椭球型,粒径较小,在5-8 nm之间,与文献10,11中所报道的TiO2溶胶粒子直径相当,这是低温制备法的一个优点.此外还可以看出,F-TiO2沉淀经干燥后没有出现明显的颗粒团聚,这是由于氟离子的引入增强了TiO2表面的负电性,使得晶体颗粒间的排斥作用得到加强.12,13事实上,将F-TiO2干凝胶置于水中后可直接形成乳白色的半透明溶胶.由高分辨TEM图中可以看到胶粒表面明显的晶格条纹,其中较为清晰的条纹间距为0.375 nm,对应锐钛矿TiO2的(101)晶面.

图1 F-TiO2纳米颗粒的透射电镜照片Fig.1 TEM image of F-TiO2nanoparticles
3.2 XRD分析
图2显示了采用不同F/Ti摩尔比制备的F-TiO2样品的XRD谱图.由图可见,各TiO2样品的主要衍射峰均对应锐钛矿型TiO2的特征峰(2θ=25.2°, 37.9°,47.7°,54.3°,62.7°),但峰强度均不高,这说明低温回流法制备的F-TiO2晶化度有限.此外,图中未含氟和氟浓度较低的TiO2样品(TF0,TF0.1)出现了微弱的板钛矿相衍射蜂(2θ=31°),随着样品中氟浓度的提高,板钛矿相的特征峰逐渐消失,而锐钛矿相的特征衍射峰逐渐增强.通过比较不同F-TiO2样品在锐钛矿相各个晶面上的衍射峰高可以发现,氟离子对锐钛矿相TiO2晶化度的提高作用没有特殊的晶面选择性.
3.3 红外吸收分析

图2 不同F-TiO2样品的XRD谱图Fig.2 XRD patterns of different F-TiO2samples(1)TF0;(2)TF0.1;(3)TF0.5;(4)TF2.The x value in TFx(x=0,0.1,0.5,2)represents the molar ratio of F/Ti in the synthetic process.
图3为样品TF0和TF0.5的红外光谱图,选取放大其中3个波段(I:3600-1200 cm-1,II:1000-800 cm-1,III:900-400 cm-1)进行比较分析.在波段I,中心波长位于3245 cm-1处的宽吸收带和1625 cm-1处的吸收峰分别对应于TiO2表面水分子或羟基基团中O―H键的伸缩振动和弯曲振动.14,15在波段II,样品TF0.5在899 cm-1处出现了一个小肩峰,可归属于Ti―F键的伸缩振动,10这说明F离子以一定方式与Ti4+产生了化学键合,这里的氟形态可能是表面吸附态,也可能掺入了TiO2晶格.在波段III,中心波长位于625 cm-1的吸收带是由[TiO6]八面配位振动引起的.16值得注意的是,样品TF0和TF0.5在这一波段的吸收峰形并无明显差异.由XRD分析可知,经不同浓度氟离子改性的TiO2均未出现TiOF2的特征峰;结合红外吸收的特点可知,低温下形成的Ti―F键主要分布在TiO2表面,而对TiO2内部的晶格结构影响甚微.
3.4 紫外-可见漫反射光谱分析

图3 样品TF0(a)和TF0.5(b)的傅里叶变换红外光谱图Fig.3 FTIR spectra of samples TF0(a)and TF0.5(b)(I)3600-1200 cm-1,(II)1000-800 cm-1,(III)900-400 cm-1

图4 不同F-TiO2样品的紫外-可见漫反射光谱Fig.4 UV-Vis DRS spectra of different F-TiO2samples
根据杂化轨道理论,TiO2中氟掺杂形成的杂质能级由F 2p组成,它位于TiO2的价带下方,与禁带区域没有任何直接的重叠;因此,氟修饰并不能增加TiO2在可见光区的吸收.5图4所示为不同F-TiO2样品的UV-Vis DRS谱图.由图可见,无论在紫外光还是可见光区域,经氟离子改性的TiO2与纯TiO2之间均没有出现明显的光学吸收性能差异,这个结果符合理论估算,也与文献6,17,18报道的实验结果一致.
3.5 比表面积和吸附特性分析
催化剂粉末对有机底物的吸附能力是影响其光催化效率的一个重要因素.表1所示为纯TiO2样品(TF0)和经氟离子改性的TiO2样品(TF0.5)对甲基橙染料吸附能力的比较结果.从表中数据可知,经氟离子改性的TiO2对甲基橙的吸附能力略有下降;同时,F-TiO2的比表面积也略低于纯的TiO2,这是由于在样品制备时,氟的存在同时增大了TiO2的晶化度和颗粒粒径,从而导致了其比表面积的下降.虽然有研究表明,氟离子的引入能增强TiO2的表面酸性,从而提高其对大部分有机物的吸附能力;9,10然而在本实验中,由于甲基橙在中性条件下主要以阴离子形式存在(以偶氮式结构居多),而引入氟离子的TiO2往往具有更高的电负性,不利于阴离子在其表面的扩散和附着,因此,F-TiO2表面酸性的变化并没有显著改变其对甲基橙分子的吸附能力.

表1 样品TF0和TF0.5对甲基橙(MO)的吸附率(ε)及比表面积(S)比较Table 1 Comparison of the adsorption rate(ε)and specific surface area(S)of methyl orange(MO)on TF0 and TF0.5
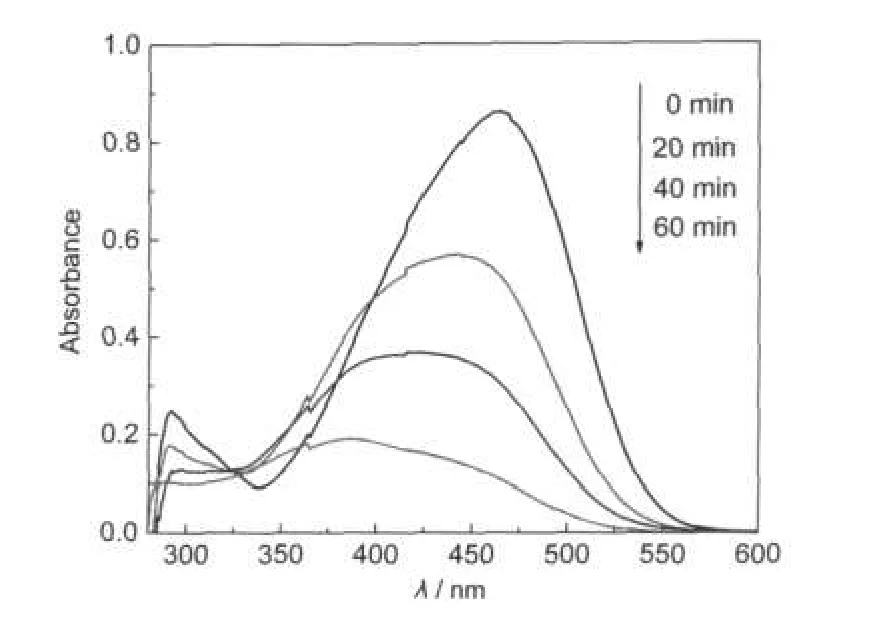
图5 甲基橙溶液在样品TF0.5的催化作用下光降解不同时间后的UV-Vis光谱图Fig.5 The UV-Vis absorption spectra of MO solution after visible-light irradiation at different time intervals in the presence of TF0.5λ>400 nm;catalyst dosage:1 g·L-1; initial MO concentration:10 mg·L-1
3.6 光催化活性评价
图5所示是在可见光(λ>400 nm)下,10 mg·L-1的甲基橙溶液在样品TF0.5的催化作用下光降解0, 20,40,60 min后的紫外-可见光谱图.从图中可以看到,未经光降解的甲基橙溶液在250-600 nm的范围内有两个吸收峰,其中最大吸收波长在464 nm处的宽吸收峰是由甲基橙中的生色基团(偏中性条件下为偶氮基)产生的,而位于290 nm左右的吸收峰应归属于甲基橙分子中苯环的特征吸收.19在可见光作用下,样品TF0.5能同时破坏甲基橙中的偶氮基和苯环结构,导致两个吸收峰的下降,从而达到从整体上降解甲基橙分子的效果.
图6所示为不同F-TiO2样品对甲基橙的降解活性比较.可以看到在全谱光照下(图6(a)),氟的修饰明显促进了TiO2对甲基橙的降解,其中以TF0.5的活性最高,仅20 min就降解了80.3%,超过了TF0在40 min内的降解率.当入射光改为λ>400 nm的可见光时(图6(b)),样品中氟的存在对甲基橙光降解速率的提高作用变得尤为显著:各掺氟样品在90 min内对10 mg·L-1甲基橙的降解率均超过了对照样品的4倍(19.7%).其中TF0.1、TF0.2和TF0.5的活性相当,而含氟量较高的TF1和TF2则表现出了相对较低的催化效率,这是由于过量Ti―F键的形成会导致TiO2的表面电位过低,从而在一定程度上阻止了光生电子有效地向催化剂表面迁移.17
3.7 低温氟改性的作用机理探讨

图6 不同F-TiO2样品在全谱(a)和可见光(b)下对甲基橙的降解曲线Fig.6 MO degradation on different F-TiO2samples (a)under UV-visible light,(b)under visible light;catalyst dosage: 1 g·L-1;initial MO concentration:(a)20 mg·L-1,(b)10 mg·L-1
关于氟改性提高TiO2紫外光催化活性的机理,多数学者认为,由表面化学吸附形成的Ti―F配位基能在紫外光下促进高活性羟基自由基(·OH)的生成,而晶格氟则有助于Ti3+的产生,18它能在TiO2带隙间形成浅势施主能级,通过俘获光生电子以提高TiO2的催化效率.2,20然而,由于氟掺杂在理论上不能引起TiO2在可见光区的吸收,对于F-TiO2所表现的可见光催化活性的根本原因有待进一步研究.6-9为了探讨本实验中F-TiO2的可见光催化本质,本文以TF2为样本,将目标污染物改为无色的苯酚溶液(10 mg·L-1),结果发现,F-TiO2对苯酚的降解能力与纯TiO2相近(见表2).这说明在可见光作用下,F-TiO2对甲基橙的高效降解并不是由TiO2的本征变化而造成的,而更可能是由于增强了染料的自身敏化作用所致.21,22

表2 样品TF0和TF2对不同底物在可见光下的降解率(δ)Table 2 Degradation rate(δ)of different substrates on samples TF0 and TF2

表3 样品TF2经不同方法处理后对甲基橙的可见光降解效率变化Table 3 Changes of visible-light degradation of MO on sample TF2 after treatment with different methods
前面的分析表明,F-TiO2中的部分氟离子以一定方式与Ti4+产生了化学键合,而且主要分布在TiO2表面.为了探讨F-TiO2中氟离子的具体化学形态及其促进甲基橙光敏化降解的原因,本文对样品TF2作了如下处理:(a)碱洗处理,将TF2在1 mol· L-1的NaOH溶液中超声处理30 min,再用大量的去离子水洗涤至中性,记为TF2-NaOH;(b)热处理,将TF2分别在200、300、400°C下保温处理2 h,记为TF2-200,TF2-300和TF2-400,并考察了其性质变化情况.由表3可知,经碱洗处理和热处理后的F-TiO2粉末对甲基橙的可见光降解能力都显著降低,这在很大程度上与F-TiO2表面氟离子的含量及其化学形态的变化有关.为此,本文进一步通过XPS和红外光谱表征对F-TiO2经不同方法处理后的表面特性变化进行了分析.
3.7.1 XPS分析
XPS全谱分析显示,样品TF2、TF2-NaOH、TF2-200均由Ti、O、C和F四种元素组成(其中C元素主要来自于XPS测试时含碳物质的污染或钛酸四丁酯的水解残留).图7和表4所示为经过不同方法处理后的TF2样品在Ti、O、F三种元素的XPS精细谱上产生的变化,并与TF0作了对比.从图7(A)中可知,TF2的F 1s谱由两部分组成:主要峰值在684.5 eV左右,另一较弱的峰值在690.6 eV左右.对于这两部分谱峰所对应的氟原子的化学形态,不少学者认为,前者是由取代了TiO2表面羟基的氟离子所产生的,而后者是由于部分氟离子进入了TiO2晶格并取代了晶格氧.9,17图7(B)表明样品TF2的表面羟基浓度要比TF0低,这说明在TF2表面,确实有部分羟基被氟离子所取代.然而,由于F 1s在TiF4晶体中的结合能为684.9 eV,23这说明即使是与钛结合的晶格氟,也很难获得高达690.6 eV的结合能,而更有可能与表面吸附氟处于相似的位置.Arichi24和Louis25等曾发现,残留于MFI沸石笼内的氟离子具有约690 eV的结合能;有鉴于此,可认为样品中位于690.6 eV的F 1s峰代表了残留于TiO2晶格间隙的氟离子.由于这些氟离子只是以较弱的静电引力与[TiO6]八面体中的各个原子结合在一起,而没有直接与Ti4+成键,因此其原子核周围的电子云密度较小,具有较高的电子结合能.由表4中数据可知,样品TF2经碱洗处理后,其总氟含量有所下降,而其间隙氟的相对含量(图7(A))和表面羟基含量(图7(B))都明显上升,这说明TF2表面的吸附态氟离子已部分被OH-所取代,与文献9,26,27报道的结果一致.样品TF2经200°C处理后,其总氟含量变化并不明显,而其原先位于690.6 eV处的F 1s峰却消失了.这说明在热处理过程中,原先位于TiO2晶格间隙的氟离子会逐渐逸出至晶粒表面,取代表面羟基而成为吸附态氟离子.由图7(B)可知,样品TF2-200的表面羟基含量相比TF2显著下降,这一方面是由于在热处理时,TiO2的表面羟基会逐渐缩聚成水而挥发,另一方面也可能是由于氟离子在TiO2表面产生了进一步的化学吸附.从Ti 2p的XPS谱(图7(C))中可以发现,吸附态氟的存在使Ti元素的结合能明显升高(TF2、TF2-200),这是由于氟离子具有较高的电负性,因此能强烈吸引Ti原子周围的电子,使Ti的结合能提高.当TF2经碱洗处理后,由于其表面氟离子的去除和表面羟基含量的大幅增加,其Ti 2p的结合能又恢复到近似TF0的水平.

图7 样品TF2经不同方法处理后的各元素XPS精细谱图变化Fig.7 Changes in XPS spectra on sample TF2 before and after further treatment(A)F 1s,(B)O 1s,(C)Ti 2p;compared to sample TF0

表4 样品TF2经不同方法处理后各元素精细谱图的对照分析Table 4 Changes in XPS results on each element of sample TF2 before and after further treatment
3.7.2 IR分析
从图8(A)可知,样品TF2在经碱洗处理后,原先位于899 cm-1处的Ti―F振动峰有一定程度减弱,这是由于部分的表面吸附氟被OH-离子所取代.从图8(B)中还可以看出,在[TiO6]八面体的配位振动区(波段I),随着热处理温度的升高,TF2的Ti―O振动峰发生了明显红移,这是由于在高温下,TiO2的锐钛矿晶体结构变得更为完整.16该现象表明,在200-400°C的热处理温度下,TiO2的晶体结构没有受到氟离子的明显影响.然而在Ti―F振动区(波段II),可以看到TF2经200°C处理后,其Ti―F振动峰明显增强.由XPS测试表明,样品TF2-200的总氟含量与TF2类似,而其表面吸附氟的比例相对较大,因此可以认为,位于899 cm-1处的红外吸收峰是由TiO2表面的吸附态氟离子引起的.当热处理温度继续升高时,由于表面氟离子的逸出,其Ti―F振动峰又逐渐减弱.

图8 样品TF2经(A)碱洗处理后的红外吸收变化和(B)不同温度处理后的FTIR吸收变化Fig.8 Changes in FTIR spectra on sample TF2(A)after alkaline wash and (B)after heat treatment at different temperatures (A)1050-750 cm-1;(I)1000-300 cm-1,(II)1050-750 cm-1
通过以上分析可知,本文制备的F-TiO2纳米粒子中存在两种形式的氟离子:以取代表面羟基而存在的吸附态氟离子和存在于TiO2晶格间隙的氟离子.碱洗处理使F-TiO2的表面吸附氟被表面羟基所取代,而热处理(200°C)则去除了TiO2晶格中的间隙氟,这些变化都使得F-TiO2对甲基橙的可见光降解活性产生了明显下降.因此可以认为,处于TiO2表层的间隙氟和表面氟存在一定的协同作用:一方面,间隙氟的存在增强了TiO2颗粒的负电性,基于电荷补偿作用,TiO2表面的―O-和―OH基团更趋向于吸附溶液中的氢离子而形成Ti―OH和Ti―OH2+,这种变化将导致TiO2表面平带电位的降低,28使得染料分子的光激发电子向TiO2导带的转移过程成为可能;另一方面,由于表面化学吸附的氟离子具有一定吸电子作用,这进一步促进了甲基橙染料受激发后产生的电子在TiO2表面的捕获.12受激发的电子迁移到TiO2导带后,能被水中的氧气捕获并形成超氧自由基;而甲基橙分子失去电子后成为不稳定的正离子自由基,29进而被超氧自由基等强氧化性物种降解.因此,经氟离子改性的TiO2显著增强了甲基橙在可见光下的降解速率.
4 结论
采用简易的沉淀-氟化-回流晶化法在低温下制备了氟改性的纳米TiO2催化剂.表征结果表明,低温下制得的F-TiO2纳米颗粒呈椭球形,晶粒大小在5-8 nm.氟的引入不但有效抑制了板钛矿相TiO2的生成,还从整体上提高了锐钛矿相TiO2的晶化度;样品中的氟主要分布在TiO2表面,以化学吸附态为主,并伴有少量的间隙氟.虽然DRS分析显示,氟的修饰没有明显改变TiO2的光学吸收性能,但光催化实验结果表明,当以甲基橙作为降解底物时,经低温回流法制得的F-TiO2不但具有较高的全谱光活性,而且在可见光下也显示出了较强的催化性能.通过进一步的机理分析,发现F-TiO2表面吸附氟和间隙氟的协同作用能够促进自由电子在可见光照射下由激发态染料向TiO2导带的迁移过程,从而显著提高了TiO2可见光催化降解甲基橙的能力.
(1)Hoffmann,M.R.;Martin,S.T.;Choi,W.;Bahnemann,D.W. Chem.Rev.1995,95,69.
(2) Xu,J.J.;Ao,Y.H.;Fu,D.G.;Yuan,C.W.Appl.Surf.Sci.2008, 254,3033.
(3)Tang,J.W.;Quan,H.D.;Ye,J.H.Chem.Mater.2007,19,116.
(4) Li,J.Y.;Ma,J.H.;Bai,T.Y.;Suyou,L.M.Acta Phys.-Chim. Sin.2007,23,1213.[李静谊,马俊华,白图雅,苏优乐玛.物理化学学报,2007,23,1213.]
(5) Li,D.;Ohashi,N.;Hishita,S.;Kolodiazhnyi,T.;Haneda,H.J. Solid State Chem.2005,178,3293.
(6) Li,D.;Haneda,H.;Labhsetwar,N.K.;Hishita,S.;Ohashi,N. Chem.Phys.Lett.2005,401,579.
(7)Ho,W.;Yu,J.C.;Lee,S.Chem.Commun.2006,1115.
(8) Ren,G.;Gao,Y.;Liu,X.;Xing,A.;Liu,H.;Yin,J.Reac.Kinet. Mech.Cat.2010,100,487.
(9)Wang,Q.;Chen,C.;Zhao,D.;Ma,W.;Zhao,J.Langmuir 2008, 24,7338.
(10) Huang,D.G.;Liao,S.J.;Dang,Z.Acta Chim.Sin.2006,64, 1805.[黄冬根,廖世军,党 志.化学学报,2006,64,1805.]
(11) Ren,D.S.;Cui,X.L.;Zhang,Q.;Yang,X.L.;Zhang,Z.J.Vac. Sci.Technol.(China)2002,22,421.[任达森,崔晓莉,张 群,杨锡良,章壮健.真空科学与技术,2002,22,421.]
(12) Park,H.;Choi,W.J.Phys.Chem.B,2004,108,4086.
(13)Zhu,S.Y.;Huo,M.X.;Zhang,L.L.;Yu,Q.;Wang,T.Z. Science and Technology Review 2010,28,112. [朱遂一,霍明昕,张蕾蕾,于 琪,王天竹.科技导报,2010,28,112.]
(14) Bezrodna,T.;Puchkovska,G.;Shimanovska,V.; Chashechnikova,I.;Khalyavka,T.;Baran,J.Appl.Surf.Sci. 2003,214,222.
(15) Hung,W.C.;Fu,S.H.;Tseng,J.J.;Chu,H.;Ko,T.H. Chemosphere 2007,66,2142.
(16) Su,H.D.Preparation and PhotocatalyticActivity of Titanium Dioxide Photocatalyst.Ph.D.Dissertation,Northeastern University,Liaoning,2005.[苏会东.二氧化钛光催化剂的制备及其性能研究[D].辽宁:东北大学,2005.]
(17) Chen,Y.M.;Zhong,J.;Chen,F.;Zhang,J.L.Chin.J.Catal. 2010,31,120.[陈艳敏,钟 晶,陈 锋,张金龙.催化学报, 2010,31,120.]
(18) Czoska,A.M.;Livraghi,S.;Chiesa,M.;Giamello,E.;Agnoli, S.;Granozzi,G.;Finazzi,E.;Di Valentin,C.;Pacchioni,G. J.Phys.Chem.C 2008,112,8951.
(19) Zhu,M.H.Instrumental Analysis,3rd ed.;Higher Education Press:Beijing,2000;p 275. [朱明华.仪器分析.第三版.北京:高等教育出版社,2000:275.]
(20)Yu,J.C.;Yu,J.G.;Ho,W.;Jiang,Z.;Zhang,L.Chem.Mater. 2002,14,3808.
(21) Liu,G.;Wu,T.;Zhao,J.;Hidaka,H.;Surpone,N.Environ.Sci. Technol.1999,33,2081.
(22) Chen,C.;Zhao,W.;Li,J.;Zhao,J.C.;Hidaka,H.;Surpone,N. Environ.Sci.Technol.2002,36,3604.
(23) Christine,M.D.;Joseph,R.;Jacques,J.V.Inorg.Chem.1987, 26,1212.
(24)Arichi,J.;Louis,B.Cryst.Growth Des.2008,8,3999.
(25) Louis,B.;Lioubov K.M.Microporous Mesoporous Mat.2004, 74,171.
(26) Minero,C.;Mariella,G.;Maurino,V.;Pelizzetti,E.Langmuir 2000,16,2632.
(27)Vohra,M.;Kim,S.;Choi,W.J.Photochem.Photobiol.A 2003, 160,55.
(28) Morrison,S.R.Electrochemistry at Semiconductor and Oxidized Metal Electrodes;Plenum Press:New York,1980; p 154.
(29) You,X.F.;Chen,F.;Zhang,J.L.;Huang,J.Z.;Zhang,L.Z. Chin.J.Catal.2006,27,270.[尤先锋,陈 锋,张金龙,黄家桢,张利中.催化学报,2006,27,270.]
October 20,2010;Revised:March 1,2011;Published on Web:April 8,2011.
Preparation of F-Modified Nanosized TiO2and Its Methyl Orange Photodegradation Mechanism
JIANG Jing-Jing LONG Ming-Ce*WU De-Yong CAI Wei-Min
(School of Environmental Science and Engineering,Shanghai Jiao Tong University,Shanghai 200240,P.R.China)
Fluorine-modified nanosized TiO2(F-TiO2)was prepared by a facile precipitation-fluorinationreflux method.Characterizations of transmission electron microscopy(TEM),X-ray diffraction(XRD), Fourier transform infrared(FTIR)spectroscopy,X-ray photoelectron spectroscopy(XPS),and diffuse reflectance spectroscopy(DRS)were carried out to investigate various properties of the as-prepared F-TiO2powder.We found that the F-TiO2particles were small(5-8 nm)and ellipsoidal in shape.The presence of fluorine not only suppressed the formation of a brookite phase,but also improved the crystallinity of the anatase phase.The fluorine atoms were mainly distributed on the surface of TiO2,and existed in both forms of chemical-adsorption and interstitial-doping.Compared to pure titania,the fluorine-modified TiO2powder showed a much higher methyl orange(MO)degradation efficiency under UV light and under visible light.Through the experiments of alkaline washing and heat treatment,we found that the increased MO degradation rate under visible light irradiation was caused by the enhanced selfdegradation of the dye over the surface-modified TiO2.
Fluorine-modification;Titanium dioxide; Reflux; Visible-light activity;Dye sensitization
O643
∗Corresponding author.Email:long_mc@sjtu.edu.cn;Tel:+86-21-54747354.
The project was supported by the Specialized Research Fund for the Doctoral Program of Higher Education of China(20090073120042).高等学校博士学科点专项科研基金新教师基金(20090073120042)资助项目

