酸洗去除冶金硅中的典型杂质
李成义,赵立新,,王 志,郭占成,王永刚
(1. 中国矿业大学 化学与环境工程学院,北京 100083;2. 中国科学院 过程工程研究所 湿法冶金清洁生产技术国家工程实验室,北京 100190;3. 中国科学院研究生院,北京 100049)
酸洗去除冶金硅中的典型杂质
李成义1,2,赵立新2,3,王 志1,郭占成2,王永刚1
(1. 中国矿业大学 化学与环境工程学院,北京 100083;2. 中国科学院 过程工程研究所 湿法冶金清洁生产技术国家工程实验室,北京 100190;3. 中国科学院研究生院,北京 100049)
以王水和氢氟酸为酸洗介质,研究酸洗对冶金硅中典型杂质元素的脱除效果。结果表明:王水和氢氟酸对金属类杂质均有明显的去除作用,但对非金属B和P去除效率差。Al杂质经王水和氢氟酸酸洗后去除率分别为80%和86.3%,Fe杂质的去除率分别为78.6%和89.4%。氢氟酸对总杂质去除率比王水提高12%,但其对Cu的去除率仅为4.8%。Cu的相态分析表明:Cu在冶金硅中主要是以Al-Si-Cu合金相存在,抗氢氟酸腐蚀性强。与氢氟酸不同,王水通过化学破碎作用使硅粉粒度变小,利于杂质相暴露。两种酸对硅粉的损失率均小于3.5%。
冶金硅;酸洗;提纯;杂质相
太阳能光伏发电产业因其取之不尽、用之不竭、清洁环保和安全可靠等独特优势而被誉为 21世纪的朝阳产业。长期以来,太阳级硅的原料主要来自西门子法生产中的过剩产能、废料和碎料[1],且成本高,能耗大。这种借用半导体工业满足光伏产业需求的方式显然是不合理的。因此,开发低成本、低能耗和环境友好型的太阳硅生产技术迫在眉睫。
冶金法以其潜在的成本低和能耗低的优势,受到越来越多的重视[2]。冶金法提纯利用硅和杂质元素物化性质的差异,通过逐级净化达到杂质元素与硅的分离,最终满足太阳硅纯度要求。主要包括酸洗、吹气、造渣、真空处理和定向凝固等工艺[3−5]。酸洗设备简单、可规模化操作,能耗低,对大多数杂质元素均有去除效果,尤其对含量高的Al和Fe等。因此,酸洗可以作为冶金法的预处理工艺,降低后续能耗。
盐酸、硫酸、氢氟酸等单酸或混酸介质的优化已得到普遍关注[6−8]。酸洗对Al、Fe、Ca等高含量元素的脱除效果好,氢氟酸对冶金硅提纯效果比盐酸好[9−10],但在酸洗过程中,冶金硅中其他杂质的脱除仍没有系统的分析,尤其是 Cu的脱除缺少研究。研究表明:氢氟酸对 Cu去除效果较差,对其原因尚不清楚。王水不仅有强酸性而且有较强的氧化性,势必对冶金硅中杂质具有脱除效果。为了提高杂质去除率,可以通过降低硅粉粒度,从而获得较好的提纯效果[9,11−12]。LIAN 等[11]研究发现,当粒度小于 1 µm 时,酸洗效果才有明显提升。氢氟酸酸洗时,发现粒度过细会出现大量硅粉上浮,搅拌困难,硅粉大量损失[11,13]。粒度过细不仅导致能耗增加,而且也给后续工序带来不便。因此,过分强调颗粒细化提高酸洗的脱除效果是不合理的。总之,系统地分析冶金硅中各杂质元素的酸敏感性,将有利于酸洗工艺的优化。硅粉粒度和损失率直接影响酸洗后高纯硅的再加工工艺,因此,研究酸洗前后硅粉粒度和损失率的变化,能够更好地优化酸洗条件。
本文作者采用王水和氢氟酸两种酸处理冶金硅,研究冶金硅中不同杂质元素的脱除效果,探讨杂质元素铜在冶金硅中的存在形式,分析氢氟酸对其去除效果极差的原因。最后,研究硅粉酸洗后粒度和损失率的变化,期望对优化酸洗工艺提供基础理论支撑。
1 实验
1.1 实验材料
冶金硅(MG-Si)从中国湖南产地购买,其牌号为1101。将购买的块硅破碎并筛选分级。经发现,150~500 µm的硅粒杂质含量较少,取150~500 µm的硅粒作为实验样品,其杂质元素的含量如表1所列。实验中所用化学试剂,如盐酸、硝酸和氢氟酸均为分析纯。过滤样品和配制溶液用水均为去离子水。

表1 冶金硅中杂质元素的含量Table 1 Contents of different impurities in MG-Si (mass fraction, 10−6)
1.2 实验装置
实验装置由恒温水浴锅和酸洗槽组成。恒温水浴锅为上海市实验仪器厂有限公司生产,型号为501型。酸洗槽为聚四氟烧杯改制而成。
本研究用冶金硅酸洗前后的质量差值占冶金硅酸洗前的质量分数作为硅粉的损失率w,其表达式如下:

式中:w为硅粉的损失率,%;m1为冶金硅酸洗前的质量,g;m2为冶金硅酸洗干燥后的质量,g。
1.3 实验过程
1.3.1 酸洗实验
酸洗实验每次取硅粉约 2 g。在恒定的机械搅拌条件下,硅粉分别在王水(70 ℃,V(HCl):V(HNO3):V(H2O)=3:1:4)和氢氟酸(70 ℃,5%)中,按照不同时间条件酸洗,然后用去离子水将酸洗后的冶金硅粉清洗至中性为止。最后将得到的样品烘干。杂质元素分析采用感应耦合等离子体(ICP)和原子吸收(AAS)进行测试。粒度分布采用激光粒度分析仪(型号为LS13320,美国贝克库尔特公司制造)分析。
1.3.2 酸侵蚀实验
块硅切割成为40 mm×30 mm的薄片,切割面通过打磨、抛光。将抛光面中的杂质相在显微镜下标定,并用能谱进行成分分析。将标定的硅片分别在王水和氢氟酸中进行侵蚀,后对残余杂质相做能谱成分分析。酸侵蚀条件分别如下:王水为V(HCl):V(HNO3):V(H2O)=3:1:4、70 ℃,氢氟酸为5%、70 ℃,侵蚀时间6 h。
2 结果与讨论
2.1 王水和氢氟酸对杂质的脱除效率
Al、Fe、Ca、Cu、Mn、Ti、V等杂质元素在熔融态硅中有较高的溶解度,但它们在固态硅中的溶解度相对低。因此,在冶金硅凝固过程中,分配系数低的杂质元素会在晶界处大量偏析。杂质元素偏析的晶界处相对较硅基体硬度比较小,容易破碎。当冶金硅在外力下破碎和研磨时,偏析在晶界处的杂质元素会因破碎而暴露出来。进而通过酸洗的方法,可以脱除暴露的杂质元素。
图1所示为冶金硅中杂质元素分别在王水和氢氟酸酸洗中杂质去除率随时间的变化曲线。由图1(a)和(b)可知,王水对冶金硅中Al、Fe、Cu、Cr、Ni、Mn、Ti、V元素均有去除效果。杂质元素的去除率随着时间的延长不断升高,且在6 h以后大多趋于稳定。Al和Fe等含量较高的杂质元素脱除率可达80%和78.6%,即从原硅中含量为 1 235.71×10−6、1 297.87×10−6分别降到 247.05×10−6和 277.21×10−6。仅有极少量的Cu元素去除效果更为显著,仅残余2.65×10−6。但对含量相对较多的Ti和V杂质元素,去除效果相对较差,仅为60%左右。B和P经王水酸洗后,去除效果最差。
而从图1(c)和(d)可以看出,Al、Fe、Cr、Ni、Mn、Ti、V杂质元素经氢氟酸酸洗后,去除效果均比王水的好。仅6 h酸洗,Al、Fe、Ni杂质去除率达到85%,Cr、Mn、Ti、V甚至高达90%。6 h后,去除率不再明显变化。氢氟酸对P没有脱除效果,对B有一定的脱除效果。值得一提的是,Cu经氢氟酸酸洗后没有脱除效果,与王水酸洗有较大差异。
王水与氢氟酸对杂质脱除效果的差异,是由酸中阴离子与金属离子配位化合物的稳定性差异造成的。F离子的配位常数高[14],具有很好的配位性,所以侵蚀性要比 Cl−好。王水既具有酸性又具有强氧化性,因此酸洗效果较好。Al、Fe、Ca、Mn、Ni、Ti、V 杂质元素均可被王水和氢氟酸去除,但固溶于基体的非金属杂质B和P则很难被脱除。部分B可以被氢氟酸脱除,说明B元素在晶界处少量存在,这可能是由于冶金硅生产过程中,采用吹氧和造渣等工序,被氧化的元素B部分残留在晶界处。

图1 浸出时间对冶金硅中杂质元素在王水和氢氟酸酸洗中去除率的影响Fig.1 Effect of leaching time on removal effect of impurities in MG-Si after leaching with aqua regia (V(HCl):V(HNO3):V(H2O)=3:1:4, 70 ℃) ((a), (b)) and HF (5%, 70 ℃) ((c), (d))
2.2 冶金硅中Cu的存在形式
王水对Cu元素脱除效果好,表明Cu元素经破碎而暴露,可被酸洗脱除。氢氟酸对 Cu元素脱除效果不好,说明 Cu在暴露的晶界处可能和某些元素相形成合金相[15],对氢氟酸有抗腐蚀性。由于原硅中 Cu含量很低,仅 18.5×10−6,在原硅样品晶界处很难发现Cu。为了分析氢氟酸对冶金硅中Cu元素脱除效果差的原因,通过添加Cu,在晶界处获得大量偏析的各种含Cu杂质相,进行含Cu相的耐酸性研究。

图2 富Cu冶金硅抛光后的金相图及不同区域的EDS能谱Fig.2 OM image of impurity phases in Cu-rich MG-Si and EDS spectra of different areas: (a) OM image; (b) Area 1; (c) Area 2; (d)Area 3; (e) Area 4; (f) Area 5
实验选取粒度均在500~2 000 µm的硅粉和铜粉,分别为25 g和0.18 g。混合均匀后在1 600 ℃下熔融得到富Cu冶金硅。图2所示为富Cu冶金硅的金相图及不同区域的能谱图。从图2中可以看出,杂质相主要分为深灰色区域、浅灰色区域和灰白色区域3类。从EDS谱图含量分布可以看出,杂质相元素主要有Ti、Fe、Cu、Si、Al、Mn、Ca和V等,颜色的差异主要来源于组成的差异。深灰色区域2组成中,一般Fe、Si、Mn、Al元素含量比较多,且成条带状,其主体应属于Si-Fe相。浅灰色区域1元素组成中,Ti、V、Fe含量较高,一般Ti在20%以上,应属于Si-Ti相。而灰白色区域(4和5)组成中,Cu、Al、Si含量较多,尤其Cu含量极高,一般在80%以上,应属于富Cu相。同时又发现,富 Cu相存在两种铝硅含量不同的合金相,一种是高Al富Cu相(Al-Si-Cu),另一种是针状高Si富Cu相(Si-Al-Cu),且后者被前者包裹着。其中,在Al-Si-Cu相中,Al含量在10%以上,Si含量小于Al(<5%),而Si-Al-Cu相中,Si和Al的含量与Al-Si-Cu相相反,Si含量在10%左右,Al含量在5%以下。但两种富Cu相中Cu含量基本一致,均在80%以上。这与 KANIBOLOTSKY等[16]的研究结果一致,在Al-Si-Cu合金中最大的相互作用是沿Cu3Si-Cu3Al2方向的,且铜铝之间相互作用强。
图3所示为王水和氢氟酸对含Cu杂质相侵蚀前后的金相图及残余物对应的能谱图。由图3可知,王水(见图3(a)和(b))对两种富Cu相腐蚀效果都好,腐蚀彻底;而深灰色的富Si-Fe相和浅灰色的富Si-Ti相由于其有比较强的耐酸性,而不易被王水腐蚀。这是导致王水对Ti和V等脱除效果较差的根本原因。氢氟酸(见图3(c)和(d))对富Si-Fe相和富Si-Ti相耐腐蚀性强的杂质相依然有效,杂质相经氢氟酸侵蚀后没有残留。研究发现,两种铝硅比不同的富 Cu相对氢氟酸却有不同的耐腐蚀性。Al-Si-Cu相对氢氟酸的耐酸性很好,不被氢氟酸腐蚀;而Si-Al-Cu相易被氢氟酸腐蚀,在Al-Si-Cu基体上出现线状腐蚀(见图3(d))。虽然Si-Al-Cu相易被氢氟酸腐蚀,其合金相中铜含量也很高,但因其含量少且被Al-Si-Cu相包裹着,成针状暴露,也只有部分被氢氟酸腐蚀。由氢氟酸酸洗可知,氢氟酸对铜元素去除效果差,也表明易被氢氟酸腐蚀的Si-Al-Cu相要比耐氢氟酸的Al-Si-Cu相含量少。由以上分析可知,Cu在冶金硅中主要是以耐氢氟酸的高Al的Al-Si-Cu相形式存在。此外,也可能存在少量针状的易被氢氟酸腐蚀的高Si的Si-Al-Cu相。
2.3 酸洗后硅粉粒度变化
利用激光粒度分析仪测定硅粉粒径(其结果如图4所示),克服了采用电镜观察测其粒度的不足[12]。图4所示为冶金硅粉分别经过王水和氢氟酸酸洗后硅粒度变化曲线。从图4可知,硅粉经王水酸洗,硅粉中较大颗粒含量降低,粒度有减小的趋势(见图4(a));在酸洗前3 h,粒度没有变化;但5 h时,粒度分布曲线明显向左偏移,说明硅粉粒度变小;随着时间的继续增加,颗粒的粒度变化不再变化(见图4(b))。而经氢氟酸酸洗后,硅粉粒度随时间的增加没有偏移。众所周知,硅不与王水反应,但在一定条件下可与氢氟酸起反应,可能会造成硅经王水酸洗后粒度无变化,但经氢氧酸酸洗后,硅的粒度明显变小。而实验得到的粒度变化与此截然不同。
图5所示为冶金硅样品王水侵蚀前后的形貌。由于王水具有化学破碎效果,它可以将杂质相,并联同邻近的硅从硅基体中剥离,同时也易造成硅基体沿着杂质相破裂,这是王水酸洗后硅粒度变化的主要原因。由粒度分布可知,粒度虽然变小,过分细小的颗粒含量没有变化。也说明这种破裂利于杂质相的暴露,而不造成颗粒过分破碎。
2.4 酸洗后硅粉损失率
图6所示为王水和氢氟酸酸洗后硅粉的损失率。由图6可知,硅粉经王水酸洗,损失率低,且随时间变化不大,其损失率最高值仅为1.24 %。5 h后,检测其硅纯度高达99.90 %。而在氢氟酸浸出实验中,3 h以前,损失率增加明显;3 h后,损失率则基本不变,最大损失率为3.37 %。王水和氢氟酸酸洗损失率的差异性归结于硅本身的物化性质,即硅粉与氢氟酸会发生反应,但与王水不反应。硅粉浸在王水中酸洗,仅会对杂质脱除,但经氢氟酸酸洗,其本身会有一定的损失。由氢氟酸酸洗得出,杂质脱除率在5 h以后不再变化,所以,延长氢氟酸酸洗时间对杂质脱除率影响较小。另外,氢氟酸酸洗时,明显发现大量的硅粉浮到水面上,且很难下沉,使搅拌很难进行。酸洗时,粒度越小,现象越明显,损失越严重。这是由于硅粉在氢氟酸酸洗时产生了憎水基团,使得界面张力变大,造成润湿性变差,同时,生成的气体吸附在其表面,使其视密度变小,从而上浮[17]。因此,酸洗提纯冶金硅时,氢氟酸应适当选用。选用时,也不易时间过长和粒度过小。

图3 王水和氢氟酸对含Cu杂质相的侵蚀前后金相图及残余物对应的EDS能谱Fig.3 OM images of impurity phases before and after acid corrosion and EDS spectra of corresponding residues: (a) Before corrosion by aqua regia; (b) After corrosion by aqua regia; (c) Before corrosion by hydrofluoric acid; (d) After corrosion by hydrofluoric acid; (e) Area 1; (f) Area 2; (g) Area 3; (h) Area 4
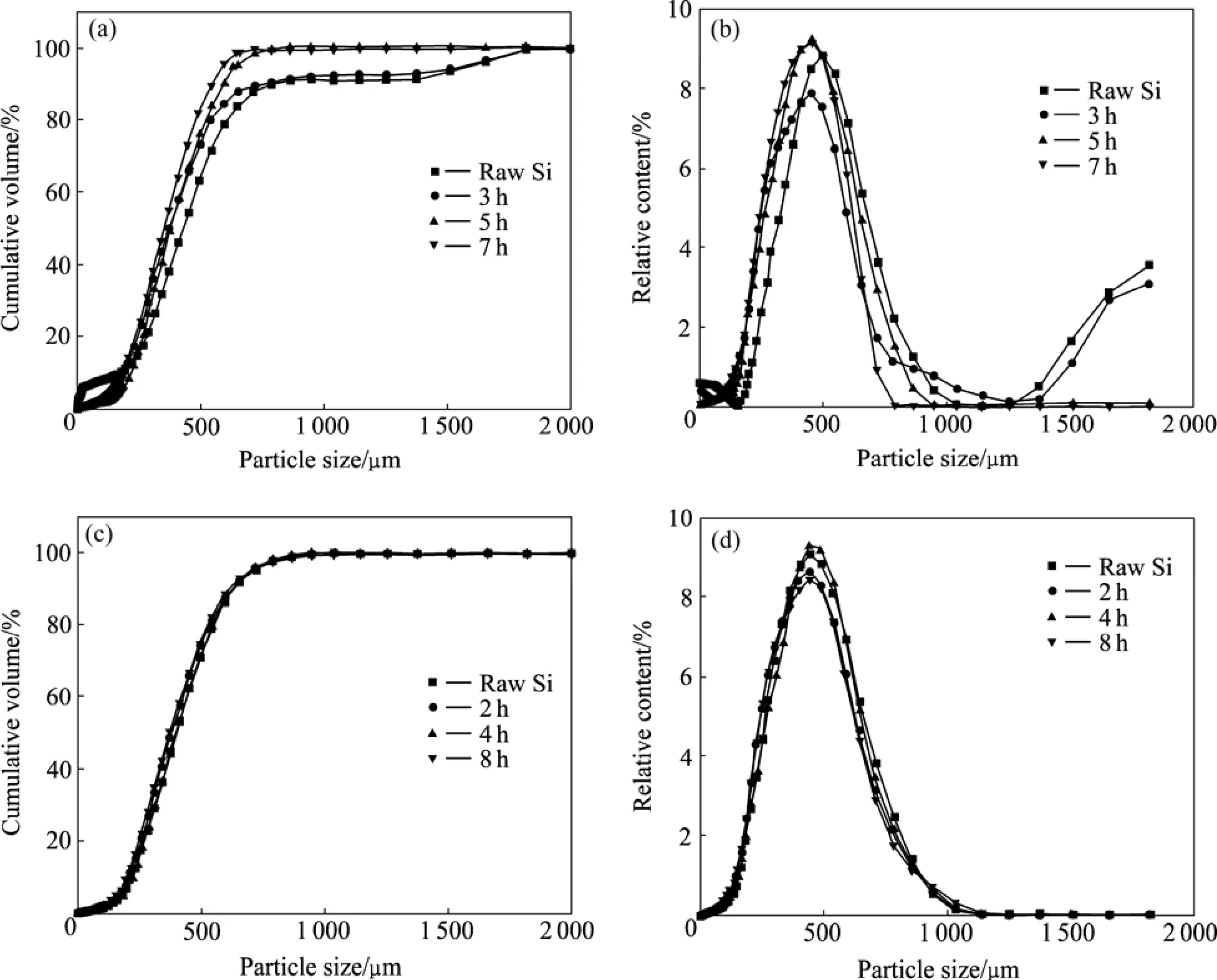
图4 冶金硅酸酸洗后的粒度变化Fig.4 Changes of MG-Si silicon powder after acid leaching: (a), (b) Aqua regia, V(HCl):V(HNO3):V(H2O)=3:1:4, 70 ℃; (c), (d) HF,5%, 70 ℃

图5 王水侵蚀前后冶金硅样品的形貌Fig.5 Morphologies of MG-Si samples before(a) and after(b) leaching with aqua regia
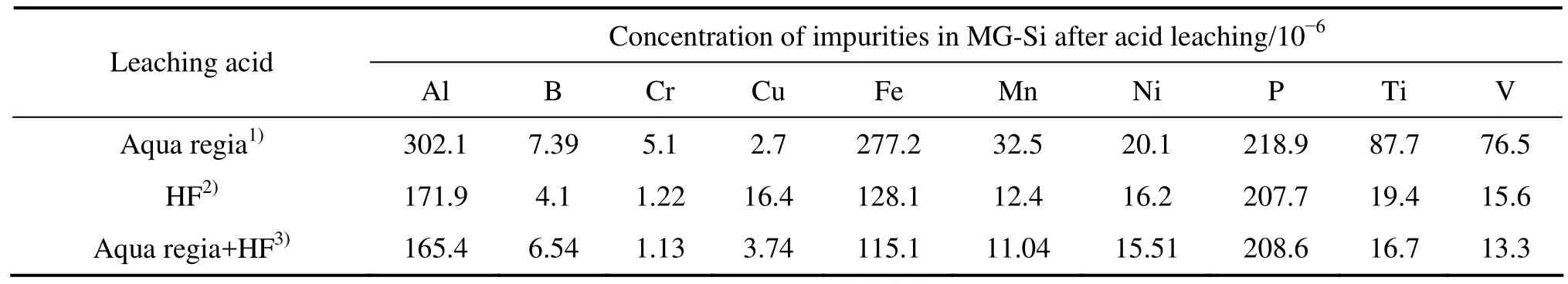
表2 冶金硅酸洗脱除效果的比较Table 2 Comparison of removal efficiency of acid leaching
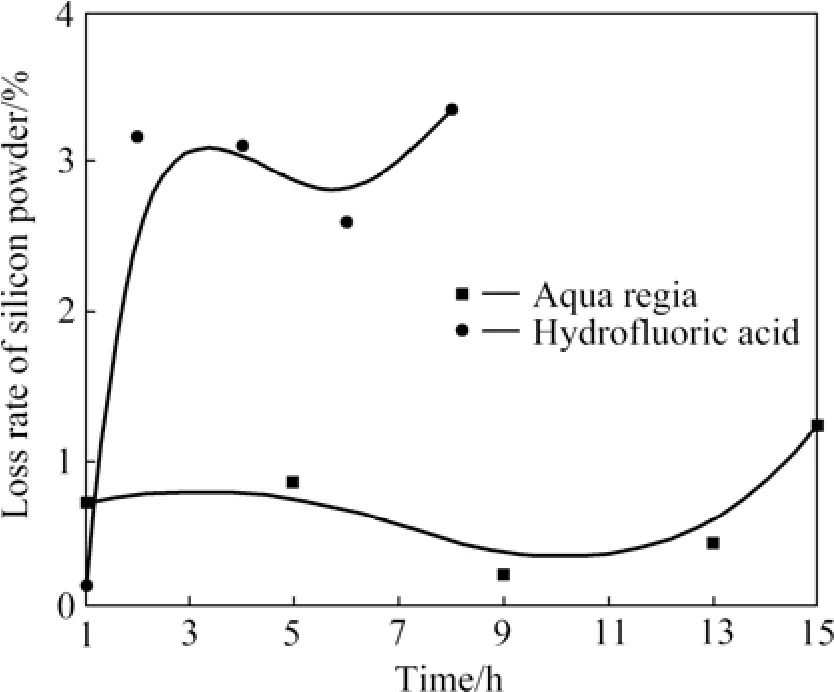
图6 王水和氢氟酸酸洗后硅粉的损失率Fig.6 Loss rates of silicon powder after acid leaching by aqua regia and hydrofluoric acid
由上述结果可知,王水和氢氟酸配合使用,脱除效果势必更好(见表2),与单纯采用王水或仅氢氟酸酸洗相比,冶金硅依次经王水和氢氟酸酸洗的去除效果最好。这主要是利用王水对杂质相的剥离作用和对硅基体沿晶界的破碎作用,以及氢氟酸对杂质相强的侵蚀性。但在应用氢氟酸酸洗时,应该尽量取较大硅颗粒和减少酸洗时间。
3 结论
1) 王水酸洗对冶金硅中 Al、Fe、Cu、Cr、Ni、Mn、Ti和V等杂质元素均有去除效果,总杂质的去除率为71 %。氢氟酸的酸洗效果优于王水的,去除率比王水提高了12%,但对Cu脱除效果差,仅为4.8%,但两种酸对B和P酸洗效果均较差。
2) Cu在冶金硅中主要是以耐氢氟酸的高 Al的Al-Si-Cu相的形式存在。另外,可能还存在少量针状易被氢氟酸腐蚀的高Si的Si-Al-Cu相。
3) 王水具有化学破碎效果,硅粉经王水酸洗后,粒度显著变小。氢氟酸虽然与硅反应,会造成硅的损失,但是王水与氢氟酸的损失率相差不大,都在3.5%以下。硅粉在氢氟酸酸洗时大量上浮,很难下沉。酸洗时粒度越小,现象越明显,损失越严重。
REFERENCES
[1] KHATTAK C P, JOYCE D B, SCHMID F. A simple process to remove boron from metallurgical grade silicon[J]. Solar Energy Materials and Solar Cells, 2002, 74: 77−79.
[2] BRAGA A F B, MOREIRA S P, ZAMPIERI P R, BACCHIN J M G, MEI P R. New processes for the production of solar-grade polycrystalline silicon: A review[J]. Solar Energy Materials and Solar Cells, 2008, 92: 418−424.
[3] MORITA K, MIKI T. Thermodynamics of solar-grade-silicon refining[J]. Intermetallics, 2003, 11: 1111−1117.
[4] 蔡 靖, 陈 朝, 罗学涛. 高纯冶金硅除硼的研究进展[J].材料导报, 2009, 23(12): 81−100.CAI Jing, CHEN Chao, LUO Xue-tao. Research process in boron removal of UMG silicon[J]. Materials Review, 2009,23(12): 81−100.
[5] 龙桂华, 吴 彬, 韩 松, 邱克强. 太阳能级多晶硅生产技术发展现状及展望[J]. 中国有色金属学报, 2008, 18(1): 386−392.LONG Gui-hua, WU Bin, HAN Song, QIU Ke-qiang.Development status and prospect of solar grade silicon production technology[J]. The Chinese Journal of Nonferrous Metals, 2008, 18(1): 386−392.
[6] 王 宇, 尹 盛, 肖成章, 何笑明, 王敬义. 硅材料湿法提纯理论分析及工艺优化[J]. 太阳能学报, 1995, 16(2): 175−179.WANG Yu, YIN Sheng, XIAO Cheng-zhang, HE Xiao-ming,WANG Jing-yi. Theoretical analysis and technology optimization for hydrometallurgical purification of Si material[J].Acta Energiae Solaris Sinica, 1995, 16(2): 175−179.
[7] 谭 毅, 姜大川, 李国斌, 许富民, 刘艳娇, 胡祖麒. 一种化学冶金提纯多晶硅的方法. CN 101311114A[P]. 2008−11−26.TAN Yi, JIANG Da-chuan, LI Guo-bin, XU Fu-min, LIU Yan-jiao, HU Zu-qi. A chemical method of metallurgical silicon purification. CN 101311114A[P]. 2008−11−26.
[8] DIETL J. Hydrometallurgical purification of metallurgicalgrades silicon[J]. Solar Cells, 1983, 10: 145−154.
[9] SANTOS I C, GONCALVES A P, SANTOS C S, ALMEIDA M,AFONSO M H, CRUZ M J. Purification of metallurgical grade silicon by acid leaching[J]. Hydrometallurgy, 1990, 23:237−246.
[10] MA Xiao-dong, ZHANG Jian, WANG Tong-ming, LI Ting-yu.Hydrometallurgical purification of metallurgical grade silicon[J].Rare Metals, 2009, 28: 221−225.
[11] LIAN Shuang-shii, KAMMELR, KHEIRI M J. Preliminary study of hydrometallurgical refining of MG-silicon with attrition grinding[J], Solar Energy Mater & Solar Cells, 1992, 26:269−276.
[12] 杨春梅, 陈红雨. 酸浸出法提纯冶金硅[J]. 功能材料, 2008,39: 686−688.YANG Chun-mei, CHEN Hong-yu. Purification of metallurgical grade silicon by acid leaching[J]. Journal of Function Materials,2008, 39: 686−688.
[13] 叶其辉, 李 核, 常 玉, 孙艳辉, 陈红雨. 提高湿法提纯多晶硅回收率的方法[C]//第28届全国化学与物理电源学术年会论文集. 天津, 2009: 354−355.YE Qi-hui, LI He, CHANG Yu, SUN Yan-hui, CHEN Hong-yu.A method for impoving recovery of hydrometallurgy purification for silicon[C]//The 28th Annual Meeting on Power Sources.Tianjing, 2009: 354−355.
[14] 张寒琦, 宋利珠, 张忆华, 林英杰. 实用化学手册[M]. 北京:科学出版社, 2004.ZHANG Han-qi, SONG Li-zhu, ZHANG Yi-hua, LIN Ying-jie.Practical handbook of chemistry[M]. Beijing: Science Press,2004.
[15] 张青莲, 申泮文. 无机化学丛书[M]. 北京: 科学出版社, 1984.ZHANG Qing-lian, SHEN Pan-wen. Inorganic chemistry books[M]. Beijing: Science Press, 1984.
[16] KANIBOLOTSKY D S, BIELOBORODOVA O A, STUKALO V A, KOTOVA N V, LISNYAK V V. Thermodynamics of liquid aluminium-copper-silicon alloys[J]. Thermochimica Acta, 2004,412: 39−45.
[17] 章小鸽. 硅及其氧化物的电化学[M]. 北京: 化学工业出版社,2004.ZHANG Xiao-ge. Electrohemistry of silicon and its oxide[M].Beijing: Chinese Chemical Industry Press, 2004.
Removal of representative impurities from metallurgical grade silicon by acid leaching
LI Cheng-yi1,2, ZHAO Li-xin2,3, WANG Zhi2, GUO Zhan-cheng2, WANG Yong-gang1
(1. School of Chemical and Environmental Engineering, China University of Mining and Technology,Beijing 100083, China;2. National Engineering Laboratory for Hydrometallurgical Cleaner Production Technology,Institute of Process Engineering, Chinese Academy of Sciences, Beijing 100190, China;3. Graduate University of Chinese Academy of Sciences, Beijing 100049, China)
The removals of representative impurities by acid-leaching were studied using aqua regia and HF as the leaching acids. The results show that the two acids have obvious removal efficiency to metal impurities, but have little removal effect to B and P. After leaching, the removal rates of Al are 80% and 86.3% by aqua regia and HF, meanwhile,the removal rates of Fe are 78.6% and 89.4%, respectively. The total impurities removal rates after HF increase by 12%than that after aqua regia, but the removal efficiency of Cu by HF is very poor, with the removal rate reaches 4.8%. The structural phase analysis results show that Al-Si-Cu is the main existence form of Cu in metallurgical grade silicon(MG-Si), which is strong acid-resistance to HF. Unlike HF,the chemical stripping-off effect of the particle size of silicon powder made by aqua regia decreases obviously and the impurity phases easily expose at the grain boundaries. The loss rates of Si powder after two acids are less than 3.5%.
metallurgical silicon; acid leaching; purification process; impurity phases
TF 803.25
A
1004-0609(2011)08-1988-09
“十一五”国家科技支撑项目重点项目(2009BAB49B04)
2010-10-12;
2010-12-29
王 志,副研究员,博士;电话:010-62579402;E-mail: zwang@home.ipe.ac.cn
(编辑 李艳红)

