岳麓山白三叶草异黄酮提取方法比较研究
周 鑫,彭婷婷,张 伟,李雪姣,姚 丹,莫 辉,彭伏镭,马 铭*
(1. 湖南师范大学化学生物学及中药分析省部共建教育部重点实验室,中国 长沙 410081; 2. 湖南师范大学附属中学,中国 长沙 410081)
白三叶草,又名白车轴草,是一种车轴草属多年生草本植物[1].原产于欧洲,现广泛分布于温带及亚热带地区.我国新疆、云南、四川、贵州、湖南、湖北等地都有野生分布,长江以南多省有大面积种植.民间曾以其全草入药,具有安神镇静、清热凉血、祛痰止咳、镇静止痛的功效[2].
近年来,三叶草的研究受到了广泛的关注.国内外学者对车轴草属植物进行了大量的分离提取研究,得到了多种活性成分.Foo和Lu等用丙酮对白三叶进行了回流提取,通过大孔吸附树脂分离得到了多种酚类物质[3];Maher 和Hughes通过浸渍法从白三叶中提取了亚麻苦苷和百脉根苷的混合物[4].Klejdus[5]等从红三叶草中分离得到46种异黄酮化合物,其中刺芒柄花素和鹰嘴豆芽素A含量最高,约占干重的0.1%~0.9%,远远高于其他植物.研究表明,车轴草中的异黄酮类化合物具有抗癌、植物雌激素样作用以及抗氧化和清除自由基的功能,能抑制胃溃疡、胃癌、乳腺癌及肠癌等[6],还能有效预防和治疗动脉硬化[7]、骨质疏松[8]等疾病,因而成为人们关注的焦点.
浸渍法和回流法作为常见提取方法被广泛应用于三叶草活性物质的提取过程中[3-4,9],但具有耗时、耗能等缺点.近年来微波和超声波技术开始被应用于异黄酮的提取过程中.于丽娜[10]等人通过单因素及正交实验优化了用超声波法提取红三叶草总异黄酮的实验条件;金汝城等人[11]采用密闭微波提取装置对红车轴草异黄酮成分进行了提取工艺的研究.然而到目前为止,检索国内外文献,很少有关于白三叶草异黄酮提取方法的对比研究报道.由于自然界中异黄酮的资源十分有限,因此选择一种省时、高效、综合提取效果好及环境友好的提取方法对充分利用白三叶草资源,实现规模化提取具有十分重要的意义.本文利用微波辅助提取法、超声辅助提取法和回流提取法对白三叶草中的异黄酮类化合物的提取进行了研究,通过对比3种提取方法,获得了岳麓山白三叶中异黄酮的最佳提取方法和工艺参数,研究结果可为岳麓山乃至全国白三叶的研究与开发提供参考依据.
1 实验部分
1.1 仪器与试剂
Agilent 1100液相色谱仪(美国安捷伦科技有限公司),由G1312A液相泵,G1316A 柱温箱,G1315 二极管阵列检测器,7725手动进样阀和10 μL微量进样器组成;TU-1221紫外-可见分光光度计(北京通用仪器设备公司);MCR-3型微波化学反应器(巩义市予华仪器有限责任公司);CQ250超声清洗仪(上海船舶电子设备研究所); DF-101S集热式恒温加热磁力搅拌器(巩义市英予华仪器厂);AB204-N电子分析天平(瑞士梅特勒仪器有限公司);SHB-III循环水式多用真空泵(郑州长城科工贸有限公司).
白三叶草样品2009年7月雨后采自岳麓山脚,经湖南师范大学生命科学学院植物学系刘克明教授鉴定后,晒干、粉碎、过40目筛备用.
刺芒柄花素标准品(纯度>98%,杰辉生物技术有限公司)、无水乙醇(分析纯,天津市大茂化学试剂厂)、乙腈(色谱纯,湖南化工研究院精细化工研究所)、甲醇(色谱纯,湖南化工研究院精细化工研究所)、超纯水(由Millipore公司的Milli-Q纯水系统制得).
1.2 色谱条件
色谱柱为大连江申Spherigel ODS C18 柱(5 μm,250×4.6 mm I.D.),流动相流速为1.0 mL/min,检测波长为249 nm,柱温为30 ℃,进样量为10 μL.
流动相:A:超纯水;B:乙腈.采用A∶B=53∶47的等度洗脱.
1.3 实验方法
准确称取一定量的白车轴草样品,加入提取溶剂,在设定条件下提取一定时间.减压抽滤,定容至50 mL即为待测样品溶液.取待测样品溶液,过0.45 μm滤膜,在选定色谱条件下进液相色谱分析,得样品提取液中刺芒柄花素的浓度c(mg/L).按下式计算三叶草样品异黄酮的提取量(Extract content of isoflavones, μg): 异黄酮提取量(μg)=c×V×Y,其中V为提取液体积(mL),Y为稀释倍数,并以异黄酮的提取量高低衡量异黄酮的提取效率,异黄酮的提取量高说明异黄酮的提取效率高.
2 结果与讨论
2.1 色谱分离分析条件的选择
据文献报道,白车轴草中所含的异黄酮主要是美皂异黄酮、染料木素和刺芒柄花素,其中刺芒柄花素的百分含量在80%以上,且由于染料木素和美皂异黄酮的含量随季节和产地的不同变化较大[12],故选刺芒柄花素作为标准对照品,并以刺芒柄花素的含量代表异黄酮的含量.
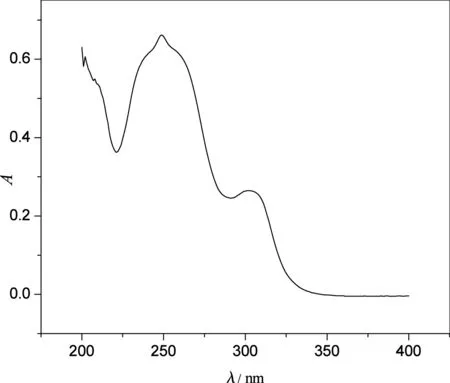
图1 刺芒柄花素的紫外吸收光谱
配制6 mg/L的刺芒柄花素标准溶液,在200~400 nm的波长范围内进行光谱扫描,得光谱图如图1所示.图1表明,标准溶液在249 nm处有最大吸收,故选择249 nm为测定波长.
用乙腈和水做流动相进行HPLC分析,流速设定为1.0 mL/min,改变乙腈-水的配比,发现以乙腈-水(v乙腈∶v水=53∶47)作流动相时能达到最佳分离效果,样品中各成分的保留时间短且分离效果好.刺芒柄花素标准溶液的色谱图和样品提取液的色谱图如图2和图3.对比图2和图3可知,样品提取液色谱图中峰1为刺芒柄花素的色谱峰.另外,在样品提取液的色谱图(图3)中,还有两个色谱峰-峰2和峰3,它们对应的紫外光谱图与峰1(刺芒柄花素)对应的紫外光谱图对比如图4.图4显示,图3中峰1对应的紫外光谱图与刺芒柄花素标准溶液的紫外光谱图形状完全一致,进一步说明图3中峰1是刺芒柄花素的色谱峰.而峰2和峰3的紫外光谱图与文献[13]报道的三叶草中其他异黄酮类化合物的紫外光谱图均不相符,说明峰2和峰3代表的物质不属于异黄酮类物质.为此,我们选择以刺芒柄花素含量来定量岳麓山白三叶总异黄酮含量.

图2 刺芒柄花素标准溶液的色谱图

图3 样品提取液的色谱图

图4 样品提取液色谱图(图3)中峰1(a)、峰2(b)和峰3(c)的紫外光谱
2.2 标准工作曲线
准确配制浓度分别为c=0、2.0、4.0、6.0、8.0和10.0 mg/L的刺芒柄花素标准溶液,分别经0.45 μm滤膜过滤,在选定色谱条件下进液相色谱分析,以刺芒柄花素色谱峰面积A对浓度c做图,发现刺芒柄花素浓度在0~10.0 mg/L 范围内,色谱峰面积与浓度呈良好线性关系,线性回归方程为A=59.26c-4.91,相关系数为r=0.999 8.
2.3 微波辅助提取单因素试验
2.3.1 固液比对异黄酮提取效率的影响 准确称取6份1.000 g的白三叶草样品,选用体积分数60%的乙醇作为提取溶剂,微波功率400 W,温度60 ℃,提取120 s,提取溶剂过滤后用60%的乙醇溶液定容至50 mL,进行色谱分析.考察了固液比分别为1∶5、1∶10、1∶15、1∶20、1∶25和1∶30时对异黄酮提取效率的影响,依次获得了119.5、144.0、172.9、188.9、191.7和194.0 μg的异黄酮提取量.结果说明,随着固液比的增加,白三叶草中异黄酮的提取效率依次增大.但当固液比达到1∶20后,再增大溶剂的用量,异黄酮的提取效率增加趋势趋于平缓,说明当固液比达到1∶20时,提取溶剂已经能够将样品中的异黄酮接近完全地提取出来.考虑到溶剂用量过大不利于后续的浓缩和纯化,从节能和提高工作效率角度考虑,我们选择固液比为1∶20开展后面的研究.
2.3.2 提取溶剂乙醇浓度对异黄酮提取效率的影响 选择1∶20的固液比,在2.3.1相同的条件下,考察了提取液乙醇体积分数分别为20%、40%、60%、80%和100%时,对异黄酮提取效率的影响,结果如图5.
由图5可知,随着乙醇浓度从20%增加到60%,白三叶草异黄酮提取效率不断增大,但当乙醇体积分数大于60%时,异黄酮的提取效率反而降低.根据文献[14]报道,黄酮类化合物在植物体内大多会与糖结合成甙,也有部分以游离状态的甙元形式存在.甙和极性较大的甙元,一般易溶于乙酸乙酯、丙酮、乙醇、甲醇、水或某些极性较大的混合溶剂.而大多的甙元易溶于极性较小的溶剂,如乙醚、氯仿等.为此,我们认为白三叶草异黄酮提取效率随乙醇浓度先增大后减小的原因,可能是因为刺芒柄花素在白三叶草中是以甙的形式存在,由于甙包括易溶于乙醇、难溶于水的刺芒柄花素甙元和易溶于水的糖基,因此,提取溶剂需要同时兼具较好的脂溶性和水溶性.增加提取溶剂中乙醇的浓度,有利于脂溶性甙元基团的溶解,从而增加了甙的提取效率;而更大浓度的乙醇,将不利于水溶性糖基的溶解,从而降低甙的提取效率.甙被提取出来后,在热的水溶液中,很容易被植物中存在的酶水解成甙元和糖.因此,甙的提取效率的高低直接决定着甙元(刺芒柄花素)提取效率的高低.结果说明,提取液乙醇体积分数选择60%为最佳.
2.3.3 提取时间对异黄酮提取效率的影响 选择提取液乙醇体积分数为60%,在2.3.2相同的条件下,考查了提取时间分别为20、60、80、120、140和180 s对提取效率的影响,结果如图6.

图5 乙醇浓度对异黄酮提取效率的影响
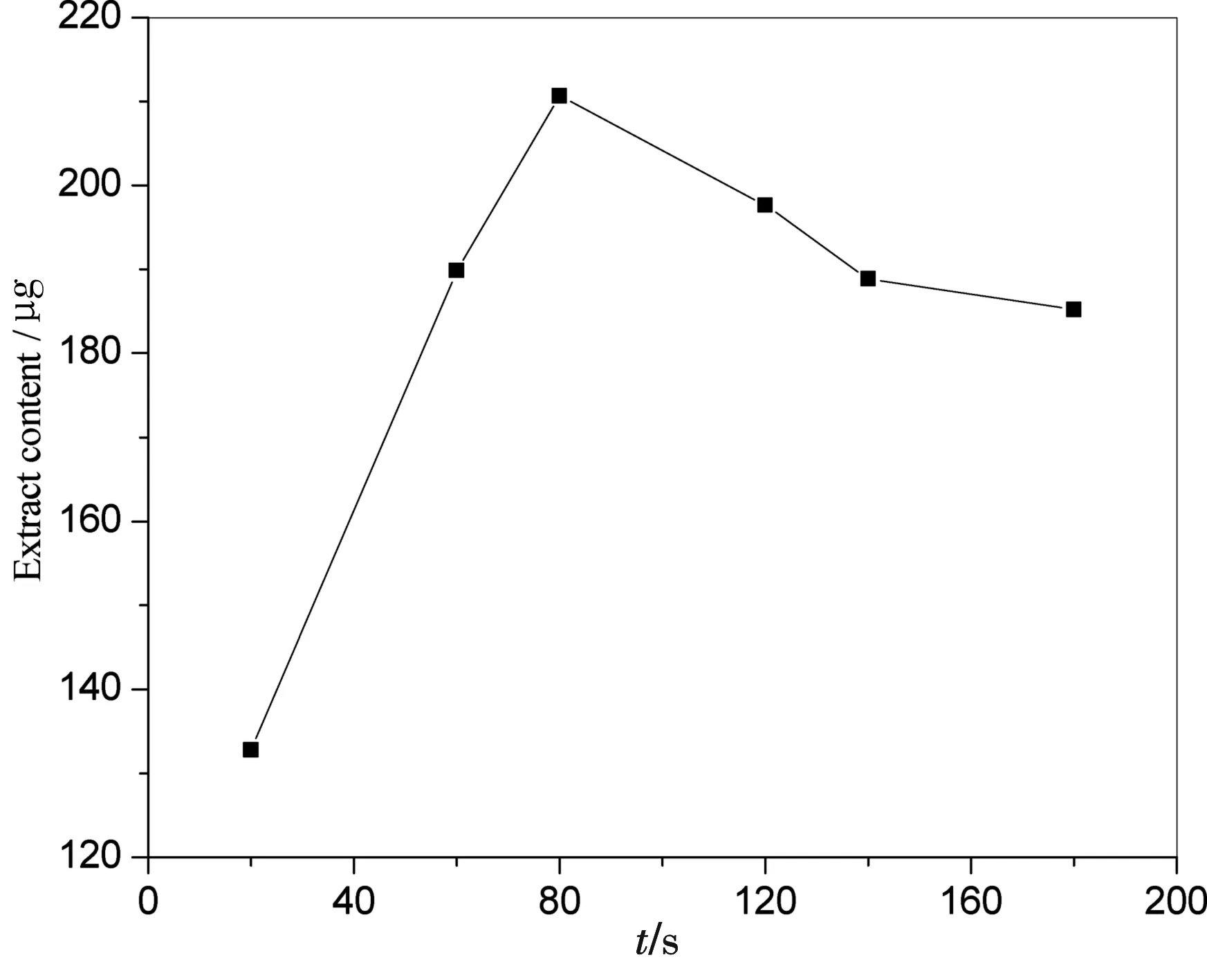
图6 微波提取时间对异黄酮提取效率的影响
由图6可知,随着提取时间的延长,异黄酮的提取效率在80 s内达到最大.但当提取时间大于80 s时,可能由于溶液温度过高,不仅易破坏异黄酮的物质结构,也会导致乙醇的挥发,异黄酮的提取效率反而减小.因此,微波辅助提取的提取时间选择80 s为宜.由以上条件实验可得到微波辅助提取的最佳条件为:乙醇体积分数60%,固液比1∶20,提取时间80 s.
2.4 超声辅助提取和回流提取法单因素试验
按照微波辅助提取相同的方法,考查了超声辅助提取法(超声功率为250 W)和回流提取法(回流温度为85 ℃)的提取条件,结果列于表1和表2.
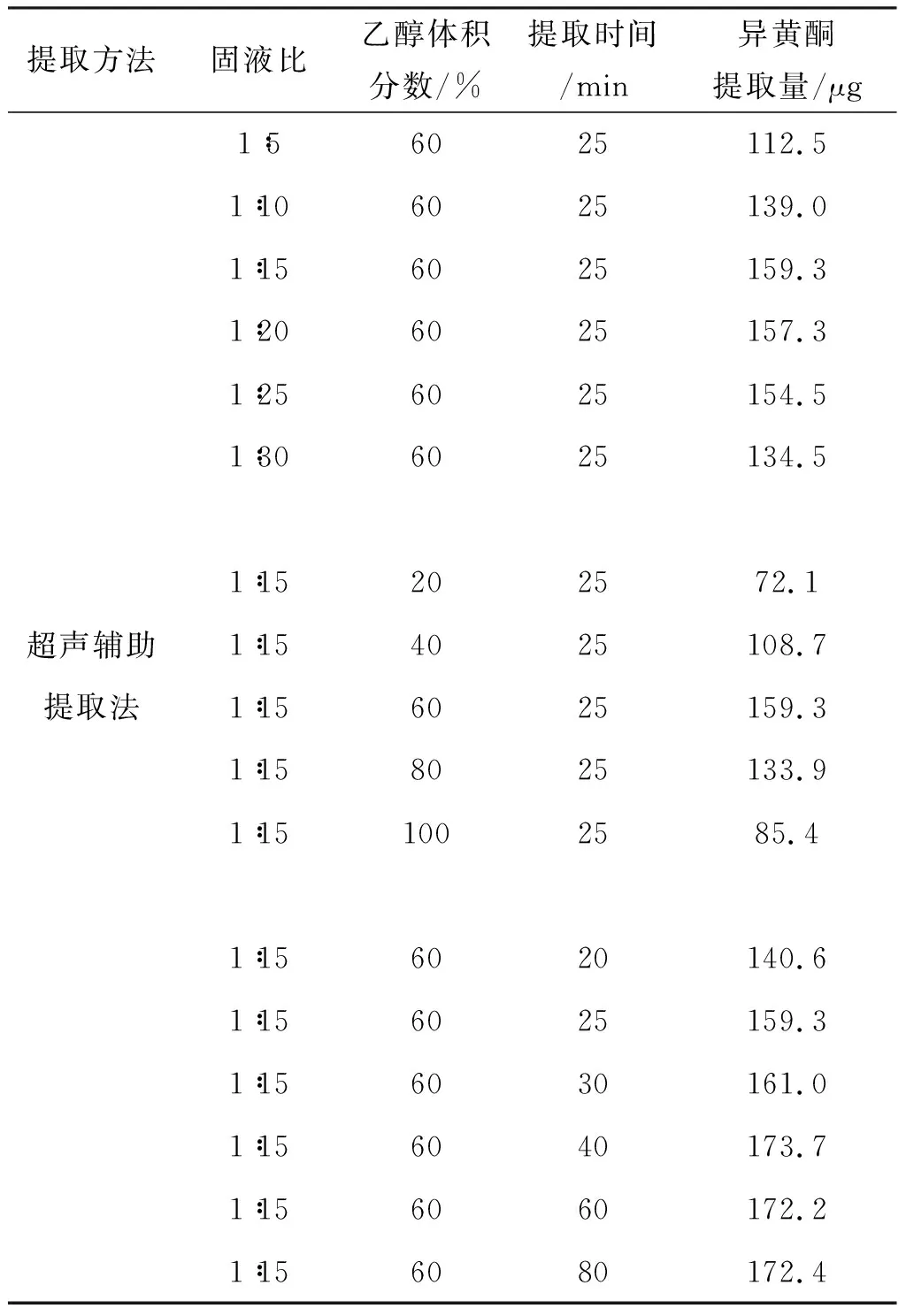
表1 超声辅助提取单因素试验结果
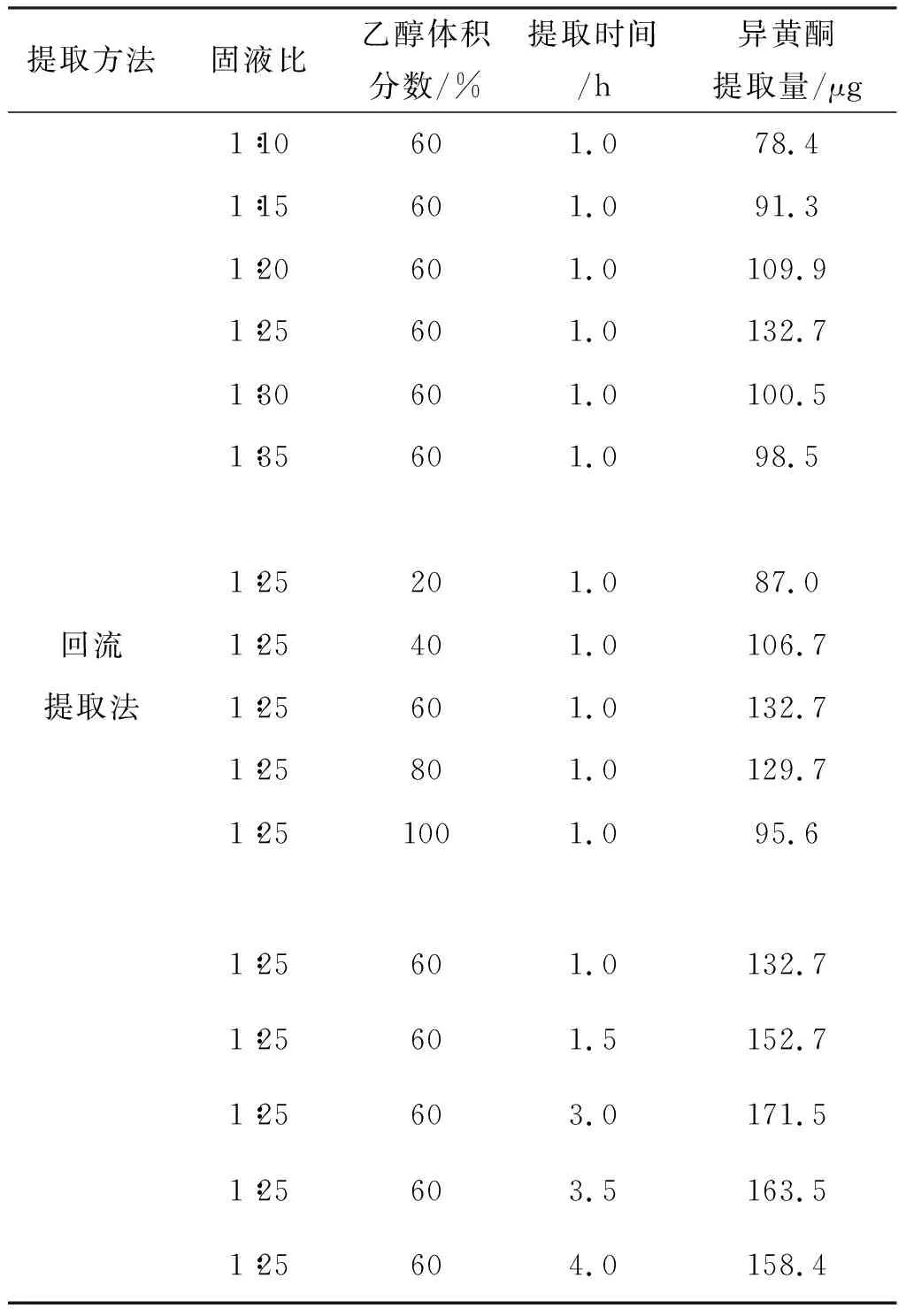
表2 回流法提取单因素试验结果
由表1可知,超声辅助提取的最佳提取条件是乙醇体积分数60%,固液比1∶15,提取时间40 min;回流提取法的最佳提取条件为乙醇体积分数60%,固液比1∶25,提取时间3 h.在最佳的提取条件下,超声辅助提取法和回流提取法分别获得了173.7 μg和的171.5 μg的异黄酮提取量.
比较3种提取方法说明,微波辅助提取所需提取时间短、异黄酮提取效率高.这是由于黄酮类化合物主要存在于细胞质中,被细胞壁包围而不易被提取.传统的热水、碱、有机溶剂提取法,受细胞壁主要成分纤维素的阻碍,使得提取效率较低.而微波是一种非电离的电磁辐射,被辐射物质的极性分子在微波电磁场中快速转向及定向排列,产生撕裂和相互摩擦引起发热,从而保证了能量的快速传递和充分利用[14],有利于在较短的时间内获得较高的提取效率.另外,与超声辅助提取法相比,微波辅助提取法几乎不产生噪音;与回流提取法相比,微波辅助提取法能大大节约能量.因此,微波辅助提取法是一种快速、高效和环境友好的方法.
3 结论
通过单因素试验考察了岳麓山白三叶草中异黄酮的几种提取方法,获得了最佳提取条件为:微波辅助提取:乙醇体积分数60%,固液比1∶20,微波时间80 s;超声辅助提取:乙醇体积分数60%,固液比1∶15,超声时间40 min;回流提取法:乙醇体积分数60%,固液比1∶25,回流时间3 h.在各自最佳实验条件下,进行对比实验,结果表明微波辅助提取法明显优于超声辅助提取法和回流提取法,其提取量可以达到210.6 μg(1.000 g样品),是一种省时、高效、环境友好的提取方法.研究采用常见、无毒、安全的乙醇溶液作为提取溶剂,避免了使用有毒有害提取溶剂给提取物带来的污染,符合药物安全规范,本文的研究结果可以为岳麓山白三叶异黄酮的合理、有效利用和开发提供有价值的参考.
参考文献:
[1] 国家中医药管理局《中华本草》编委会. 中华本草: 第4卷[M]. 上海: 上海科学技术出版社, 1999: 3418-3419.
[2] 江苏新医学院. 中药大辞典[K]. 上海: 上海科学技术出版社, 1992: 1012-1013.
[3] FOO L Y, LU Y, MOLAN A L,etal. The phenols and prodelphinidins of white clover flowers[J]. Phytochemistry, 2000, 54: 539-548.
[4] MAHER E P, HUGHES M A. Isolation of linamarin-lotaustralin fromTrifoliumrepens[J]. Phytochemistry, 1971, 10 (12): 3005-3007.
[5] KLEDJUS B, VITAMVSOV-TRBOVD, KUBV. Identification of isoflavone conjugates in red clover (Trifoliumpratense) by liquid chromatography-mass spectrometry after two-dimensional solid-phase extraction[J]. Anal Chim Acta, 2001, 450: 81-97.
[6] LAM A N C, DEMASI M, JAMES M J,etal. Effect of red clover isoflavones on Cox-2 activity in murine and human monocyte/macrophage cells[J]. Nutrition and Cancer, 2004, 49(1): 89-93.
[7] MEIJER G W, FRANKE W C, REDDY P R. Composition for lowing blood cholesterol:US, 6787151[P].2004-09-07.
[8] POTTER S M, HENLEY E C, TAYLOR R B. Hormone replacement therapy: US, 6326366[P].2001-12-04.
[9] PONCE M A, SCERVINO J M, ERRA-BALSELLS R,etal. Flavonoids from shoots and roots ofTrifoliumrepens(white clover) grown in presence or absence of the arbuscular mycorrhizal fungus Glomus intraradices[J]. Phytochemistry, 2004, 65: 1925-1930.
[10] 于丽娜, 张永忠, 辛 禹,等. 超声波法提取红三叶草总异黄酮的研究[J]. 食品工业科技, 2006, 27(9): 124-126.
[11] 金汝城, 赵国磊, 李贵文,等. 微波辅助提取红车轴草异黄酮的工艺研究[J]. 食品科学, 2007, 28(9): 165-168.
[12] 徐桂花. 三叶草春季植物雌激素的含量变化及种和品种间差异[D]. 南京:南京农业大学, 2005.
[13] DE RIJKE R, ZAPPEY H, ARIESE F,etal. Flavonoids in leguminosae: analysis of extracts ofT.pratenseL.,T.dubiumL.,T.repensL., andL.corniculatusL. leaves using liquid chromatography with UV, mass spectrometric and fluorescence detection[J]. Anal Bioanal Chem, 2004, 378: 995-1006.
[14] 李凤林, 李青旺, 冯彩宁, 等. 天然黄酮类化合物提取方法研究进展[J]. 中国食品添加剂, 2008(5): 60-64.

