Ag含量对钙钛矿型La-Ca-Co-O氧还原催化剂电催化特性的影响
张正富, 马全宝, 陈庆华
(昆明理工大学 材料科学与工程学院,昆明650093)
Ag含量对钙钛矿型La-Ca-Co-O氧还原催化剂电催化特性的影响
张正富, 马全宝, 陈庆华
(昆明理工大学 材料科学与工程学院,昆明650093)
为了提高钙钛矿型 La-Ca-Co-O的氧还原催化性能,采用柠檬酸辅助的溶胶-凝胶法制备添加 AgNO3的La0.4Ca0.6CoO3粉体。采用XRD、SEM和EDAX分析手段研究凝胶在700 ℃焙烧后的产物,通过电位阶跃技术测定不同Ag含量粉体的电化学有效表面积。通过线性扫描伏安法测定催化剂粉体催化氧还原反应的极化特性;通过 Tafel技术测定其催化氧还原反应的交换电流密度。采用粉末压片和直流电路测定催化剂的表观电导率。结果表明:Ag+固溶入La0.4Ca0.6CoO3晶格导致晶格膨胀;添加AgNO3的粉体中还有单质Ag颗粒析出。在La0.4Ca0.6CoO3中引入 Ag+可显著提高其对氧还原的电催化活性,在 Ag含量为 2%时,催化氧还原的交换电流密度达到最大值0.298 8 A/m2;而La0.4Ca0.6CoO3的表观电导率随着Ag含量增加而增大。
钙钛矿型催化剂;氧还原;Ag含量;交换电流密度;电导率
钙钛矿型氧化物具有ABO3结构通式,用不同价态离子置换A位或B位离子时,为了电荷平衡,在其晶格中会形成阳离子空位或阴离子空位;当B位离子为可变价的过渡金属离子时,也可通过B位离子的变价来实现电荷平衡。用不同价态离子置换A位或B位离子时导致ABO3禁带中形成施主或受主能级,使化合物具有半导体性,显著改变其电子电导率。当B位离子为过渡金属离子时,钙钛矿氧化物对诸如甲烷重整[1-3]、CO催化氧化[4-5]、催化燃烧[6-8]、NOx催化除去[9-11]、挥发性有机化合物的氧化[12-13]、甲醇阳极催化氧化[14-15]和氧还原等化学反应[16-18],都表现出明显的催化活性。尤其其在碱性介质中催化氧还原时,过渡金属钙钛矿氧化物,如La-Ca-Co-O和La-Ca-Mn-O,表现出了接近于Pt的催化活性。但是,作为半导体的掺杂钙钛矿化合物,其电子电导率仍然很低,而作为电催化剂,较高的电子电导率是其基本要求之一。提高这类复合氧化物电催化剂的电子电导率一直是学术界努力的重点之一。以往研究的努力方向基本都是通过A位或B位的离子替换以提高载流子浓度,但效果有限。近年来,在NOx催化分解、催化燃烧和甲烷重整等领域,从提高催化活性出发,贵金属/钙钛矿氧化物复合体系催化剂得到了较广泛的研究[4,19-21]。这自然让我们联想到采用金属与钙钛矿氧化物的复合体系有可能提高钙钛矿氧化物电催化剂的电导率,同时,当添加的金属对氧还原也有良好的催化活性时,则有可能使二者的催化活性起到协同加强的作用,得到电导率高、催化活性优良、同时成本增加不大的催化剂。基于此设想,在本文作者采用在 La-Ca-Co-O中添加对氧还原有较高催化活性的银,研究添加的银对催化剂的结构、形貌、电导率、电催化活性的影响。
1 实验
以分析纯的硝酸钙 Ca(NO3)2·4H2O、硝酸钴Co(NO3)2·6H2O、硝酸镧 La(NO3)3·nH2O、硝酸银AgNO3、柠檬酸C6H8O7·H2O为原料,蒸馏水为溶剂,采用柠檬酸辅助的溶胶-凝胶法制备了含 Ag的La0.4Ca0.6CoO3粉体。用日本理学D/Max2200 X射线衍射仪分析相结构;用Philips Quanta 200扫描电子显微镜观察形貌并测定微区成分。采用CHI660A电化学工作站和粉末微电极构成的测试系统表征粉末的电催化特性,电催化活性用交换电流密度表征。粉末微电极的制作方法为,采用直径为100 μm的铂丝用低熔点玻璃封接后,再用热王水腐蚀至微孔深约为100 μm,电化学测试前,将粉末样品填入微孔中[22]。运用三电极体系,通过电位阶跃技术测定粉末电极的真实电化学有效表面积,电解液采用0.1 mol/L的KCl水溶液,以标准饱和甘汞电极为参比电极;用粉末压制烧结、抛光后的陶瓷片作为测定有效表面积的对比基准。通过 Tafel技术测定电催化反应的交换电流,并计算交换电流密度,计算中涉及的面积采用粉末微电极的电化学有效表面积;采用线性扫描伏安法测定催化剂催化氧还原反应的极化特性。Tafel和线性扫描伏安测定过程中,电解液为6 mol/L的KOH水溶液、参比电极为标准Hg/HgO电极,用纯氧饱和电解液,并且在整个测量过程中保持通入纯氧。将粉末压片后,在其两个面上涂上导电银胶并粘上电极,用数字万用表测定压片的电阻,用千分尺测定压片几何尺寸,再计算表观电导率。压制压片的压强为20 MPa。测定电导率和交换电流密度时,每个数据点重复测量5次,然后去掉最高值和最低值,取中间3个数据的平均值作为实验值。
2 结果与讨论
2.1 添加银对粉体相结构的影响
图 1 所示为 La0.4Ca0.6CoO3、La0.4Ca0.6CoO3+2%Ag(总质量分数,下同)、La0.4Ca0.6CoO3+4%Ag的催化剂粉体的XRD谱,样品都经700 ℃焙烧。从图1中可看出,La0.4Ca0.6CoO3粉体结晶度较好,形成了以钙钛矿结构为主的相组成,主要以 La0.6Ca0.4CoO3、Ca2Co2O5两种相存在。La0.4Ca0.6CoO3+2%Ag粉体的相组成为 La0.6Ca0.4CoO3、Ca2Co2O5和单质 Ag;La0.4Ca0.6CoO3+4%Ag粉体也主要由 La0.6Ca0.4CoO3、Ca2Co2O5和单质Ag等3种相组成,且其单质Ag的衍射峰比 La0.4Ca0.6CoO3+2%Ag粉体的更明显,说明单质Ag的析出量较大。
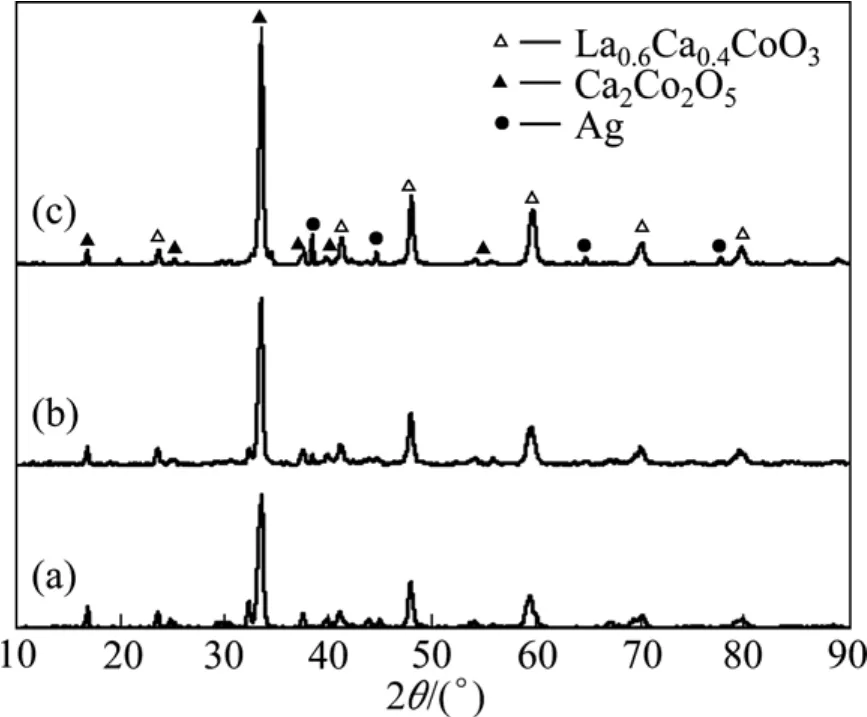
图1 在700 ℃焙烧后粉体的XRD谱Fig.1 XRD patterns of powders sintered at 700 ℃: (a)La0.6Ca0.4CoO3; (b) La0.4Ca0.6CoO3 + 2%Ag; (c) La0.4Ca0.6CoO3 +4%Ag
从文献[23]中查到,在六配位情况下:La3+半径为1.032 Å,Co3+半径为 0.545 Å(低自旋)及 0.61 Å (高自旋),Co2+半径为 0.65 Å(低自旋)及 0.745 Å(高自旋),Ag+半径为 1.15 Å,Ca2+半径为 1.00 Å。Ag+半径比 La3+半径大11.43%,但与其他离子相比,Ag+半径和La3+半径最接近。因此,当发生置换时,Ag+只可能替代La3+,但又由于 Ag+半径比 La3+半径大,为了保持原有的钙钛矿结构,部分 Ag+以单质 Ag的形式析出,这就是图1中出现Ag衍射峰的原因。
另外,根据衍射数据进行计算可得La0.4Ca0.6CoO3粉体、La0.4Ca0.6CoO3+2%Ag粉体和 La0.4Ca0.6CoO3+4%Ag粉体的晶格常数a(体心立方)分别为3.808 5 Å、3.812 7 Å和3.811 3 Å。从晶格常数的大小可知,加Ag+后钙钛矿均发生晶格常数变大、晶格膨胀,表明添加的 Ag+确实固溶入钙钛矿晶格中,部分替代了La3+。La0.4Ca0.6CoO3+2%Ag的晶格膨胀相对最大,此时 Ag+在晶格中应该具有较大固溶量,同时还保持了钙钛矿结构的稳定性;La0.4Ca0.6CoO3+4%Ag的晶格常数比添加La0.4Ca0.6CoO3+2%Ag的小,说明随Ag+的固溶量增加,晶格膨胀带来的能量增加不利于钙钛矿结构稳定,故而通过析出单质 Ag来减小晶格膨胀,降低能量。
2.2 催化剂粉体的显微形貌和微区成分分析
图2所示为La0.4Ca0.6CoO3+2%Ag粉体的背散射SEM像。由图2可见,粉末呈含大量孔网的鳞片状,其中还有单质Ag析出,并且分布不均匀,Ag颗粒直径在1~3 µm之间。图3所示为图2中亮点的元素组成(EDAX谱)。从图3中可看出,亮点主要由Ag组成。由背散射电子像和能谱图可判定粉体中有富Ag区域,再根据前述X射线衍射相结构分析,可判定粉体中有单质Ag析出。图4所示为粉体元素组成(EDAX谱)。从图4中可看出,粉体中包含La、Ca、Co、O、Ag、C等6种元素,C峰的存在是柠檬酸高温分解后少量C残留在粉体中所造成的。
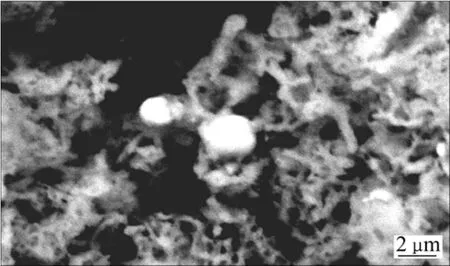
图2 La0.4Ca0.6CoO3+2%Ag粉体的BSE像Fig.2 BSE image of La0.4Ca0.6CoO3+2%Ag powders
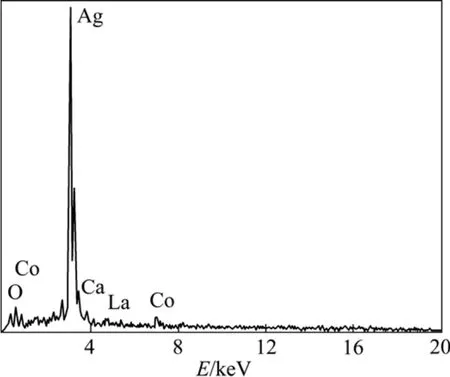
图3 图2中亮点的元素组成(EDAX谱)Fig.3 Element composition of bright spot in Fig. 2 (EDAX spectra)
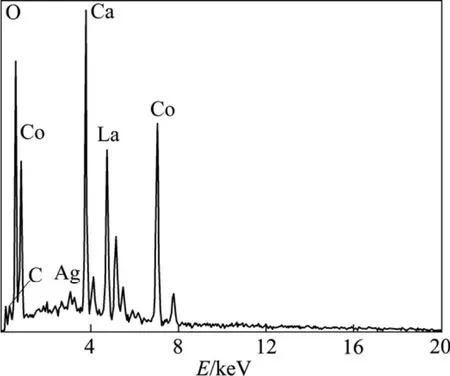
图4 La0.4Ca0.6CoO3+2%Ag粉体的元素组成(EDAX谱)Fig.4 Element composition of La0.4Ca0.6CoO3+2%Ag powder(EDAX spectra)
2.3 添加Ag对催化剂电催化特性的影响
2.3.1 粉末微电极有效表面积的测定
采用测量电极表面双电层电容的方法来测定粉末微电极的电化学有效表面积,而双电层电容采用电位阶跃技术(或计时电流法)测量。其电化学有效表面积的测量计算如下所述:
若已知某材质电极在一定条件下单位真实表面积的双电层电容值,又在同样条件下用实验测得多孔电极的双电层电容,由此可算得相同材质的多孔电极的真实电化学有效表面积S[22]:

式中:C为多孔电极的双电层电容;C0为单位平整表面的双电层电容。
表面平整的电极的制作及其单位面积双电层电容的测定如下:
首先,将La0.4Ca0.6CoO3粉末在20 MPa下压成圆片,然后在900 W微波炉中满功率焙烧9 min烧结致密,用金相砂纸抛光后,测得其底面面积为 80.078 cm2。将其一面用银导电胶涂覆并粘上导线,然后用环氧树脂封装,仅暴露面积为80.078 cm2的底面。在0.1 mol/L 的KCl溶液中进行电位阶跃测试,阶跃电压为ΔU=0.5 V,在0~0.25 s范围内对I—t曲线进行数值积分,由式可求出吸附在电极表面的电量ΔQ,对于该平整的电极,ΔQ=5.486 69×10-4C。最后,由C=dQ/dU=ΔQ/ΔU可求出电极的双电层电容,C=1.097 3×10-3F。由此可算出在该电化学测试条件下,La0.4Ca0.6CoO3单位平整表面的双电层电容值C0=C/S=13.703 4 F/m2,该值作为粉末微电极真实电化学有效表面积测定的比较基准。
将不同 Ag含量的粉末微电极在与上述相同的电化学测试条件下测定电位阶跃曲线。图5和6所示分别为 La0.4Ca0.6CoO3粉末微电极和 La0.4Ca0.6CoO3+2%Ag粉末微电极的电位阶跃曲线。然后,按上述方法计算不同 Ag含量的粉末微电极的表面双电层电容值,最后,用式(1)计算它们的真实电化学有效表面积,结果列于表1。
2.3.2 Ag含量对交换电流密度的影响
交换电流密度是表征电化学反应动力学的基本参数,也是表征电化学催化剂内禀催化活性的基本参数,故本研究通过交换电流密度来比较不同 Ag含量对La0.4Ca0.6CoO3电催化活性的影响。交换电流密度采用Tafel曲线图解法求取,具体方法可参考文献[22]。将表1所列不同Ag含量的催化剂粉体进行了Tafel测试,图 7和 8所示分别为 La0.4Ca0.6CoO3粉末微电极和La0.4Ca0.6CoO3+2%Ag粉末微电极的Tafel曲线。根据Tafel曲线图解计算得到的各样品的交换电流密度值列于表1中。图9所示为Ag含量与交换电流密度的关系图。从图9可看出,添加2%Ag的粉体交换电流密度最大,表面积也最大,因而催化活性最高。
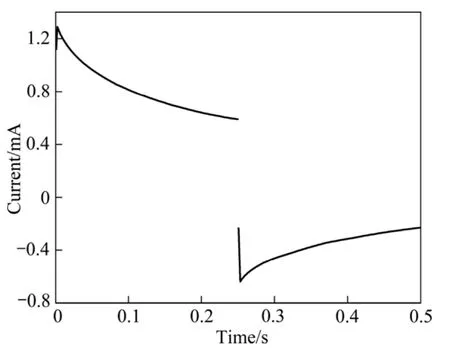
图5 La0.4Ca0.6CoO3粉末微电极的电位阶跃曲线Fig.5 Potential step chronoamperometry curve for La0.4Ca0.6CoO3 powders microelectrode
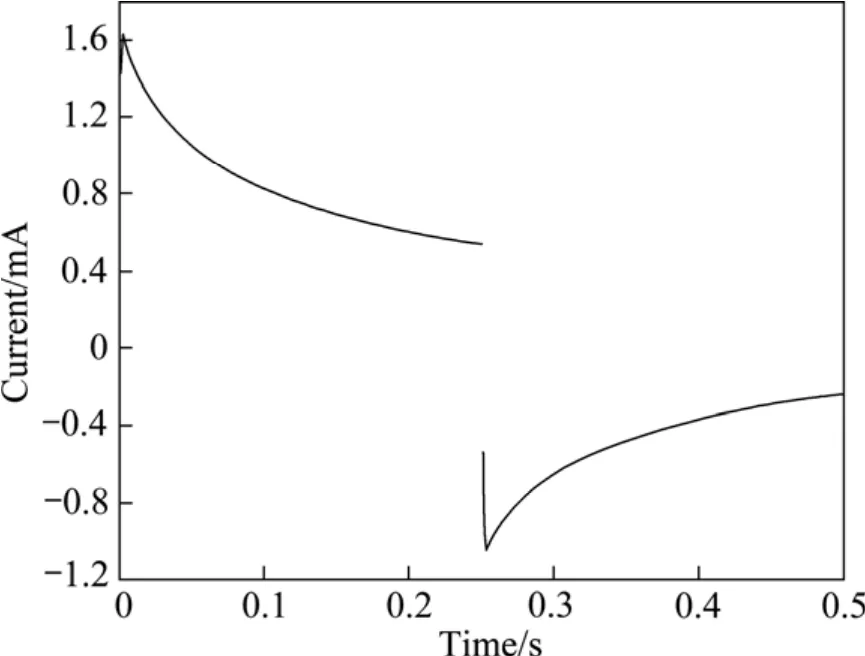
图6 La0.4Ca0.6CoO3+2% Ag粉末微电极的电位阶跃曲线Fig.6 Potential step chronoamperometry curve for La0.4Ca0.6CoO3+2%Ag powders microelectrode
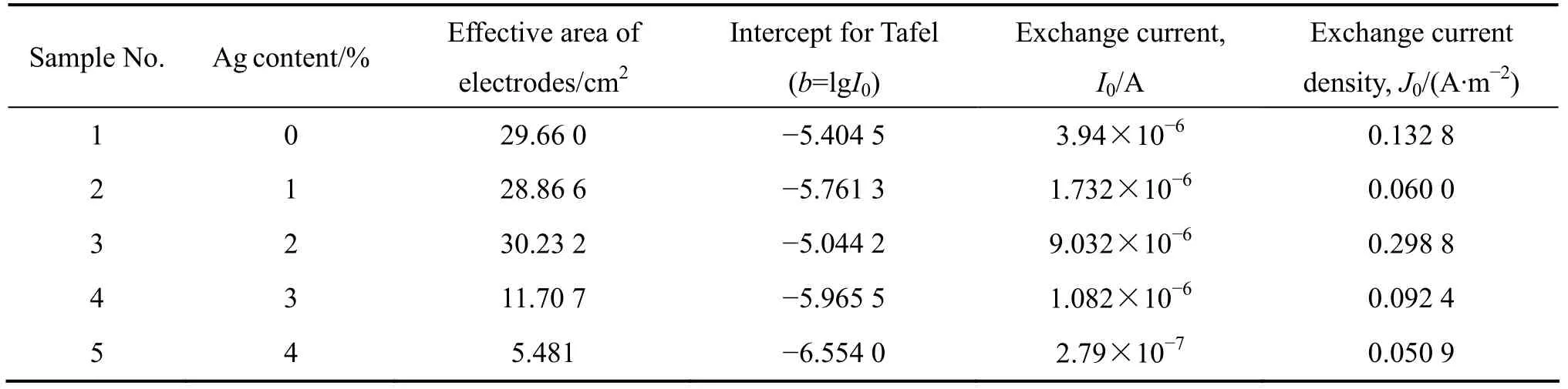
表1 不同Ag含量La0.4Ca0.6CoO3样品的实验数据(样品焙烧温度为700 ℃)Table 1 Experiment data of La0.4Ca0.6CoO3 with different Ag contents (Samples sintered at 700 ℃)
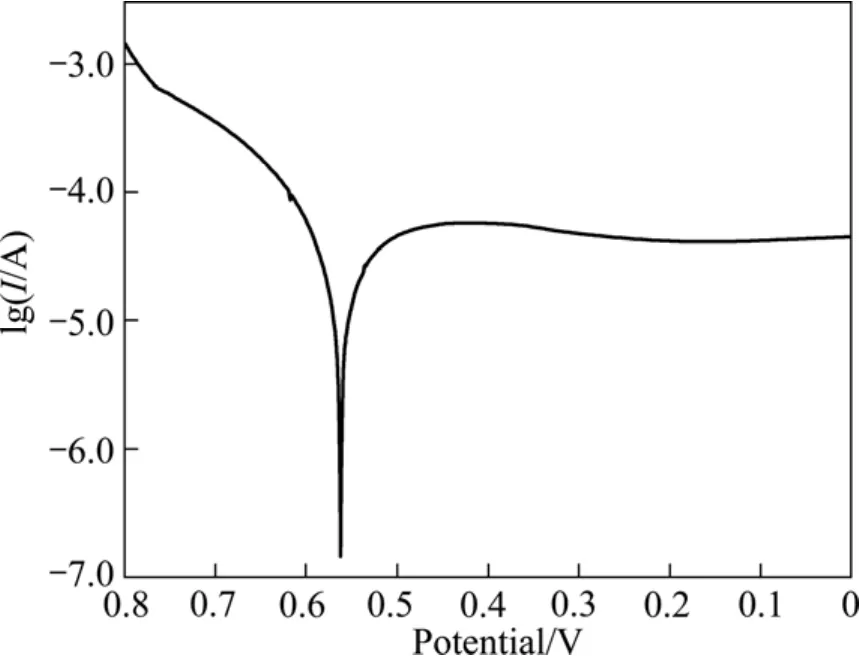
图7 La0.4Ca0.6CoO3粉末微电极的Tafel曲线Fig.7 Tafel curve of La0.4Ca0.6CoO3 powders microelectrode
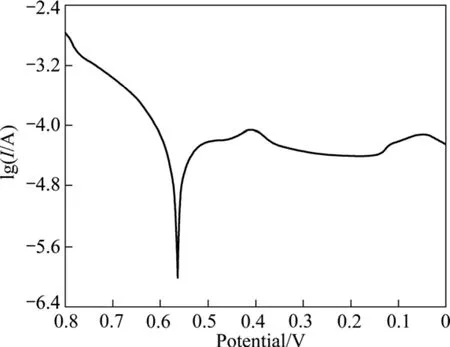
图8 La0.4Ca0.6CoO3+2%Ag粉末微电极的Tafel曲线Fig.8 Tafel curve of La0.4Ca0.6CoO3+2%Ag powders microelectrode
由离子半径及X射线衍射分析可知,Ag+固溶入La0.4Ca0.6CoO3晶格后,只可能替代La3+,并导致晶格膨胀。为了电荷平衡,此时,要形成氧离子空位,导致附近的B位Co3+的配位数减小、能量升高,使其与扩散到其表面的氧分子的作用加强。氧分子的未成对电子传递给钴离子的3d轨道,而3d轨道的电子传递到氧分子的 π*反键轨道,这样就能削弱氧原子-氧原子间的键合,使氧分子活化,进而促使氧-氧键断裂,形成吸附氧 Oads。一般认为,钙钛矿氧化物催化氧还原时是按四电子反应机理进行的,此时,吸附氧通过如下反应被还原为OH-:

表面氧空位的增多,也有利于O2-沿表面的扩散迁移,增大其与H2O反应的几率。
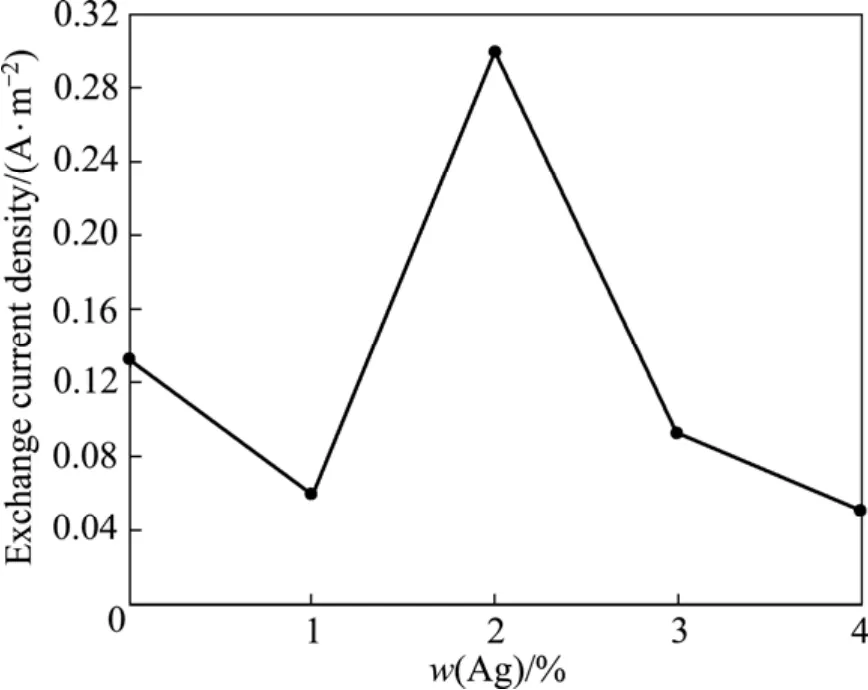
图9 Ag含量对交换电流密度的影响Fig.9 Effect of Ag content on exchange current density
当 Ag+的固溶量不足时,上述效应不明显;当晶格中 Ag+的固溶量增大,且仍能维持钙钛矿结构稳定时,上述替代效应的作用增大;但是当银含量进一步增加时,固溶导致的晶格畸变增大,则会使部分固溶的Ag+以单质Ag0的形式析出,X射线衍射分析也表明,添加 4%Ag的样品的晶格常数反而略小于添加2%Ag的样品。这些析出的 Ag0可能会包裹于La0.4Ca0.6CoO3颗粒内部,这样虽然Ag对氧还原也有良好的催化活性,但确不能发挥出来,同时,由于大部分固溶的Ag+以Ag0的形式析出,固溶替代引起的钙钛矿氧化物的催化增强效应又被削弱,因而,反倒使催化活性降低。这就在实验上表现为观察到的La0.4Ca0.6CoO3+2%Ag粉体的电催化活性最高,而La0.4Ca0.6CoO3+4%Ag粉体的反而降低。
图10所示为不同Ag含量的催化剂粉体的线性扫描伏安曲线。从图10中可看出,在极化过电位相同的情况下,添加2%Ag的催化剂粉体电流密度最大,催化氧还原反应的催化活性最高;各粉体的催化活性按由高到低的顺序为(c)>(a)>(d)>(b)>(e)。这与 Tafel曲线所得催化活性的顺序一致,也说明了交换电流密度的测试计算是可靠的。
2.4 添加Ag对催化剂电导率的影响
经700 ℃焙烧后不同Ag含量的La0.4Ca0.6CoO3样品测得的数据及电导率计算结果列于表2中。图11所示为Ag含量与表观电导率的关系。从图11中可看出,La0.4Ca0.6CoO3的表观电导率随添加 Ag含量的增加而增大,这主要是因为Ag+添加得越多,析出的Ag单质也相应增多,Ag颗粒之间的接触概率增大,由于 Ag是电子的优良导体,故而,样品的电导率随之增大。
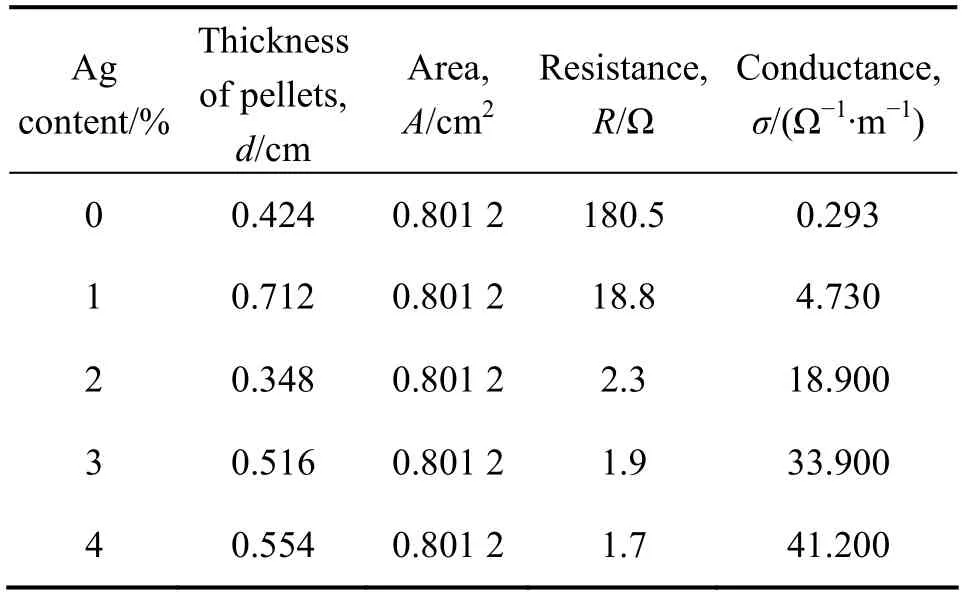
表2 Ag含量与La0.4Ca0.6CoO3表观电导率关系的实验数据Table 2 Experiment data of apparent conductance of La0.4Ca0.6CoO3 and Ag content
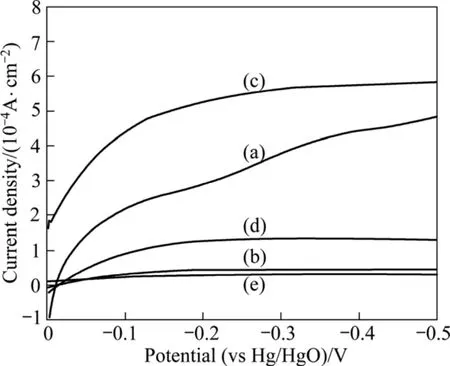
图10 不同Ag含量的La0.4Ca0.6CoO3样品的LSV曲线Fig.10 LSV curves of La0.4Ca0.6CoO3 with different Ag contents: (a) 0% Ag; (b) 1%Ag; (c) 2%Ag; (d) 3%Ag; (e) 4%Ag
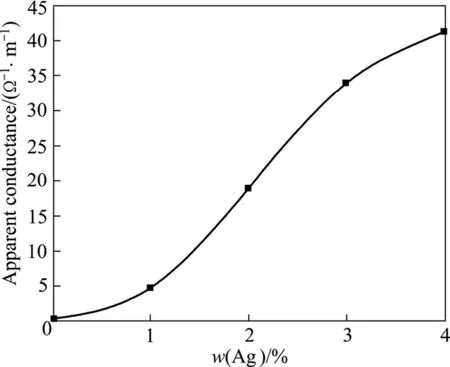
图11 Ag含量与表观电导率的关系Fig.11 Relationship between apparent conductance and Ag content
3 结论
1) 在溶胶-凝胶法制备 La0.4Ca0.6CoO3配料过程中添加AgNO3,样品经700 ℃焙烧后,Ag+可以部分固溶在晶格中,导致晶格膨胀;同时,多余的 Ag+会以单质 Ag形式析出,析出的 Ag颗粒尺寸约为 1~3 μm,在粉体中分布不均匀。
2) 在 La0.4Ca0.6CoO3中引入 Ag+可显著提高其对氧还原的电催化活性。在Ag含量为2%时,催化氧还原的交换电流密度达到最大值0.298 8 A/m2;Ag含量进一步增加时,交换电流密度又下降,原因是晶格中Ag+的固溶量减小了。
3) La0.4Ca0.6CoO3的表观电导率随着Ag含量的增加而增大。在Ag含量为2%时,表观电导率达到18.9 S/m;在Ag含量为4%时,表观电导率为41.2 S/m。
REFERENCES
[1] GALLEGO G S, MONDRAGÓN F, BARRAULT J,TATIBOUËT J-M, BATIOT-DUPEYRAT C. CO2reforming of CH4over La-Ni based perovskite precursors[J]. Applied Catalysis A: General, 2006, 311: 164-171.
[2] VALDERRAMA G, KIENNEMANN A, GOLDWASSER M R.La-Sr-Ni-Co-O based perovskite-type solid solutions as catalyst precursors in the CO2reforming of methane[J]. Journal of Power Sources, 2010, 195: 1765-1771.
[3] CHOI S O, MOON S H. Performance of La1-xCexFe0.7Ni0.3O3perovskite catalysts for methane steam reforming[J]. Catalysis Today, 2009, 146: 148-153.
[4] PETROVIĆA S, RAKIĆ V, JOVANOVIĆ D M, BARIČEVIĆ A T. Oxidation of CO over Ru containing perovskite type oxides[J]. Applied Catalysis B: Environmental, 2006, 66:249-257.
[5] BULGAN G, 滕 飞, 梁淑惠, 姚文清, 朱永法. Cu掺杂对LaMnO3催化剂的结构和催化氧化性能的影响[J]. 物理化学学报, 2007, 23(9): 1387-1392.BULGAN G, TENG Fei, LIANG Shu-hui, YAO Wen-qing,ZHU Yong-fa. Effect of Cu doping on the structure and catalytic activity of LaMnO3catalyst[J]. Acta Phys-Chim Sin, 2007, 23(9):1387-1392.
[6] RIDA K, BENABBAS A, BOUREMMAD F, PENA M A,SASTRE E, MARTÍNEZ-ARIAS A. Effect of calcination temperature on the structural characteristics and catalytic activity for propene combustion of sol-gel derived lanthanum chromite perovskite[J]. Applied Catalysis A: General, 2007, 327:173-179.
[7] IOJOIU E E, BASSOU B, GUILHAUME N, FARRUSSENG D,DESMARTIN-CHOMEL A, LOMBAERT K, BIANCHI D,MIRODATOS C. High-throughput approach to the catalytic combustion of diesel soot[J]. Catalysis Today, 2008, 137:103-109.
[8] 王宴秋, 胡瑞生, 武 鹏, 苏海全. Mg掺杂对稀土钙钛矿型LaCrO3催化剂的结构和甲烷催化燃烧性能的影响[J]. 工业催化, 2006, 14(3): 56-58.WANG Yan-qiu, HU Rui-sheng, WU Peng, SU Hai-quan.Effects of magnesium doping on structure and methane combustion performance of rare-earth perovskite LaCrO3catalysts[J]. Industrial Catalysis, 2006, 14(3): 56-58.
[9] STATHOPOULOS V N, BELESSI V C, BAKAS T V,NEOPHYTIDES S G, COSTA C N, POMONIS P J,EFSTATHIOU A M. Comparative study of La-Sr-Fe-O perovskite-type oxides prepared by ceramic and surfactant methods over the CH4and H2lean-deNOx[J]. Applied Catalysis B: Environmental, 2009, 93: 1-11.
[10] ZHU Y J, WANG D, YUAN F L, ZHANG G, FU H G. Direct NO decomposition over La2-xBaxNiO4catalysts containing BaCO3phase[J]. Applied Catalysis B: Environmental, 2008, 82:255-263.
[11] ZHU J J, THOMAS A. Perovskite-type mixed oxides as catalytic material for NO removal[J]. Applied Catalysis B: Environmental,2009, 92: 225-233.
[12] BARBERO B P, GAMBOA J A, CADÚS L E. Synthesis and characterisation of La1-xCaxFeO3perovskite-type oxide catalysts for total oxidation of volatile organic compounds[J]. Applied Catalysis B: Environmental, 2006, 65: 21-30.
[13] LI W B, WANG J X, GONG H. Catalytic combustion of VOCs on non-noble metal catalysts[J]. Catalysis Today, 2009, 148:81-87.
[14] BALASUBRAMANIAN A, KARTHIKEYAN N, GIRIDHAR V V. Synthesis and characterization of LaNiO3-based platinum catalyst for methanol oxidation[J]. Journal of Power Sources,2008, 185: 670-675.
[15] DESHPANDE K, MUKASYAN A, VARMA A. High throughput evaluation of perovskite-based anode catalysts for direct methanol fuel cells[J]. Journal of Power Sources, 2006,158: 60-68.
[16] HAMMOUCHE A, KAHOUL A, SAUER D U, DE DONCKER R W. Influential factors on oxygen reduction at La1-xCaxCoO3electrodes in alkaline electrolyte[J]. Journal of Power Sources,2006, 153: 239-244.
[17] SINGH R N, ANINDITA M M, SINHA A S K, CHARTIER P.Polypyrrole and La1-xSrxMnO3(0≤x≤0.4) composite electrodes for electroreduction of oxygen in alkaline medium[J].Electrochimica Acta, 2007, 52: 4264-4271.
[18] CHANG Y M, WU P W, WU C Y, HSIEH Y C. Synthesis of La0.6Ca0.4Co0.8Ir0.2O3perovskite for Bi-functional catalysis in an alkaline electrolyte[J]. Journal of Power Sources, 2009, 189:1003-1007.
[19] PECCHI G, CAMPOS C M, JILIBERTO MG, DELGADO E J,FIERRO J L G. Effect of additive Ag on the physicochemical and catalytic properties of LaMn0.9Co0.1O3-δperovskite[J].Applied Catalysis A: General, 2009, 371: 78-84.
[20] NAVARRO R M, ALVAREZ-GALVAN M C, VILLORIA J A,GONZÁLEZ-JIMÉNEZ I D, ROSA F, FIERRO J L G. Effect of Ru on LaCoO3perovskite-derived catalyst properties tested in oxidative reforming of diesel[J]. Applied Catalysis B:Environmental, 2007, 73: 247-258.
[21] SEKINE Y, TAKAMATSU H, ARAMAKI S, ICHISHIMA K,TAKADA M, MATSUKATA M, KIKUCHI E. Synergistic effect of Pt or Pd and perovskite oxide for water gas shift reaction[J]. Applied Catalysis A: General, 2009, 352: 214-222.
[22] 查全性. 电极过程动力学导论[M]. 三版. 北京: 科学出版社,2002: 129-168, 236-281, 345-375.ZHA Quan-xing. Introduction to kinetics of electrode process[M].3rd ed. Beijing: Science Press, 2002: 129-168, 236-281,345-375.
[23] SPEIGHT J G. Lange’s handbook of chemistry[M]. 16th ed.New York: McGraw-Hill Companies, Inc, 2005: 1.151-1.156.
Effect of Ag content on electrocatalytic properties of perovskite-type La-Ca-Co-O to oxygen reduction
ZHANG Zheng-fu, MA Quan-bao, CHEN Qing-hua
( Faculty of Materials Science and Engineering,Kunming University of Science and Technology, Kunming 650093, China )
In order to improve electrocatalytic property to oxygen reducing, the La0.4Ca0.6CoO3powders with AgNO3addition were prepared through citric acid sol-gel method. After being annealed at 700 ℃, the products were studied by XRD, SEM and EDAX. The electrochemical effective area of powders was determined through CA technology. The electrochemical polarization of powder for catalyzing oxygen reduction was investigated by LSV technology. The exchange current density was measured through Tafel technology. The apparent conductance of powder pellet was measured by DC method. The result shows that the silver ion dissolves into La0.4Ca0.6CoO3lattice and brings on the latter expanding, the metal silver particles are affirmed in the microstructure. The electrocatalysis activity to oxygen reducing can be improved remarkably by introducing silver ion into La0.4Ca0.6CoO3lattice. The maximum exchange current density,0.298 8 A/m2, can be obtained when the silver content (mass fraction) is 2%. In addition, the apparent conductance increases with increasing the silver content.
perovskite catalyst; oxygen reduction; silver content; exchange current density; conductance
TQ426.7,O643.3
A
1004-0609(2011)05-1111-07
云南省高等学校教学、科研带头人培养计划资助项目(2004年度)
2010-05-21;
2010-10-28
张正富, 副教授, 博士; 电话:0871-5109952; 传真:0871-5107922; E-mail:zhang_zhengf@yahoo.com.cn
(编辑 何学锋)

