Wnt在胰岛素抵抗大鼠海马Aβ沉积中的作用及罗格列酮治疗前后Aβ的变化
杨思思, 张晓洁, 张木勋
(华中科技大学同济医学院附属同济医院内分泌科, 湖北 武汉 430030)
Wnt在胰岛素抵抗大鼠海马Aβ沉积中的作用及罗格列酮治疗前后Aβ的变化
杨思思, 张晓洁, 张木勋△
(华中科技大学同济医学院附属同济医院内分泌科, 湖北 武汉 430030)
目的探讨经典Wnt通路中的配体Wnt3a及下游胞内的β-catenin与胰岛素抵抗(IR)大鼠模型海马中β淀粉样肽(Aβ)沉积的关系;观察IR模型大鼠经罗格列酮治疗后,上述各指标的改变及与过氧化物酶体增殖物激活受体-γ(PPARγ)的相关性。方法高糖、高脂、高蛋白饮食3个月造IR大鼠模型(IR),给予罗格列酮灌胃4周为治疗组(TZD);葡萄糖氧化酶法检测大鼠血糖水平,放免法检测血浆胰岛素水平,HOMA-IR评估胰岛素抵抗水平,蛋白印迹技术检测大鼠海马内Aβ、Wnt3a、β-catenin及PPARγ的水平。结果IR组血浆胰岛素水平及胰岛素抵抗程度显著高于对照组。免疫印迹结果显示,IR组大鼠海马中Aβ及β-catenin表达增加,Wnt3a及PPARγ表达明显减少;经TZD干预后,大鼠海马中Aβ表达减少,Wnt3a、β-catenin及PPARγ表达增加。结论胰岛素抵抗大鼠海马内Wnt信号通路水平下降可能是导致Aβ沉积的原因。罗格列酮作为PPARγ激动剂,可通过上调Wnt通路活性从而减少IR大鼠海马内Aβ的沉积。
胰岛素抵抗; 淀粉样β肽; Wnt信号通路; 罗格列酮;过氧化物酶体增殖物激活受体γ
胰岛素抵抗(insulin resistance,IR)及高胰岛素血症在肥胖人群中常见,流行病学研究显示IR是阿尔茨海默病(Alzheimer’s disease,AD)强烈的预测因子之一[1]。AD是一种与年龄相关的严重中枢神经系统退行性疾病,严重损害患者的认知功能,造成患者自理能力障碍及精神行为的异常。AD患者最典型的病理改变是:脑细胞外β淀粉样肽(β-amyloid,Aβ)沉积导致的老年斑及脑神经细胞轴突内tau蛋白过度磷酸化所导致的神经纤维缠结[2],并且认为Aβ沉积是AD的始发病理生理学改变[3]。研究证实,脑内胰岛素信号受损可促使Aβ沉积[4],并且IR及Aβ沉积均可导致Wnt信号通路(the wingless pathway in Drosophila)下调[5,6]。
Wnt信号通路是Wnt配体介导的经典信号通路,Wnt配体(如Wnt3a,是一类分泌型糖蛋白,通过自分泌或旁分泌发挥作用)与其膜受体Frizzled结合介导了跨膜信号转导,激活胞质内的蓬乱蛋白(dishevelled protein,Dsh),使得糖原合成激酶-3β( glycogen synthase kinase 3β,GSK-3β)结合到由轴蛋白(Axin)、大肠腺瘤性息肉蛋白(APC)及β-catenin组成的复合体上从而失去其活性,最后导致细胞内β-catenin的水平增加,其进入细胞核内与转录因子TCF/LEF结合最终使得Wnt目的基因表达增加。
噻唑烷二酮类药物(TZD)是迄今为止被认为是最强的过氧化物酶体增殖物激活受体-γ(peroxisome proliferator-activated receptor γ,PPARγ)激动剂,而PPARγ不仅是Wnt/β-catenin的目的基因之一,并且PPARγ与激动剂结合后还能上调β-catenin基因转录。因此本研究首先观察IR大鼠Aβ水平及通过检测β-catenin和Wnt3a水平来评估Wnt途径活性的改变,然后给予TZD干预改善IR后,通过检测两者的变化,探讨罗格列酮是否通过Wnt途径改善Aβ沉积,从而降低AD在IR中发病风险。
材 料 和 方 法
1材料
1.1实验对象 雄性SD大鼠( 华中科技大学同济医学院动物中心提供),体重180-220 g ,10-12周龄.随机将大鼠分为3组:对照组予正常饮食饲养;肥胖胰岛素抵抗模型组(IR) 予高脂高糖高蛋白饮食饲养;罗格列酮治疗组(TZD)予高糖高脂高蛋白饲养3月,以罗格列酮片3.0 mg·kg-1·d-1灌胃4周(罗格列酮片由格兰素史克公司提供),对照组IR组均以等剂量生理盐水灌胃。灌胃4周后断颈处死所有大鼠,取海马。
1.2主要试剂 见表1。
2观察指标及方法
2.1血糖测定(plasma glucose) 处死前由大鼠尾静脉采血,用血糖仪(强生稳豪)检测血糖水平。
2.2血浆胰岛素测定(plasma insulin) 于大鼠被处死前心脏取血1 mL,离心后取血浆,-20 ℃保存,放免法检测。药盒购自北京原子能研究所, 测定值批内CV<2.5%,批间CV<3.5%。
2.3胰岛素抵抗指标 以稳态模型的胰岛素抵抗指数HOMA -IR =空腹胰岛素(U/L)×空腹葡萄糖(mmol/L)÷22.5表示。
2.4免疫印迹技术检测大鼠海马中Aβ、Wnt3a、β-catenin及PPAR-γ水平 断颈处死动物取海马放入匀浆器内,加入蛋白质提取液,冰上匀浆(总蛋白质提取液购自武汉凌飞科技公司)。于4 ℃ 12 000×g离心10 min ,取上清即为蛋白质。取10 μL用Bradford法检测蛋白质浓度,余储存于-80 ℃备用。用前加 2×样本缓冲液并混匀,于100 ℃变性5 min。在具10道双垂直电泳槽孔内加入约 12 μg蛋白质,10%SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE),结束后全湿转至NC膜。摇床上5%BSA封闭2 h,杂交I抗( 所有抗体如表 2所示) 4 ℃过夜,PBST洗膜3次,每次10 min,杂交Ⅱ抗(辣根酶标记的羊抗兔、羊抗鼠及兔抗羊IgG购自Santa Cruz),室温摇床上1 h,PBST洗膜3次,每次10 min。ECL试剂盒显色(ECL试剂盒购于武汉凌飞科技公司)。运用BandScan 5.0软件对免疫反应条带进行定量分析。
3统计学处理
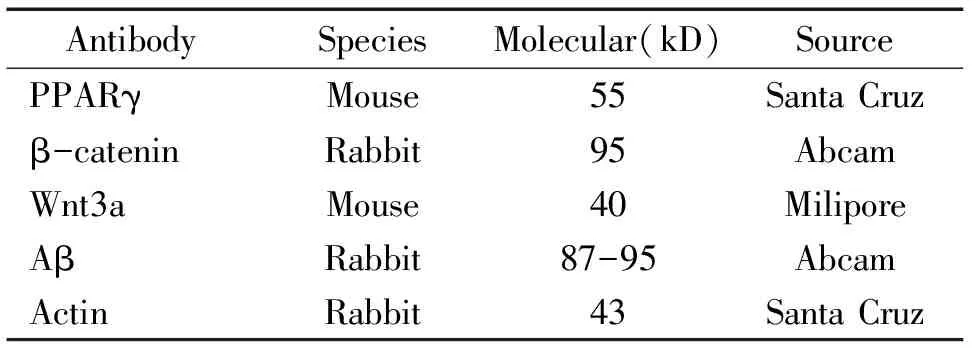
表1 实验所用抗体
结 果
1血浆胰岛素及胰岛素抵抗程度比较
IR组大鼠胰岛素水平显著高于对照组,根据HOMA公式计算出的胰岛素抵抗指数显示IR组HOMA-IR显著高于对照组,说明造模成功,见表2。
表2 动物分组及一般资料
2免疫印迹技术检测大鼠海马内Aβ、Wnt3a、β-catenin及PPARγ的表达
免疫印迹结果显示,与对照组大鼠相比IR组大鼠海马中Aβ及β-catenin表达增加,Wnt3a及PPARγ表达明显减少;与IR组大鼠相比,TZD组大鼠海马中Aβ表达减少,Wnt3a、β-catenin及PPARγ表达增加,见图1。
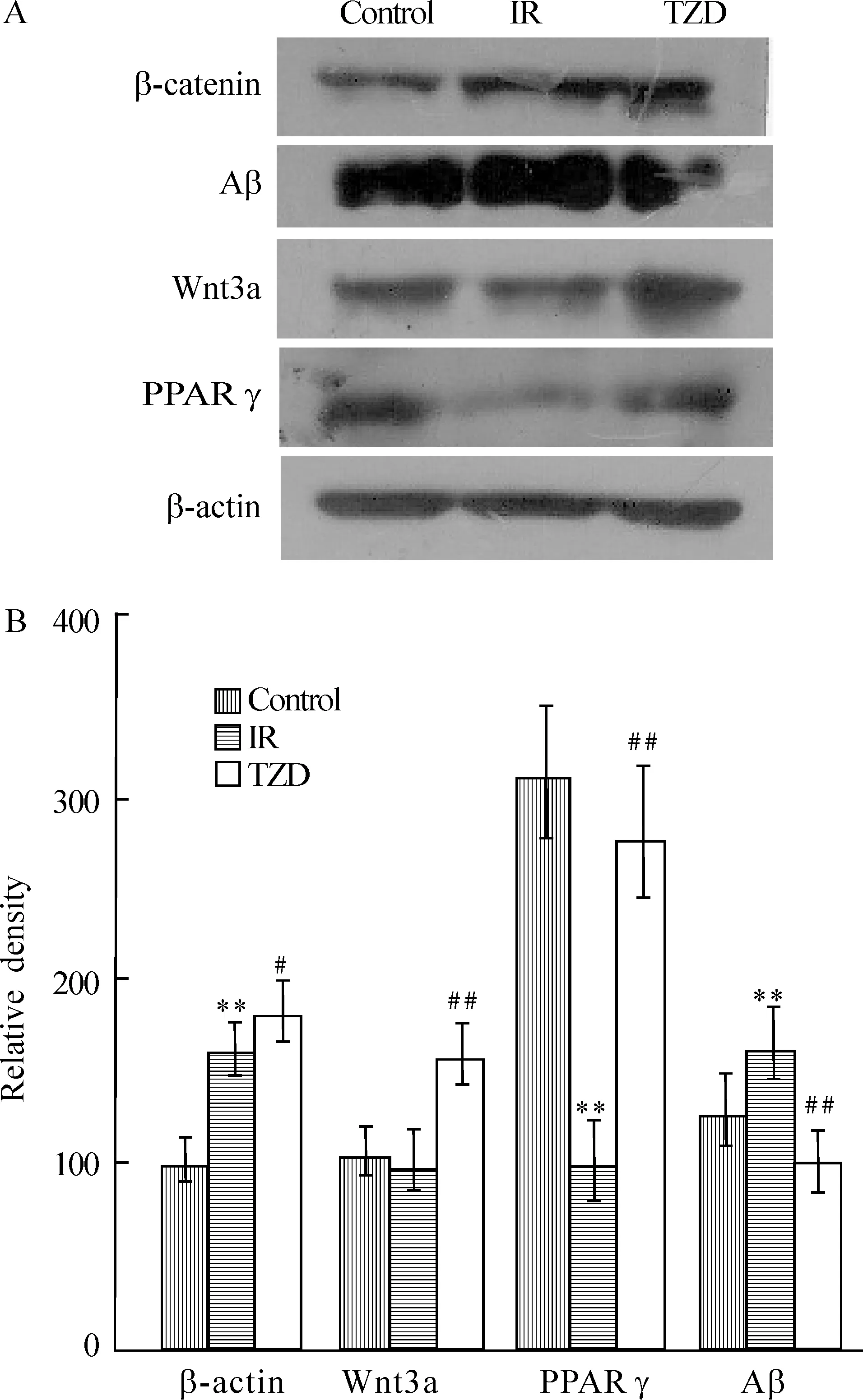
Figure 1. Western blotting analysis of Wnt3a,β-catenin and PPAR-γ in rat hippocampi. A: Crude hippocampal extracts(7-13 μg/lane) were analyzed by Western blotting developed with antibodies to Wnt3a, β-catenin and PPARγ. β-actin served as a loading control. Each lane was from an individual rat. B: the blots as shown in panel A were quantitated densitometrically. ±s. n=5. *P<0.05,**P<0.01 vs control group; #P<0.05,##P<0.01 vs IR group.
讨 论
IR程度是AD发病的强烈预测因子之一,脑内胰岛素信号受损可促使Aβ沉积[4],并且胰岛素抵抗程度及Aβ沉积的增加均可导致Wnt信号通路下调[5,6]。TZD药物是迄今为止被认为最强的PPARγ受体激动剂,临床上多用于减轻IR。研究证实,PPARγ不仅是Wnt/β-catenin的目的基因之一,与激动剂结合后还能上调其下游β-catenin的基因转录,本研究运用TZD类药物罗格列酮改善胰岛素抵抗状态,通过检测Wnt信号途径中β-catenin及Wnt3a水平观察Wnt途径活性改变,然后检测大鼠大脑Aβ沉积状态,探讨TZD通过Wnt途径改善胰岛素抵抗大鼠大脑Aβ沉积状态的可能机制。
本研究中,我们首先检测具有胰岛素抵抗特征的大鼠大脑Aβ沉积状态,结果显示,IR组大鼠比对照组大鼠大脑内Aβ表达增多。检测Wnt通路中重要组成成分,结果显示,与对照组比较,IR组β-catenin水平增高,Wnt3a表达减少。在胰岛素抵抗时Wnt/β-catenin信号通路应该是被抑制,因此理论上β-catenin应该是表达减少的。分析在本实验中其β-catenin表达增多是因为在OB组中,IR导致Aβ增多,而Aβ增多可反馈性地增加β-catenin表达。这又是因为增加的β-catenin可直接减少Aβ的生成[7]。另外,β-catenin表达增加的同时Wnt3a表达反而是下降的,这说明此时β-catenin表达增加,可能并不是通过Wnt3a配体激活Wnt/β-catenin经典通路来实现的。因为Wnt经典通路中Wnt3a及β-catenin的变化应该是一致的:Wnt3a为Wnt经典通路中的配体而β-catenin为配体下游的蛋白。然而,β-catenin的表达还受许多其它因素的影响,如非经典Wnt通路及与GSK-3β有关的信号通路影响。另一研究也支持此推论:当Aβ表达增多时它可与Wnt膜受体Frizzled的半胱氨酸域结合从而抑制Wnt/β-catenin经典作用通路[8]。IR导致Aβ沉积的机制主要有2种学说。(1)受损的胰岛素信号通路对胰岛素信号转导系统中的关键酶GSK-3β及GSK-3α的抑制作用减弱[9]。激活的GSK-3α可以激活APPγ分泌酶从而增加Aβ的产生;而激活的GSK-3β可使得tau过度磷酸化从而导致神经纤维缠结[10],两者都可加快疾病的进程。(2)胰岛素抵抗导致Aβ沉积是通过影响其清除及生成过程实现的。Aβ被认为主要是通过血脑屏障或是小胶质细胞清除的,这个过程依赖低密度脂蛋白受体相关蛋白(LRP)及其配体ApoE和α2巨球蛋白[11]。而本次实验结果显示OB组比对照组海马中Wnt3a明显下降而Aβ沉积增加,因此我们推测IR导致Aβ沉积另一可能的机制是:IR时Wnt/β-catenin信号通路被抑制从而导致Aβ沉积。TZD治疗组大鼠较OB组Aβ表达减少、Wnt3a及β-catenin表达增多、 PPARγ表达增多。依此推测罗格列酮可改善IR并且上调Wnt,经典Wnt通路上调可使Aβ沉积减轻,同时罗格列酮的核受体PPARγ不仅是Wnt通路的目的基因之一[12],并且当罗格列酮作用与PPARγ结合后又可上调β-catenin基因的转录。PPARγ表达增多可增强罗格列酮的作用,并且上调β-catenin表达。
总之,AD作为IR患者的重要并发症之一越来越受到人们重视,找出两者间发病的关键及相关因素有望干预病情发展。Wnt/β-catenin通路在IR及AD发病中均起到重要作用,其可能为 IR患者患AD的病理生理学基础之一。
[1] Inestrosa NC, Toledo EM. The role of Wnt signaling in neuronal dysfunction in Alzheimer’s disease [J]. Mol Neurodegener, 2008, 3(1):9.
[2] Iqbal K, Grundke-Iqbal I. Discoveries of tau, abnormally hyperphosphorylated tau and others of neurofibrillary degeneration: a personal historical perspective[J]. J Alzheimers Dis, 2006, 9(3 Suppl):219-242.
[3] Stolk RP, Pols HA, Lamberts SW, et al. Diabetes mellitus, impaired glucose tolerance, and hyperinsulinemia in an elderly population. The Rotterdam Study[J]. Am J Epidemiol, 1997, 145(1):24-32.
[4] Hsiao K, Chapman P, Nilsen S, et al. Correlative memory deficits, Aβ elevation, and amyloid plaques in transgenic mice[J]. Science, 1996, 274(5284): 99-103.
[5] Heller RS, Klein T, Ling Z, et al. Expression of Wnt, frizzled, sFRP, and DKK genes in adult human pancreas[J]. Gene Expression, 2003, 11(3-4): 141-147.
[6] Cauchi S, El Achhab Y, Choquet H, et al. TCF7L2 is reproducibly associated with type 2 diabetes in various ethnic groups: a global meta-analysis[J]. Mol Med, 2007, 85(7): 777-782.
[7] Salins P, Shawesh S, He Y, et al. Lovastatin protects hu-
man neurons against Aβ-induced toxicity and causes activation of β-catenin-TCF/LEF signaling[J]. Neurosci Lett, 2007, 412(3):211-216.
[8] Chacón MA, Varela-Nallar L, Inestrosa NC, et al. Frizzled-1 is involved in the neuroprotective effect of Wnt3a against Abeta oligomers[J]. Cell Physiol, 2008, 217(1): 215-227.
[9] Sutherland C, Leighton IA, Cohen P. Inactivation of glycogen synthase kinase-3β by phosphorylation: new kinase connections in insulin and growth-factor signaling[J]. Biochem J,1993, 296(Pt 1):15-19.
[10]Grimes CA, Jope RS. The multifaceted roles of glycogen synthase kinase 3 β in cellular signaling [J]. Prog Neurobiol, 2001, 65(4):391-426.
[11]Harris-White ME, Frautschy SA. Low density lipoprotein receptor-related proteins(LRPs), Alzheimer’s and cognition[J]. Curr Drug Targets CNS Neurol Disord, 2005, 4(5): 469-480.
[12]Heneka MT, Landreth GE. PPARs in the brain[J]. Biochim Biophys Acta, 2007, 1771(8):1031-1045.
RoleofWntpathwayinAβdepositioninhippocampusofinsulinresistantratsbeforeandaftertreatedwithrosiglitazone
YANG Si-si, ZHANG Xiao-jie, ZHANG Mu-xun
(DepartmentofEndocrinology,TongjiHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430030,China.E-mail:zmx1220@sina.com)
AIM: To investigate the relationship between classical Wnt pathway with β-amyloid peptide(Aβ) deposition in hippocampus of insulin resistance(IR) rat model and to observe the above-mentioned proteins and the correlation with peroxisome proliferator-activated receptor γ(PPARγ) by treating the IR rats with rosiglitazone.METHODSThe rat models of IR and TZD were made. The plasma insulin and the plasma glucose levels were tested by RIA and glucose-oxidase methods, respectively. The indexes of insulin resistance were calculated by HOMA-IR. The proteins of Aβ, Wnt3a, β-catenin and PPARγ were analyzed by Western blotting.RESULTSThe plasma insulin in IR group was significantly higher than that in control group. Insulin resistance, which was calculated by HOMA-IR, was significantly higher in IR group than that in control group. The levels of Aβ and β-catenin in IR group were higher than those in control group, while the levels of Wnt3a and PPARγ were decreased. After treatment with rosiglitazone, Aβ was reduced but Wnt3a, β-catenin and PPARγ were increased.CONCLUSIONIn hippocampus of IR rats, Aβ is deposited and the levels of Wnt3a and Wnt are reduced. Rosiglitazone, as a PPARγ agonist, can upregulate the activity of Wnt pathway and reduce Aβ deposition in rat hippocampus.
Insulin resistance; β-amyloid; Wnt signaling pathway; Rosiglitazone; Peroxisomal proliferator-activated receptor γ
R363
A
10.3969/j.issn.1000-4718.2011.02-031
1000-4718(2011)02-0375-04
2010-06-28
2010-10-12
△通讯作者 Tel:027-83663615; E-mail: zmx1220@sina.com

