肌注PHA对猪血清中补体C3、C4的影响
肌注PHA对猪血清中补体C3、C4的影响
肖啸①* 何克灿②沈学文②张荣华②杨东②(①云南农业大学动物科学技术学院 昆明 650201 ②云南省红河州动物疫病预防控制中心 蒙自)
本试验对各猪只肌注PHA,通过测定不同时期血清中补体C3、C4的浓度,来判定PHA是否对补体有影响作用,并测定有显著影响的PHA剂量。试验中,把PHA分成5个剂量组:低剂量组(0.4mg/kg)、中剂量组(0.8mg/kg)、高剂量组(1.2mg/kg)、超高剂量组(1.6 mg/kg)、对照组(0.8mg/kg生理盐水)进行肌肉注射。各试验猪均按正常管理、饲喂,并在注射后的第1、7、14d对各组猪只采血,测定其血清中补体的含量。结果显示,不同剂量的PHA对猪只的补体系统刺激作用不同,其中中剂量组可以提高机体的补体水平,并保持一定时间的高水平,低剂量组的猪只补体水平稍有升高,而高剂量组和超高剂量组则使机体的补体水平有所降低。
猪 植物凝集素 补体C3、C4
植物凝集素(PHA)主要用于激活免疫细胞—淋巴细胞,是一种干扰素诱导剂,不仅可以刺激机体产生白介素-2和干扰素;还可以刺激机体产生非特异性抗体,激活机体的补体系统[9]。PHA的药理作用[10-11]特别广泛,其作用机理是机体免疫系统通过识别植物血凝素而识别病毒,并产生相应的抗体和其它免疫反应,从而清除体内病毒。作用主要有:(1)PHA为广谱抗病毒药,可刺激T淋巴细胞增殖分化产生大量效应T细胞和细胞毒T细胞,效应T细胞分泌产生大量细胞因子(如干扰素等)杀伤病毒,细胞毒T细胞可直接杀伤病毒。(2)PHA可同时刺激B细胞转化为浆母细胞后增殖分化为浆细胞,浆细胞产生大量非特异性抗体来中和病毒。(3)PHA可增强机体免疫功能,提高骨髓造血机能,促进机体白细胞及多核白细胞数量明显增加;提高机体细胞诱生干扰素,增强机体免疫力,促进抗体形成,增强机体对病原微生物的吞噬作用。(4)PHA与黄芪多糖、左旋咪唑、阿糖腺苷配伍,有明显的增效作用;与部分抗生素等配伍具有相加作用。(5)PHA在肌肉注射后约5~15min血药浓度达高峰,口服约1h后血药浓度达高峰,代谢产物主要从尿液排出。
目前,国内还没有人做过肌注PHA对猪血清补体C3、C4的影响的研究。所以本试验通过给猪只肌肉注射不同剂量的PHA,测定不同时期其体内补体C3、C4的含量,并进行生物学统计学分析,从而判定给猪只肌注PHA来增强机体免疫力的最适剂量。
1 材料与方法
1.1 材料
1.1.1 试验动物 本次试验所选用30头猪都由泸西县蓝天种猪场提供。所选猪只均为65日龄,体重为17~25kg。试验前对猪进行预防接种疫苗,并确定所选猪均属健康。试验前、后均按正常方式饲养,环境、饲料不变。
1.2.2 试验药物 植物凝集素(1mg/ml),由云南师范大学生命科学院提取。
1.2.3 试验器材及试剂 柠檬酸钠真空采血管,江西格兰斯医疗器械有限公司,生产批号081009;半自动生化分析仪,华仪器 L-3280,V1.06.0808,仪器序列号:SHB10604044;离心机,北京医用离心机厂生产型号LD4-2A。
1.2 方法
1.2.1 试验分组 选择的健康猪只30头,按年龄体重相近似原则对其分组,分成5个组,每组为6头并将其编号。对照组为01~06号肌注0.8mg/kg的生理盐水、低剂量组为07~12号肌注PHA的剂量为0.4mg/kg、中剂量组为13~18号肌注PHA的剂量为0.8mg/kg、高剂量组为19~24号肌注PHA的剂量为1.2mg/kg、超高剂量组为25~30号肌注PHA的剂量为1.6mg/kg。肌注部位为:猪耳后3~5cm处。各试验猪均按正常管理。间隔1周和2周对各组猪只采血分析。
1.2.2 血样的采集和处理 试验期为2周,在注射后的第1、7、14d分别采血取样。用注射器从各猪只的耳静脉抽取3ml全血,放入柠檬酸钠真空采血管中保存,于离心机中离心,以4000r/min离心30min,分离血清,取上层血清移入各试剂杯中。
1.2.3 检测指标 待测血清做生化指标检测。用半自动生化分析仪检测待测血清,主要检测补体C3、C4浓度。
1.2.4 检测方法 采用免疫比浊测定法。其基本原理是:抗原抗体在特殊缓冲液中快速形成抗原抗体复合物,使反应液出现浊度。当反应液中保持抗体过量时,形成的复合物随抗原量增加而增加,反应液的浊度亦随之增加,与一系列的标准品对照,即可计算出受检物的含量。
1.2.5 数据分析 采用SPSS数据分析软件。全部数据采用平均值对比(图表比较)和F检验与q检验(结果用均数±标准差)表示。标准差用α表示。
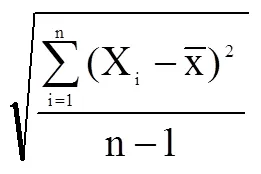
2 试验结果
测得每头猪的补体C3、C4水平的数据见表1。由表1资料总结出表2和表3并作出折线图1。从表3中明显可见中剂量组的PHA对猪只免疫增强有非常好的效果,补体C3、C4水平达到了高峰,第14天与第1、7天相比补体C3、C4有显著提高(P<0.05)。
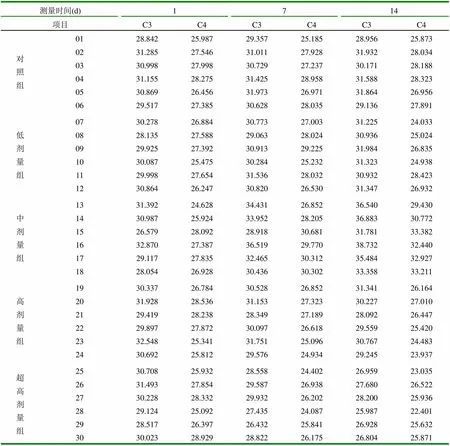
表1 不同时期补体C3、C4的含量 (mg/L)
从表1可见,每1头猪所在不同时期测出的补体C3、C4的量有所不同。
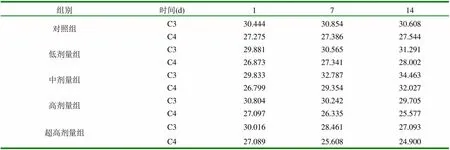
表2 不同时期补体C3、C4平均数比较 (mg/L)
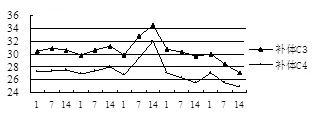
对照组 低剂量组 中剂量组 高剂量组 超高剂量组
由表1、2、3可知,与对照组相比,在给猪只注射了4个剂量组的PHA,在经过1周时间之后,每头猪的补体C3、C4都有了不同程度的提高或降低,主要原因是由不同剂量的PHA和猪个体差异所引起的。但是中剂量组呈明显提高的趋势,达到9.90%(C3)和9.53%(C4)的提高率,低剂量组为2.29%(C3)和2.38%(C4),高剂量组为-1.82%(C3)和-2.81%(C4),超高剂量组为-5.18%(C3)和-5.47%(C4)。然而在2周之后测量时,中剂量组仍保持在较高的水平,为原来的5.11%(C3)和9.11%(C4),低剂量组有所提高为1.74%(C3)和2.43%(C4),高剂量组和超高剂量组却低于原来的水平,分别为-1.78%(C3),-2.88%(C4)和-4.81(C3)和-2.76(C4)。另外,对照组补体C3、C4的含量也有一定的变化,但相对其它4个试验组,变化不明显。
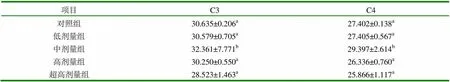
表3 补体C3、C4数目分析,结果用(均数±标准差) (mg/L)
注:表中列数字右肩字母不同者,表示差异显著(P<0.05)
由表3可知,对照组的C3、C4的差异不显著(P>0.05)。相对于其它剂量组,中剂量组的PHA差异显著(P<0.05),而低剂量组、高剂量组和超高剂量组的差异不显著(>0.05)。
3 讨论
3.1 PHA的生物学功效 植物凝集素是利用国际先进的超低温冷冻技术从红芸豆中提取的一种物质,由D-甘露糖、氨基酸葡萄糖酸衍生物所构成的低聚糖辅基与蛋白质复合物。植物凝集素对机体毒副作用小,具有刺激细胞增殖、活化,增强免疫低下患者的免疫功能,抑制肿瘤生长等生物学功效[1]。植物中,不仅种子中存在凝集素,根、茎、叶、皮、果实中也发现有凝集素。1888年俄国Dorpt大学的Stillmark首次发现了蓖麻凝集素。1936年Summer and Howell发现凝集素专一性结合糖的性质。1960年Nowell报道了植物细胞凝集素有促进有丝分裂的作用。1975年Becker等研究了刀豆凝集素分子的三级结构,揭开了研究植物凝集素分子空间结构和功能的序幕[2]。植物凝集素的定义也已几经修正,1995年Willy J.Peumans和Els J.M.Van Damme认为确定蛋白质为凝集素的唯一前提条件是至少应有一非结构域,且其能可逆地结合到特异碳水化合物上[3]。
PHA无种属特异性,具有协同作用或相加作用,具有明显提高原有产品疗效的作用,同时不干扰原产品的检测,使用方便,分布广泛,避免由于加强免疫引起的抗体水平过高及疫苗应激反应。在抗病毒方面具有广谱、毒性小、安全范围大等特点。在免疫学领域,植物凝集素是免疫学研究中极其重要的试剂,有着巨大的应用前景。目前,国内外的好多专家学者都对植物凝集素的功能做了深入的研究,认为植物凝集素是自然界广泛存在的一类能凝集细胞、多糖或糖复合物的非源于免疫反应的糖蛋白,是一种有丝分裂原,主要用于激活免疫细胞即淋巴细胞。他们发现PHA聚酯有至少125种不同的单体结构,并且新的单体被不断地发现出来。由微生物合成的PHA有一些特殊的性能,包括生物可降解性、生物相容性、压电性和光学活性等。另外,根据单体结构或含量的不同,PHA的性能可从坚硬到柔软到弹性变化[4]。
3.2 补体系统的生物学意义 补体(complement,C)是存在于人和动物新鲜血清中具有酶活性的免疫球蛋白,约占血清球蛋白总量的10%。动物血清中的补体系统既是天然免疫的重要组成部分,又在获得性免疫过程中发挥重要作用。19世纪末,在研究免疫溶菌和免疫溶血反应中,认为这种球蛋白是对抗体的溶细胞有辅助作用的物质,因而得名补体。补体由9种成分组成,分别命名为C1、C2、C3、…、C9。其中C1又3个亚单位即C1q、C1r和C1s亚单位组成,统称为补体系统。当存在抗原抗体复合物或其它激活因子时,补体可以被激活。补体活化后在靶细胞膜上形成膜攻击复合物,导致靶细胞的溶解,这一功能在动物的免疫系统中起重要的防御和免疫监视作用,在抗体产生前可抵抗病原微生物的感染,在抗体产生后,起主要的杀灭微生物的作用[5]。补体在体内作用很广泛,补体结合反应的膜攻击作用可使某些细菌溶解破坏,丧失致病力。补体反应序列中所产生的各种中间产物有促进炎症反应、增强吞噬功能,中和病毒和免疫吸附的作用。另外,补体还与血液凝固及蛋白质溶解系统有关[6]。补体极不稳定,大部分对热敏感,56℃30min即失去活性。在哺乳动物体内,细菌性疫苗产生抗体后,当同类病原体再次侵入动物机体时,不仅动物体内的抗体能够及时地对病原体进行黏附,病原体本身和抗原抗体复合物同时激活补体,对侵入机体的细菌进行杀灭清除,哺乳动物体内补体的活性和数量较高,能够较大强度地杀灭细菌予以清除,保护动物健康[7]。
补体系统参与机体的特异性和非特异性免疫机制,表现为抗微生物防御反应,免疫调节及介导免疫病理的损伤性反应,是机体内一个具有重要生物学意义的效应系统和效应放大系统,而补体C3是补体系统中含量最高的成分。补体系统中补体C3、C4为补体系统中固有的成分,存在于体液中,补体C3 是补体激活过程中起关键性作用的一种成分,不论是经典激活途径还是替代激活途径,均需在C3 被激活之后,才能推进后续补体成分的连锁反应。补体C4 则在经典途径的活化阶段起着重要作用[8]。补体C3、C4是体内一组具有酶原活性的球蛋白,它们在机体防御过程中可通过免疫复合作用、调理吞噬细胞等机制对病原微生物进行清除及活化炎性细胞对靶细胞的杀伤作用。
3.3 PHA可提高机体免疫力 由表2和表3可知,该试验结果与河南农大的郭爽等人[12]利用植物凝集素在小白鼠上所做的结果有相似之处。在本试验中给猪肌肉注射不同计量的PHA后,其不同程度的刺激猪机体免疫,使机体补体C3、C4的含量都有不同程度的变化。其中,与对照组相比,在给猪只注射了4个剂量组的PHA,在经过1周时间之后,补体C3、C4都有了不同程度的提高或降低,其中中剂量组提高的最高,低剂量组稍有提高,高剂量组和超高剂量组却有所降低。在2周之后测量时,中剂量组仍保持在较高的水平,低剂量组也保持在相对稳定的状态,高剂量组和超高剂量组还是低于原来的水平。试验结果说明,给猪只注射不同剂量的PHA之后,在一定时期内能够提高机体的免疫力,从而保护动物的健康,但不同剂量PHA在对机体作用时有不同的效果,并且在注射后的不同时间,效果也不相同。
PHA可以用于激活免疫细胞,刺激机体产生白介素-2和干扰素,还可以刺激机体产生非特异性抗体,激活机体的补体系统。补体是人或动物体液中正常存在的一组与免疫有关的、具有酶原活性的球蛋白。补体系统广泛参与机体抗微生物防御反应以及免疫调节,也可介导免疫病理的损伤性反应,是机体内具有重要生物学意义的效应系统和效应放大系统。而C3、C4为补体系统中固有的成分,存在于体液中。补体系统被活化后,具有溶菌、溶细胞现象,并可促进吞噬细胞的吞噬作用,还可使肥大细胞脱颗粒、释放组织胺等。导致血管通透性增高、产生炎症反应。有利于将杀菌因素和吞噬细胞集中到炎症部位,将免疫复合物清除。
3.4 不同剂量的PHA免疫效果不同 给猪只注射不同剂量的PHA,在不同时期内,机体的补体水平不相同,中剂量组使机体的C3、C4水平提高较高,并在2周后仍保持在相当高的水平。低剂量组的PHA对补体C3、C4水平稍有升高,可能是由于PHA含量较少,虽有对机体刺激使补体C3、C4水平有所提高,但效果不是最明显的。高剂量组中补体C3、C4下降并低于原来的水平,可能是产生了免疫抑制现象,即抑制非特异性免疫,使体液中补体减少,降低机体抵抗力;抑制特异性免疫,造成淋巴器官萎缩、周围淋巴细胞减少及功能抑制、抗体形成抑制;抑制免疫监视功能。超高剂量组中的补体C3、C4水平也下降了,这也可能是PHA的过量注射而产生了免疫抑制。其中,上述各组均有个别猪只的补体C3、C4在注射PHA后高于或低于原来的水平,这可能是因为试验动物不是标准的实验动物、猪只个体水平的差异、饲养环境、饲料等因素所导致的。另外,对照组补体C3、C4的含量也有一定的波动,也可能与试验猪个体特质有关系,由于受外界条件因素的影响,其体内的补体含量本来就不稳定,但相对于试验组,其变化很明显。
4 结论
通过该试验,说明对猪使用PHA可以激活机体的补体系统,尤其是刺激机体产生补体C3、C4;5个组补体C3、C4的量不同,说明不同剂量的PHA对猪只的补体系统刺激作用强度不同,其中中剂量组(0.8mg/kg)的PHA可以极大地提高机体的补体水平,并保持一定时间的高水平,低剂量组也有升高,而高剂量组和超高剂量组使机体的补体水平有所下降。在应用PHA时,应注意PHA的质量,谨慎使用,并严格注意其用量,以免发生抑制免疫起不到理想的免疫效果。
[1] 莫菲,许巧丽,张军忍,江善祥.植物血凝素对鸡免疫功能的影响[J].甘肃农业大学学报,2009,44(1): 36-40.
[2] 孙册,朱政,莫汉庆.凝集素[M] .北京:科学出版社,1986: 15-22.
[3] 王志斌,李学勇,郭三堆.植物凝集素与抗虫基因工程[J] .生物技术通报,1998, (2) : 5-10.
[4] 于敏,王志德,董志芳.植物凝集素(PHA)的提取及血凝效果研究[J] .安徽技术师范学院学报,2002,16(1) :23-26.
[5] 马雪云.不同动物血清补体活性的研究[J] .中国医药导报,2006,5 (7) : 23.
[6] 王金宝,李庆怀.不同途径接种卡介苗对仔猪血清补体溶血单位的影响[J] .中国兽医科技,1996,26(1): 32-34.
[7]马雪云,牛钟相.不同动物血清补体对大肠杆菌的杀灭效果[J] .山东科学,2006,19(6): 102-104.
[8] 赵桂英,常华,等.不同剂量的双歧杆菌对断奶仔猪补体C3 、C4 的影响[J] .家畜生态学报,2007,28(2): 41-44.
[9] 张世峰.植物血凝素[J] .兽药市场指南,2006, (10) : 14-14.
[10] 张玮玮.补体C3的临床应用[J] .药物与临床,2007,120: 129-130.
[11] 娄在祥,王洪新,等.豆类植物凝集素抗营养机理研究[J] .粮食与油脂,2008,1: 16-18.
[12] 郭爽,索江华,苏丽娟.植物血凝素对小白鼠免疫功能的影响[J] .安徽农业科学,2007,35(34) : 11117-11118.
云南省高端科技人才引进计划项目子项目。项目编号:2009C1125-6。
S852.5+1
A
1007-1733(2011)01-0001-04
(2010–10–31)

