多孔双相钙磷钛合金微弧氧化膜层的制备及生物相容性
王凤彪,狄士春
(1.哈尔滨工业大学机电工程学院,黑龙江 哈尔滨 150001;2.大连交通大学信息工程学院,辽宁 大连 116023)
【化学转化膜】
多孔双相钙磷钛合金微弧氧化膜层的制备及生物相容性
王凤彪1,2,*,狄士春1
(1.哈尔滨工业大学机电工程学院,黑龙江 哈尔滨 150001;2.大连交通大学信息工程学院,辽宁 大连 116023)
为克服钛合金生物膜层单一相的缺陷,以Ti6Al4V合金为基体,用微弧氧化法制得具有双相钙磷复合陶瓷膜层(BCP)的钛合金器件。通过控制工作液成分制得由不同比例的β-磷酸三钙(β-TCP)和羟基磷灰石(HA)组成的多孔性复合膜层。研究了电源占空比对BCP膜孔隙率和孔径大小的影响。采用能谱仪和X射线衍射仪分析了BCP膜层的组成与构相。通过模拟体液浸泡(SBF)和生物体植入试验,研究了BCP膜的生物相容性。结果表明,提高BCP膜层中的HA含量,有利于类骨物质的生成;而提高β-TCP含量,能使膜层中类骨物质的形成速率加快。当n(HA)/n(β-TCP)= 6∶4时,BCP膜的生物相容性最佳。
钛合金;微弧氧化;β–磷酸三钙;羟基磷灰石;复合膜层;生物相容性
1 前言
双相钙磷生物陶瓷(BCP)是由羟基磷灰石(HA)和β-磷酸三钙(β-TCP)按不同比例组成的人骨组织修复材料,通过控制不同的HA和β-TCP比例来控制其降解速率。BCP具有良好的生物活性和生物相容性,但BCP材料由于其自身强度低、韧性及力学性能差等缺陷[1],其应用受到限制,难以满足医学要求。钛及其合金的抗蚀性、生物相容性、骨骼融合性、力学性能、可加工性等都符合医用器件基体材料的要求,并可弥补双相钙磷生物陶瓷的缺陷,但钛合金本身并不具有引导成骨的特性[2]。因此,在钛及钛合金表面生成羟基磷灰石,使之既有优异的力学性能又有良好的成骨特性,成为生物材料研究者关注的热点。
微弧氧化(Microarc Oxidation,简称MAO)技术能在金属表面形成一层多孔的耐磨、耐蚀并与基质牢固结合的陶瓷层,适用于生物医用钛合金的表面改性[3-5]。本文通过微弧氧化工艺在钛合金表面制备以 β-磷酸三钙和羟基磷灰石为多孔生物陶瓷膜层的医用器件,探讨了其体外浸泡和体内植入的生物特性。
2 实验
2. 1 试验材料
以Ti6Al4V为基体材料,其组成及含量(以质量分数表示)为:Al 5.50% ~ 6.75%,V 3.5% ~ 4.5%,O 0.2% ~ 0.3%,Fe ≤0.5%,其他<0.3%,Ti为余量。先将基体切割成20 mm × 20 mm × 3.5 mm的薄片,再用1000#砂纸打磨以除去表面氧化层,随后分别用丙酮和去离子水超声波清洗20 min。
2. 2 试验装置
采用自制的直流/交流微弧氧化装置,该设备由脉冲电源、电解槽、搅拌系统和冷却系统组成。基体用专用夹具夹持并与电源正极相连(即作为阳极),不锈钢电解槽作为阴极。微弧氧化过程中电压恒定为510 V,频率500 Hz,脉宽300 μs,占空比15%,电流根据加工过程自动调节。
2. 3 电解液液组成
HA微弧氧化液:Ca(NO3)20.25 mol/L,NH4H2PO40.006 mol/L,(NH4)2HPO40.006 mol/L,用氨水调节至pH为12。
β-TCP微弧氧化液:Ca(NO3)20.03 mol/L,(NH4)2HPO40.02 mol/L,用氨水调节至pH为12。
制备试样时,保持工作液在40 °C以下,先进行β-TCP微弧氧化,再进行HA微弧氧化,各10 min。通过控制 2种微弧氧化液中的电解质浓度得到不同的电解液,以制备n(HA)/n(β-TCP)值不同的BCP膜,具体如表1所示。
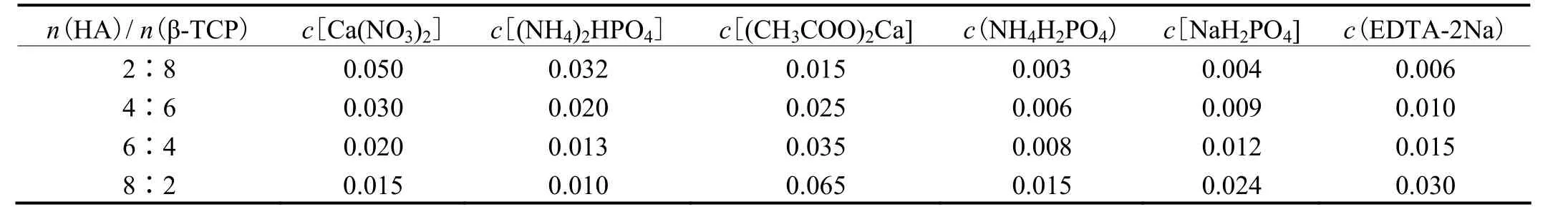
表1 电解质配比Table 1 Compositions of electrolytes (mol/L)
2. 4 模拟体液浸泡试验
生物活性模拟体液(SBF)的主要成分与人体血浆无机成分基本相同,具体为:NaCl 7.994 g/L,NaHCO30.352 g/L,CaCl20.278 g/L,MgCl2·6H2O 0.306 g/L,KCl 0.228 g/L,K2HPO4·3H2O 0.228 g/L,Na2SO40.07 g/L。将试样置于模拟体液中,在(37 ± 0.5) °C下连续浸泡4周。
2. 5 生物体内植入试验
试样处理:将只含HA及n(HA)/n(β-TCP)分别为6∶4和8∶2的试样置于生理盐水中超声清洗20 min,蒸馏水冲洗3遍后烘干。植入前将试样于121 °C下灭菌1 h,并编号N1、N2、N3。
植入试验:选用新西兰雄兔 3只,编号为 M1、M2、M3,体重约2 kg,消毒后麻醉,在其腿部肌肉处切口,分别植入N1、N2、N3试样。术后缝合,再饲养,试样N1、N2于3周后取出,N3于4周后取出。
2. 6 性能测定
利用JSM-5900LV型扫描电镜(SEM,日本JEOL)观察膜层形貌、结构特征;AXIS-ULTRADLD型电子能谱仪(EDS,英国 KRATOS)分析膜层元素组成;D/max-2550型X射线衍射仪(XRD,日本Rigaku)分析氧化层的构相;按ISO 1014:1985中规定的方法测定并计算孔隙率。用SSA-4300型比表面及孔径测定仪(北京彼奥德电子技术有限公司)测量试样的平均孔径。
3 结果与讨论
3. 1 微弧氧化膜层特性
图1为当n(HA)/n(β-TCP)= 4∶6时,电源占空比对膜层平均孔径及孔隙率影响。
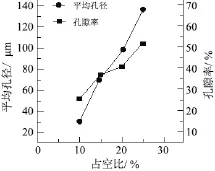
图1 占空比微弧氧化膜层平均孔径及孔隙率的影响Figure 1 Effect of duty cycle on aperture and porosity of MAO coating
从图 1可知,随占空比的增大,膜层孔径及孔隙率均增大。这主要是因为占空比增大时,脉冲放电强度增大,使反应更剧烈,氧化膜被熔化而向放电通道外喷出的量增多,从而使放电通道增大,放电通道冷却后即形成微孔。
微弧氧化膜层的孔径、孔隙率对其生物性能有显著影响:大于10 μm时,生物膜层能使细胞长入孔内;15 ~ 50 μm时,可形成纤维组织;50 ~ 100 μm时,可形成类骨组织;大于100 μm时,可形成矿化骨[6]。孔隙率越高说明材料比表面积越大,与生物体组织液和细胞的接触面积越大,降解越快,成骨组织越容易生长[7]。从图1可知,膜层的最小孔径大于10 μm。当占空比为15%时,膜层的孔径、孔隙率分别为61 μm和39%,满足生物体外浸泡和体内植入研究的要求。故本文采用15%的占空比。
3. 2 SBF浸泡前后氧化膜的结构及相分析
图2为不同组成的膜层SBF浸泡前后的SEM图。

图2 不同相组成的多孔陶瓷膜在SBF中浸泡后的SEM图Figure 2 SEM images for porous ceramic coatings with different phase compositions after soaking in SBF
从图 2可知,膜层表面有大、小孔,n(HA)/ n(β-TCP)= 2∶8时,多孔膜SBF浸泡1周后,孔壁上开始出现细小的颗粒状晶体,且分布很广。而n(HA)/ n(β-TCP)= 4∶6的膜层浸泡2周后,晶体数增多,部分区域的晶体已长成较大的棒状晶体,且小孔壁上也有较小的颗粒状晶体出现。n(HA)/n(β-TCP)= 6∶4的多孔膜浸泡3周左右时,大孔壁上开始有颗粒状晶体生成,且随着浸泡时间的延长,晶体逐渐长大,数量增多。而n(HA)/n(β-TCP)= 8∶2的多孔膜浸泡4周后,大孔壁上才开始出现细小的颗粒状晶体。因此,β-TCP含量越高,膜层与SBF发生作用生成新物质(图2g中的A物质)的速率就越快;浸泡时间越长,大孔壁上出现的晶体越多,且晶粒越大,覆盖膜层的面积越大。
综上所述,当n(HA)/n(β-TCP)= 6∶4时,膜层表面生长最佳。
为确定SBF浸泡实验中所生成的新物质,分析了n(HA)/n(β-TCP)= 6∶4试样的膜层成分(见图3)。结果表明,浸泡前后膜层中n(Ca)/n(P)值由1.582上升到1.637,而HA、β-TCP的n(Ca)/n(P)值分别为1.67、1.5。可见,试样浸泡4周后,有类似于HA的物质产生。该试样的表面构相见图 4。由图 4可知,浸泡后HA的特征峰强度明显高于浸泡前,可能是因为β-TCP降解速率比HA快,且又有新的类骨磷灰石(CHA)物质生成。类骨材料中钙、磷的溶解和沉积使新生的骨晶体直接沉积于类骨磷灰石表面,溶解的磷灰石能促进生物骨细胞分化、增殖[7]。钙磷陶瓷表面新物质的形成实际上是新相形成和晶体长大的过程,即晶核的形成和晶体长大 2个阶段,这都与材料附近的局域钙磷离子浓度相关,当钙、磷离子浓度达到其成核阈值时,晶体才能形成。BCP陶瓷浸泡于SBF溶液中,先产生表面溶解,使表面附近Ca2+、等离子浓度升高,再通过静电吸引,在其表面吸附、成核、长大,从而形成类骨磷灰石新相,即图2g中的A物质。

图3 n(HA)/n(β-TCP)= 6∶4的膜层在SBF浸泡前后的能谱图Figure 3 Energy-dispersive spectra of the coating with a molar ratio of HA to β-TCP 6:4 before and after soaking in SBF
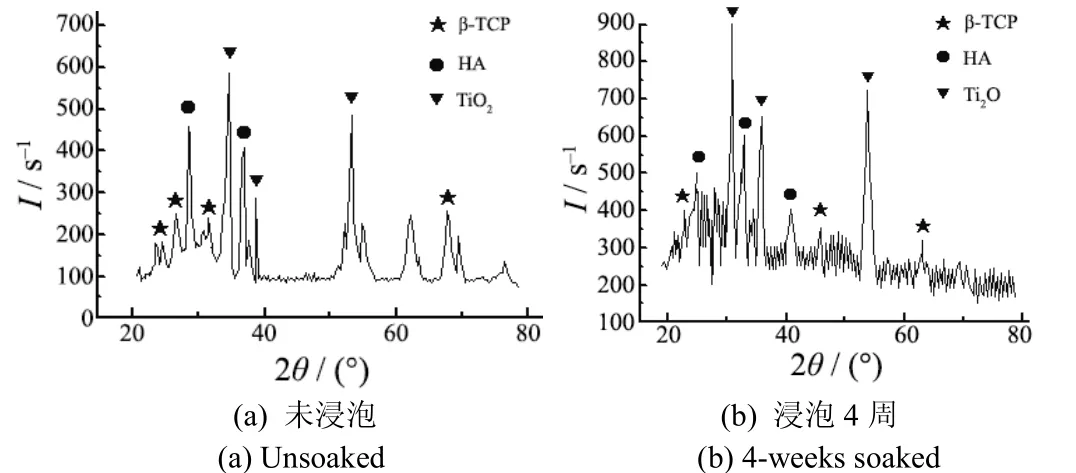
图4 n(HA)/n(β-TCP)= 6∶4的膜层在SBF浸泡前后XRD谱图Figure 4 XRD patterns of the coating with a molar ratio of HA to β-TCP 6:4 before and after soaking in SBF
3. 3 膜层材料生物体植入试验
进行膜层材料生物活性研究,除体外模拟体液浸泡试验,还需将试样植入生物体内骨区或非骨区,观察类骨材料表面成分的变化。图 5为试样植入新西兰雄兔体内后的组织生长情况。

图5 新西兰雄兔体内植入HA/β-TCP膜后的组织生长情况Figure 5 Tissue growth of New Zealand male rabbit after implantation with HA/β-TCP film
比较图5a和5b可发现,在相同的植入时间内,n(HA)/n(β-TCP)= 6∶4的试样在植入处的组织生长比纯 HA试样快,且生长效果好,几乎完全覆盖试样表面。对比图5b和5c可知,n(HA)/n(β-TCP)= 8∶2的试样植入时间虽已达4周,但由于β-TCP的含量少,膜层表面磷酸钙盐的降解速度慢,从而影响组织的生长速率。
4 结论
(1) 通过微弧氧化工艺,制备了含不同 HA与 β-TCP物质的量之比的多孔BCP生物成分的医用钛合金陶瓷膜层。
(2) 通过控制微弧氧化电源的占空比,可获得不同孔径和孔隙率的生物陶瓷膜层。提高占空比可使膜层的孔径和孔隙率增大,有利于提高其生物适应性。
(3) 提高BCP膜层中的HA含量,有利于类骨物质的形成;而提高β-TCP含量,能使膜层中类骨磷灰石的形成速率加快。n(HA)/n(β-TCP)= 6∶4时,组织生长速率最快,生长效果最佳。
[1] SUL Y T, JOHANSSON C B, JEONG Y, et al. Oxidized implants and their influence on the bone response [J]. Journal of Materials Science: Materials in Medicine, 2001, 12 (10/12): 1025-1031.
[2] 李夕金, 程国安, 薛文斌, 等. TiAl合金微弧氧化膜的制备及抗氧化性能研究[J]. 材料热处理学报, 2006, 27 (5): 95-99.
[3] SON W W, ZHU X L, SHIN H I, et al. In vivo histological response to anodized and anodized/hydrothermally treated titanium implants [J]. Journal of Biomedical Materials Research Part B: Applied Biomaterials, 2003, 66 (2): 520-525.
[4] LI L H, KONG Y M, KIM H W, et al. Improved biological performance of Ti implants due to surface modification by micro-arc oxidation [J]. Biomaterials, 2004, 25 (14): 2867-2875.
[5] ISHIZAWA H, OGINO M. Characterization of thin hydroxyapatite layers formed on anodic titanium oxide films containing Ca and P by hydrothermal treatment [J]. Journal of Biomedical Materials Research Part A, 1995, 29 (9): 1071-1079.
[6] NIE X, LEYLAND A, MATTHEWS A. Deposition of layered bioceramic hydroxyapatite/TiO2coatings on titanium alloys using a hybrid technique of micro-arc oxidation and electrophoresis [J]. Surface and Coatings Technology, 2000, 125 (1/3): 407-414.
[7] 阮建明, 邹俭鹏, 黄伯云. 生物材料学[M]. 北京: 科学出版社, 2004.
Preparation of porous biphasic calcium phosphate coating by microarc oxidation on titanium alloy surface and its biocompatibility //
WANG Feng-biao*, DI Shi-chun
A porous biphasic calcium phosphate (BCP) coating was prepared on the surface of Ti6Al4V alloy by microarc oxidation to overcome the defects of single-phase biofilm on titanium alloy. The porous composite coatings composed of different proportions of β-tricalcium phosphate (β-TCP) and hydroxyapatite (HA) were obtained by controlling the compositions of working electrolytes. The effect of duty cycle on the aperture and porosity of BCP coating was studied. The composition and structure of BCP was analyzed using energy spectrometer and X-ray diffractometer. The biocompatibility of BCP coating was studied by immersion in simulated body fluid (SBF) and implantation in organism. The results showed that the increase of HA content in BCP coating facilitates the formation of skeleton, while the increase of β-TCP speeds up the formation of bone materials. The biocompatibility of BCP coating is best when the molar ratio of HA to β-TCP is 6:4.
titanium alloy; microarc oxidation; beta-tricalcium phosphate; hydroxyapatite; composite coating; biocompatibility
School of Mechatronics Engineering, Harbin Institute of Technology, Harbin 150001, China
TG178; TG174.453
A
1004 – 227X (2011) 12 – 0037 – 04
2011–07–21
2011–08–15
王凤彪(1979–),男,辽宁沈阳人,讲师,在读博士研究生,主要研究方向为钛合金生物涂层。
作者联系方式:(E-mail) wfb_0_0@163.com。
[ 编辑:周新莉 ]

