弓形虫Prugniaud株感染小鼠后脑组织病理学动态观察*
吴升伟,包怀恩,葛 爽,李小燕
2.贵州省疾病预防控制中心,贵阳 550004
弓形虫病是由刚地弓形虫(Toxoplasma gondii)感染引起的严重危害健康的一种人兽共患性疾病,其病原体弓形虫是重要的专性细胞内寄生的机会性致病原虫,可以感染包括人在内的所有哺乳动物、鸟类和爬行动物,并在人和多种动物的有核细胞内发育和繁殖,从而引起宿主细胞和组织的炎症和坏死等非特异性病变。对人群中弓形虫感染的流行病学调查资料显示,全世界大约有25%~50%的人受到感染,我国的感染率为5%~10%[1]。弓形虫具有亲神经性的特点,脑组织是弓形虫最易侵犯的部位之一。有报道称90%以上的全身性弓形虫病患者死于弓形虫脑部感染及其诱发的弓形虫脑炎[2]。除此之外,近年发现弓形虫感染是艾滋病患者最常见的机会性感染之一,有10%~30%艾滋病患者可并发弓形虫脑炎,并且是其死亡的主要原因之一[3]。
弓形虫Prugniaud株是人体和动物感染的优势虫株之一[4],其毒力弱于RH强毒株,该虫有速殖子和缓殖子两种状态,前者有较强侵袭性,后者容易在宿主脑组织中形成包囊。为观察这株弓形虫在宿主弓形虫性脑病中的病理变化及机制,本实验以腹腔感染途径向ICR小鼠注入弓形虫Prugniaud株包囊,建立小鼠感染模型,应用常规组织病理学方法、免疫组织化学法及PCR检测弓形虫特异性基因的方法,观察小鼠脑组织病理变化与虫体的关系及弓形虫包囊在脑的形成和存在时间,以为弓形虫脑病组织病理学诊断提供依据,并为进一步研究脑组织中包囊活化的发生机理奠定基础。
1 材料与方法
1.1 实验动物 6~8周龄SPF级ICR雌性小鼠,体重20~25g,购自北京维通利华实验动物技术有限公司(小鼠许可证编号SCXK(京)2006-0009)。
1.2 虫株 弓形虫Prugniaud株由蚌埠医学院孙新教授和南京医科大学陈锡慰教授惠赠,本室在昆明小鼠体内传代保种。
1.3 主要试剂 兔抗弓形虫多克隆抗体购自美国ViroStat公司,兔抗体免疫组化试剂盒购自深圳欣博盛生物科技有限公司,DNA提取试剂盒及DNA marker购自宝生物工程(大连)有限公司,琼脂糖购自Electrop Grade西班牙公司,2×PCR Green mix购自北京鼎国生物技术有限公司。
1.4 引物的合成 根据GenBank上弓形虫RH株(序列号:AF179871.1)B1基因序列,利用DNAMAN软件进行引物设计,上游引物:5′-GGAACTGCATCCGTTCATGAG-3′,下游引物 :5′-TCT TTAAAGCGT TCGTGGTC-3′,扩增长度194bp,引物由上海生物工程有限公司合成。
1.5 实验动物感染 将感染Prugniaud株弓形虫的小鼠用颈椎脱臼法处死,无菌状态下取小鼠脑组织,放入加有 PBS的匀浆器内制备成脑组织匀浆液,取10μ L匀浆液平铺在玻片上,于显微镜下计数包囊,并于试管内用无菌PBS调整至10个/0.5mL包囊,准备作感染动物用。购买的健康ICR小鼠(雌性,20~25g)经本实验室适应性饲养后,予感染组小鼠腹腔注射脑组织匀浆液0.5mL/只鼠,对照组小鼠腹腔注射同等量的PBS,其中感染组小鼠接种40只,对照组小鼠22只,分别分笼饲养,每笼5~6只,正常取食及饮水。
1.6 感染小鼠发病情况及指标观察 感染后每天观察小鼠,记录发病情况。于腹腔接种后第 5d、10d、15d、20d、25d、30d、60d、90d、120d、150d 及180d用颈椎脱臼法随机处死3只感染组小鼠和2只对照组小鼠,取部分小鼠脑组织于10%中性甲醛溶液固定24h,按常规方法进行脱水、石蜡包埋,制作4μ mol/L切片,分别作HE染色和免疫组织化学检测;同时取部分组织用匀浆器研磨后DNA提取试剂盒抽提组织DNA,具体操作方法见说明书。
1.7 免疫组化检测 石蜡切片用二甲苯常规脱蜡及入水。染色前用PBS浸泡石蜡切片10 min,然后入3%H2O2-甲醇液中浸泡10 min,PBS洗后加一滴封闭液于组织切片上孵育10min,吸干液体后加适量兔抗弓形虫多克隆抗体(1∶200)湿盒内孵育30~60min,PBS洗后加一滴生物素化抗兔IgG孵育10min,PBS洗后加一滴链亲和素标记HRP孵育10min,PBS洗后DAB室温显色2~5min后自来水充分冲洗,苏木素复染,盐酸酒精分化后氨水泛蓝,最后乙醇脱水、二甲苯透明、中性树胶封片、镜检。阴性对照是用正常PBS代替弓形虫多克隆抗体,其余步骤同上。结果判定:阳性反应为在抗原定位处见到棕黄或棕褐色沉淀。
1.8 对不同感染时间小鼠脑组织用PCR扩增弓形虫B1基因特异性片段检测 反应体系为25μ L,其中 2×PCR Green mix 12.5μ L,无菌双蒸水 9.5μ L,上下游引物(10μ mol/L)各 1μ L,模板 1μ L,上述反应混合物先在94℃5 min预变性,然后进入循环,94℃30 s,58℃45 s,72℃1min,30个循环,72℃延伸7 min,4℃保存。PCR产物的鉴定:取10μ L扩增产物于2%琼脂糖凝胶电泳(含0.5 mmol/L溴乙锭)上,100 V,30 min,紫外检测仪器下观察,200 bp附近出现条带判定阳性。
2 结 果
2.1 感染小鼠发病情况及症状 感染弓形虫包囊后第6d小鼠开始出现食欲减退、耸毛、怠惰、抖动、体重减轻、腹胀、腹泻及死亡等,同时15%小鼠出现死亡,剖检死亡小鼠发现腹水和肝脾明显肿大,腹水检测发现弓形虫速殖子(图1)。从第20d开始,小鼠逐渐进入恢复期,饮食、饮水开始恢复,活动开始增加,至第30d,小鼠表现为活动增加、皮毛光滑、食欲好转,体重开始增加。对照组小鼠无异常。
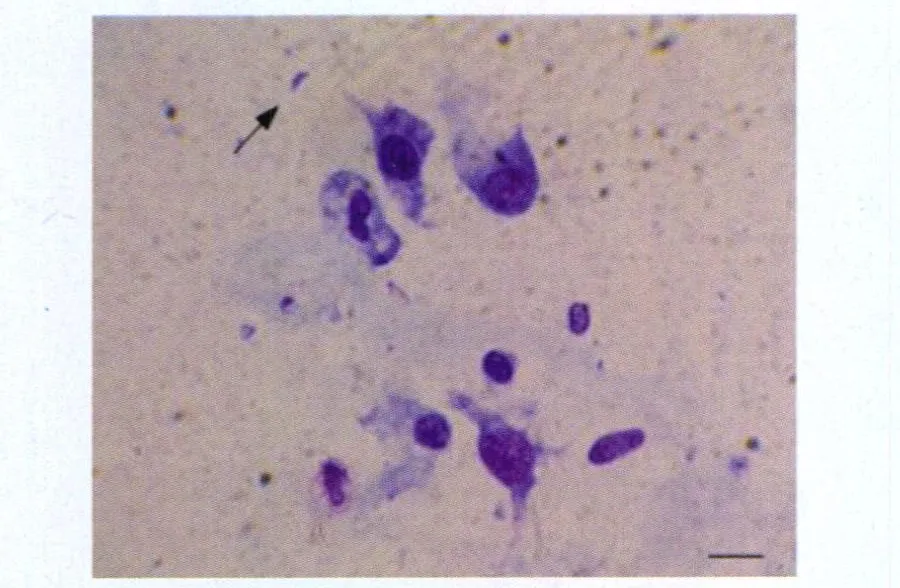
图1 箭头所示为弓形虫感染小鼠腹水中速殖子,周围可见假包囊,右下角为标尺,代表 10μ m(Gimesa染色,×1 000)Fig.1 The arrow shows Toxopalsa gondii tachyzoite from peritoneal fluid smear of infected mice,surrounding pseudocyst can be seen,and lowright was scale,which was 10μ m(Gimesa staining,×1 000)
2.2 小鼠的脑组织病理学动态观察 在上述时间对脑组织进行病理切片,作HE染色,镜检结果如下:感染5d时脑组织未见明显病变。感染10d时脑组织见明显的神经元变性,神经元周围出现多个少突胶质细胞围绕即卫星现象,可见小胶质细胞吞噬死亡的神经元即噬神经现象,未见典型的弓形虫速殖子。感染15d时偶见小胶质细胞和星形胶质细胞增生形成的胶质结节,并见一个较小的弓形虫包囊。感染20d时神经胶质结节、卫星现象、噬神经现象及弓形虫包囊更加多见,珠网膜下腔炎症细胞明显增多,以淋巴细胞为主,同时见少量单核细胞。感染25d时见小血管扩张充血,中等量的炎症细胞围血管浸润形成血管套,即袖套现象(图2-A);神经胶质细胞弥漫性增生形成的结节明显增多,脑实质及血管周边可见多个弓形虫包囊,包囊周围可见噬神经现象、神经胶质细胞弥漫性增多等改变(图2-B和2-C);同时可见脑软化灶(图2-D),其内见脑组织基质消失,崩解的核碎片及增多的淋巴细胞;珠网膜下腔内血管扩张充血,以淋巴细胞和单核细胞为主的炎症细胞弥漫性增多(图2-E)。感染30d时病变与感染25d时的相似。感染60d时脑组织包囊和袖套现象依然明显,弓形虫包囊较感染30d时直径明显增加,囊内见大量缓殖子,珠网膜下腔见明显炎症细胞。感染90d时珠网膜下腔见散在炎症细胞、纤维母细胞及成垂直样排列的新生毛细血管,似肉芽组织(图2-F)。120d后袖套现象开始不明显,但仍可见明显的弓形虫包囊、神经元变性及胶质细胞增生形成结节,珠网膜下腔炎症反应较前明显减轻。感染150d和180d时病理变化与120d时类似,珠网膜下腔仍可见少量炎症细胞浸润。对照组小鼠脑组织病理切片HE染色未见任何病理学变化。
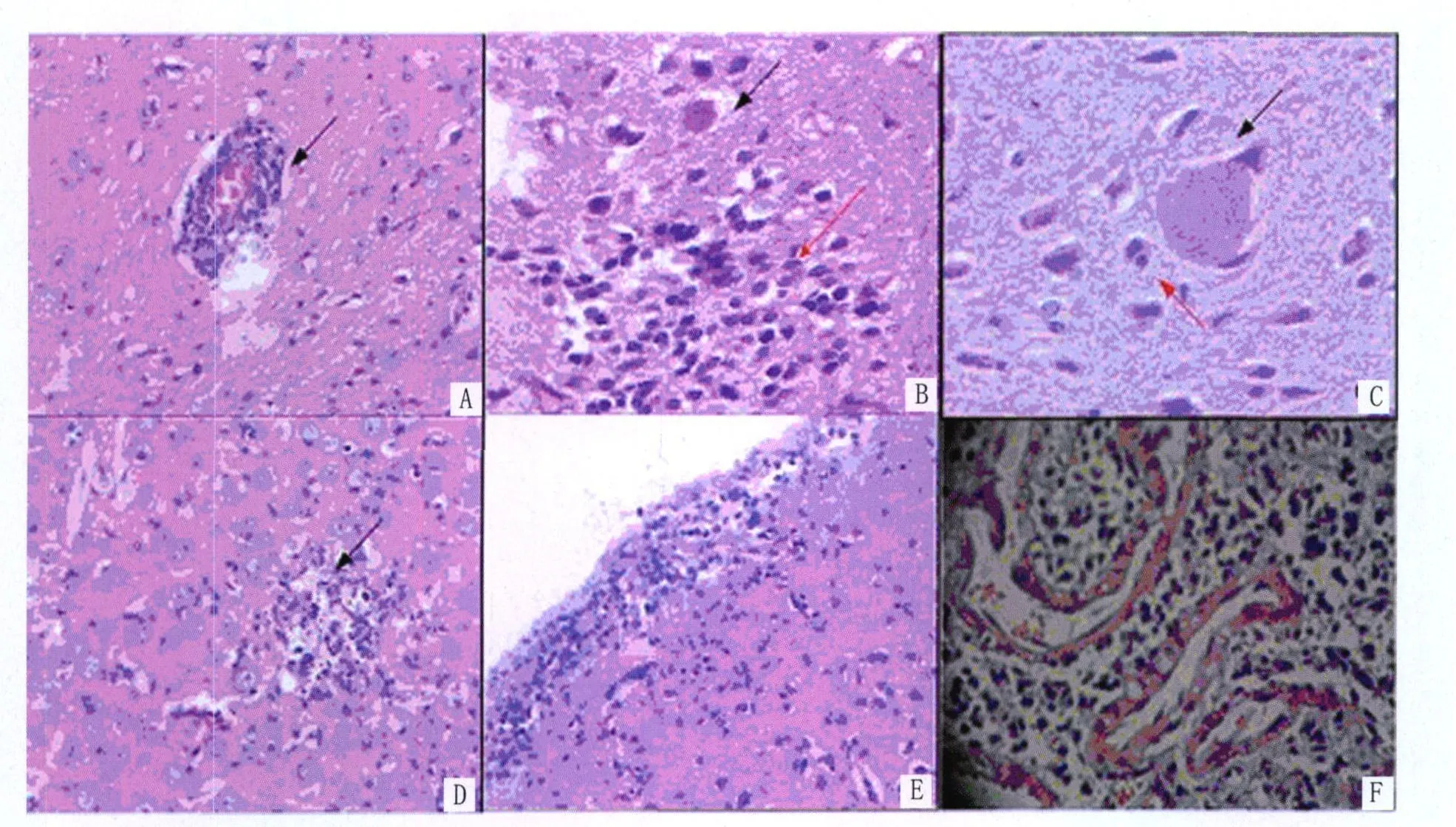
图2 弓形虫感染小鼠脑组织病理学改变A:箭头所示为弓形虫感染第25d袖套现象(HE染色,×200)B:黑色箭头所示为弓形虫感染第25d弓形虫包囊,红色箭头为神经胶质细胞聚集(HE染色,×400);C:黑色箭头所示为弓形虫感染第25d弓形虫包囊,红色箭头显示噬神经现象(HE染色,×400);D:箭头所示为感染第25d脑软化灶(HE染色,×200);E:弓形虫感染第25d珠网膜下腔见炎症细胞浸润及血管扩张充血(HE染色,×200);F:弓形虫感染90d珠网膜下腔肉芽组织(HE染色,×200)Fig.2 Histopathological changes of the brain in mice infected with Toxoplasma gondiiA :Arrow show sleeve cuffing at 25d post-infection(HE staining,×200);B:Black arrow show Toxoplasma cyst,and red arrow show neuroglial cell aggregation at 25d post-infection(HE staining,×400);C :Black arrow show Toxoplasma cyst,and red arrow show neruonophagia at 25d post-infection(HE staining,×400);D:Arrow show cerebral malacia change at 25d post-infection(HE staining,×200);E:Inflammatory cell infiltration,hemangiectasia and hyperaemia on cavitas subarachnoidealis at 25d post-infection(HE staining,×200);F:Granulation tissue on cavitas subarachnoidealis at 90d post-infection(HE staining,×200)

图3 弓形虫感染小鼠脑组织免疫组织化学检测(IHC,×400)A:弓形虫多克隆抗体在感染第10d脑组织中的表达;B:弓形虫感染第60d脑组织出现弓形虫包囊,可见缓殖子(箭头所示为包囊)Fig.3 Immunohistochemistry test of the brain in mice infected by Toxoplasma gondii(IHC,×400)A:Expression of Toxoplasmagondii polyclonal antibody on the brain at 10d post-infection;B:Toxoplasma cysts including bradyzoite on the brain at 60d post-infection(the arrow shows a cyst)
2.3 免疫组织化学检测 对脑组织石蜡切片常规进行脱蜡、入水及染色,以脑组织弓形虫抗原定位处出现棕褐色沉淀判为阳性。通过显微镜观察发现感染第5d时脑组织切片未见棕褐色沉淀,感染第10d时脑组织细胞胞浆和胞核出现棕褐色颗粒状物质(图3-A),说明脑组织中存在弓形虫虫体或弓形虫抗原。从感染15d起脑组织中棕褐色物质渐减少并出现染成淡黄色的弓形虫包囊(图3-B),可清楚看见囊内缓殖子,直至实验结束均能看见弓形虫包囊。对照组小鼠脑组织未见任何阳性反应。
2.4 不同感染时间小鼠脑组织中弓形虫B1基因特异性片段PCR扩增结果 从脑组织匀浆液中提取组织DNA,用PCR仪进行特异性片段扩增。琼脂糖凝胶电泳显示在感染第5d时脑组织DNA中未发现目的条带,而从感染第10d至第180d,在约200bp大小处见一明显条带,考虑为弓形虫B1基因特异性片段(图4),说明在这些组织中存在弓形虫虫体,而对照组小鼠脑组织未扩增出弓形虫B1基因特异性片段。
3 讨 论
以往的研究证明弓形虫速殖子可以侵入脑神经元细胞、星形胶质细胞和小胶质细胞等,并在其内成囊,但对于弓形虫感染所致的脑组织病理损害未见详尽描述。本次研究发现自Prugniaud株弓形虫感染第10d开始小鼠脑组织内即出现神经元变性、卫星现象及噬神经现象等病理改变,第15d起出现神经胶质细胞聚集,第20d起珠网膜下腔发现炎症细胞浸润,25d起出现炎症细胞围血管浸润即袖套现象,第90d时在珠网膜下腔见肉芽组织,可见弓形虫Prugniaud株入侵脑组织可直接损伤神经细胞,甚至可造成细胞的变性坏死,并随时间延长引起小鼠非特异性脑膜脑炎的病理改变,随之逐渐开始了炎症修复过程。在感染第10d时,脑组织免疫组化检测发现了弓形虫抗原,同时用PCR方法检测到弓形虫B1基因特异性DNA,进一步证明了在感染10d时弓形虫速殖子已经进入脑组织,而这与病变的发生有时间上的相关性;常规组织病理学和免疫组化检测均从感染第15d标本中发现弓形虫包囊,且包囊直径随感染时间的增加渐增大,内含缓殖子也渐增多,直至感染第180d仍能找到弓形虫包囊,这些动态变化提示了脑组织的病理损伤主要与弓形虫速殖子有关,之后表现为病变逐渐修复,而弓形虫包囊却长期存在脑组织。然而,在感染第10d时HE染色片上我们未见明显的弓形虫包囊或速殖子,这可能是由于包囊尚未形成,而速殖子较小且经过固定脱水,难以辨别出组织切片中虫体,尤其在核内感染时,不易和核内染色质区别。
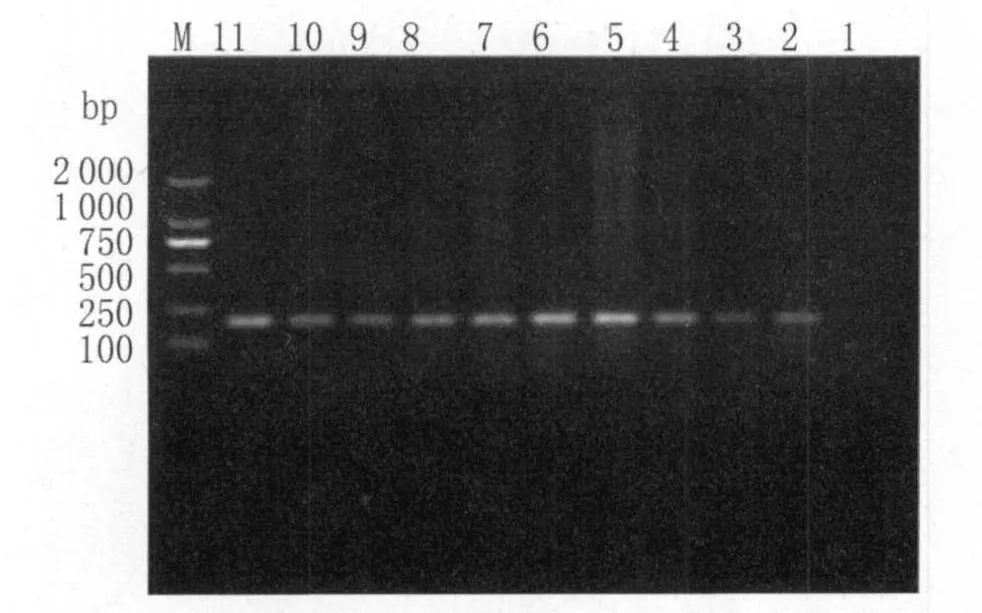
图4 不同感染时间小鼠脑组织中PCR扩增弓形虫B1基因片段电泳图M:marker,1:感染第 5d脑组织,2:感染第 10d脑组织,3:感染第 15d脑组织,4:感染第20d脑组织,5:感染第25d脑组织,6:感染第 30d脑组织,7:感染第 60d脑组织,8:感染第90d脑组织,9:感染第120d脑组织,10:感染第150d脑组织,11:感染第180d脑组织Fig.4 B1 gene identification for brain tissue by PCR in different timeM :100bp lander,1:brain tissue 5d post-infection,2:brain tissue 10d post-infection,3:brain tissue15d post-infection,4:brain tissue 20d post-infection,5:brain tissue25d post-infection,6:brain tissue 30d post-infection,7:brain tissue 60d post-infection,8:brain tissue 90d post-infection,9:brain tissue 120d post-infection,10:brain tissue 150d post-infection,11:brain tissue 180d post-infection
本实验观察到的包囊形成与学者Ferguson[5]应用电镜观察到的结果基本相似,即第11d出现早期包囊,3~6个月包囊直径增大,直至22个月均可见包囊,实验中15d才看见包囊可能是由于检测手段及取材时间不同导致;组织病理学变化与杜重波[6]等观察到的自然弱毒株引起小白鼠脑组织病理改变是不完全相同的,后者在感染第7d即可发现袖套现象,且未见明显的神经细胞软化坏死的表现,而本实验在感染第25d时才观察到袖套现象,并见明显的脑软化灶,这些差别的可能原因是所用小鼠品系、级别及虫株不同引起。实验中发现感染小鼠第6d开始出现食欲减退、耸毛、腹泻等症状,同时出现15%的死亡,第20d起开始恢复,第30d时如同正常小鼠,这些临床症状的出现与弓形虫速殖子侵入内脏器官引起这些器官严重的病理改变有明显关系(内脏的病理改变见另文描述)。
免疫组化染色时发现包囊着色较速殖子浅,这与刘俊燕等[7]的观察结果是一致的,可能原因是由于所用的兔抗弓形虫多克隆抗体是针对 RH速殖子的,而Prugniaud株和RH株产生的抗原是有一定区别的;同时包囊囊壁较厚且虫体排列紧密致使弓形虫抗原不易暴露所致。脑内包囊的长期存在对于免疫力受抑制的患者如艾滋病患者、器官移植和癌症放化疗患者可能造成严重危害,是弓形虫病复发的根源。
[1]于恩庶.中国弓形虫病[M].香港:亚洲医药出版社,2000:18-19.
[2]刘利,董国军,高振平,等.弓形虫RH株在实验小鼠脑组织内的动态分布[J].中国病原生物学杂志,2009,4(9):670-671.
[3]张永举,李宏军,赵旋.艾滋病相关性弓形虫脑炎的影像学诊断[J].中国艾滋病性病,2008,14(4):368-370.
[4]王家传,蒋作君,沈继龙,等.一个具有诊断价值的弓形虫基因的发现[J].临床输血与检验,2005,7(3):184-186.
[5]Ferguson DJP,Hutchison WM.An ultrastructural study of the early evelopment and tissue cyst formation ofToxoplasma gondiiin the brains of mice[J].Parasitol Res,1987,,73(6):483-491.
[6]杜重波,郭志刚,马军武,等.弓形虫GJS株、QHO株人工感染小白鼠动态病理学研究[J].中国兽医科技,1989,12:12-15.
[7]刘俊燕,杨秀珍,吴增强,等.间接免疫酶染色检测小鼠组织内弓形虫及抗原[J].天津医科大学学报,2005,11(3):356-358.

