25℃时三元体系SrCl2-CaCl2-H2O相平衡研究
毕玉敬 孙 柏 赵 静 宋彭生 李 武
(1中国科学院青海盐湖研究所,西宁 810008)(2中国科学院研究生院,北京 100049)
25℃时三元体系SrCl2-CaCl2-H2O相平衡研究
毕玉敬1,2孙 柏*,1赵 静1,2宋彭生1李 武1
(1中国科学院青海盐湖研究所,西宁 810008)
(2中国科学院研究生院,北京 100049)
采用等温溶解平衡法,研究了三元体系SrCl2-CaCl2-H2O 25℃相平衡,同时测定了平衡溶液的物化性质(密度和折光率)。平衡液相所对应的平衡固相由湿渣法、偏光显微镜观测法和XRD法确定。根据实验研究数据,绘制了该三元体系相图。相图由3个无变量点、4条单变量曲线和4个盐类结晶区构成,4个结晶区分别对应CaCl2·6H2O、钙盐为基固溶体、锶盐为基固溶体和SrCl2·6H2O 结晶区。
相平衡;溶解度;氯化钙;氯化锶;固溶体
0 引 言
我国有丰富的无机盐液体矿产资源,包括海水、盐湖卤水、井卤、油田水等,在青藏高原地区有丰富的卤水资源[1],相对于海水和盐湖卤水,油田水的开发还不充分,使这一宝贵的资源未能得到充分的利用。随着现今发现的油气田资源开发的加快和生产规模的迅速扩大,使得油田水产量急剧增加[2],因此,就需要对油田水相关的开发利用进行有关的基础研究工作。相平衡研究是卤水资源开发利用的理论基础。利用相图可以判断体系中各种盐的析出顺序及转化规律,利用水盐体系的溶解度和物化性质数据进行工艺计算,制定卤水开发的蒸发、冷冻、兑卤和结晶等工艺流程[3-6]。
柴达木盆地南翼山地区油田水按照苏林分类属于氯化钙型,该油田水除含有大量的氯化钙外,还含有较高浓度的氯化锶 (锶离子:5 363.75 mg·L-1),锂、钾、锶远景储量较大[7],具有较高的开发价值。目前,针对该油田卤水的开发,已展开相关研究工作[8-11],经过前期处理后,该地区油田水可近似概括为LiCl-KCl-NaCl-CaCl2-SrCl2-H2O六元体系。作为该油田卤水体系的次级体系,NaCl-CaCl2-H2O[19]、SrCl2-KCl-H2O[20]和 SrCl2-NaCl-H2O[21]等三元体系 25℃时相关系已进行过报道。本论文报道对SrCl2-CaCl2-H2O三元体系25℃相平衡的研究结果。
相平衡实验,通常从低组分体系逐渐向高组分体系进行研究,SrCl2-CaCl2-H2O体系的研究结果,可以为含有该三元体系的高组分体系,提供实验研究依据和模型计算数据[12-15]。SrCl2-CaCl2-H2O三元体系相化学研究,对于该油田水的开发及其老卤的处理有一定的指导意义。
SrCl2-CaCl2-H2O三元体系,仅Assarsson于1953年进行过18~114℃多温相化学研究[16]。为研究该三元体系中SrCl2·6H2O与SrCl2·2H2O之间的相转变点,Assarsson 详 细研 究 了 该 体 系 18.0、28.0、28.5、29.0、29.5 和 29.7 ℃时相平衡关系,未报道 25 ℃时研究结果。对于油田卤水体系相关系研究,该三元体系25℃相化学研究,是必不可少的研究基础。
1 实验部分
1.1 试剂及纯化
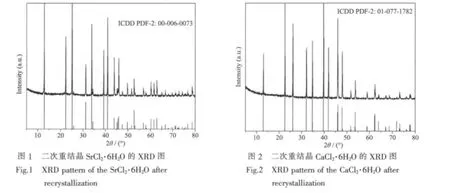
水:经离子交换和二次蒸馏过的纯水,pH=6.60,电导率小于 1.2×10-4S·m-1。 实验中试剂重结晶、配置平衡料液及化学分析均用此水。六水合氯化锶:SrCl2·6H2O 试剂(G.R.,天津华北特种试剂有限公司),进行二次重结晶,晶体析出和干燥温度均控制在60℃以下,其化学组成分析结果见表1。经X-ray粉晶衍射鉴定为SrCl2·6H2O,图1为二次重结晶SrCl2·6H2O的XRD图。六水合氯化钙:CaCl2·6H2O 试剂(G.R.,天津华北特种试剂有限公司),进行二次重结晶,结晶析出和干燥温度均控制在28℃以下,其化学组成分析结果见表2。经X-ray粉晶衍射鉴定为CaCl2·6H2O,图2为二次重结晶CaCl2·6H2O的XRD图。

表1 二次重结晶SrCl2·6H2O化学组成Table 1 Chemical composition of SrCl2·6H2O after recrystallization

表2 二次重结晶CaCl2·6H2O化学组成Table 2 Chemical composition of CaCl2·6H2O after recrystallization
1.2 实验仪器
ICAP 6500 DUO型等离子体发射光谱仪 (美国热电公司);X′Pert Pro型X-ray衍射仪 (荷兰帕纳科公司),工作条件:Cu Kα,管压 40 kV,管流 30 mA;BP 210S型分析天平 (德国赛多利斯公司);BX41型偏光显微镜(日本奥林巴斯公司)。
1.3 相平衡研究方法
本文采用等温溶解平衡法进行相平衡研究,实验装置如图3所示。实验温度采用双重控温装置控制,以避免环境温度波动对平衡温度的影响。温度波动范围为±0.03℃,溶解度及液相物化性质均在(25±0.03)℃下进行测定。体系液相平衡标志为化学组成不变。体系平衡固相综合采用湿渣法[17]、偏光显微镜观察法及XRD法确定。该体系的平衡时间为4~6 d。

1.4 分析方法
锶钙共存时,用EDTA配位滴定Ca2+或Sr2+离子,相互之间有强烈的干扰。本研究的固、液相化学组成中Ca2+、Sr2+用ICP-AES法测定。配制标准溶液的储备液,采用质量滴定法确定其浓度。分别标定阳离子、阴离子浓度,两者偏差小于0.2%。用储备液配制六个标准溶液测定标准曲线,未知样品测试后测定已知标准样品,标准溶液每次测定偏差小于1%。同时测定未知样品总氯浓度,与ICP测定结果计算得到的总氯浓度比较,两者偏差小于1%。其中Cl-:汞量法测定[18-19];Sr2+:采用改进的质量滴定法[20];Ca2+:采用改进的质量滴定法[19],以指示剂溶液(钙试剂羧酸钠盐0.10g,用体积比为1:1的丙酮与水混合溶液溶解,并稀释至50 mL)作为指示剂。ICP-AES仪器工作条件:高盐雾化器,泵速50 r·min-1,雾化器流速 0.55 L·min-1,RF 功率 1150 W,冷却气流量12 L·min-1,辅助气流量 0.5 L·min-1。
1.5 密度和折光率的测定方法
作为溶液重要物化性质,在本研究中测定了平衡溶液的密度和折光率。它们不仅在组成-性质图上作为奇异点,可以佐证体系的平衡状态。同时也提供了溶液的基础性质数据。
本研究中测定了平衡液相的密度和折光率。测定方法:密度采用比重瓶法测定。在(25±0.03)℃下,用去离子二次蒸馏水校正比重瓶的体积。用已校正的比重瓶,测定平衡液相的密度,每次测定2个平行样,取其平均值。测定的2个平行样的密度值,相对偏差小于0.3%。折光率采用WZS-I 800067型阿贝折射仪测定。在(25±0.03)℃下,用去离子二次蒸馏水校正阿贝折射仪的折光率为1.33246(25℃时纯水折光率)[22]。用已校正的阿贝折光仪测定平衡液相的折光率,测定过程中,间隔10 min测定1次,重复测定3次或3次以上,每次相差不超过0.0002,然后取其平均值。密度和折光率的测定均在 (25±0.03)℃下进行。
2 结果与结论
2.1 体系溶解度

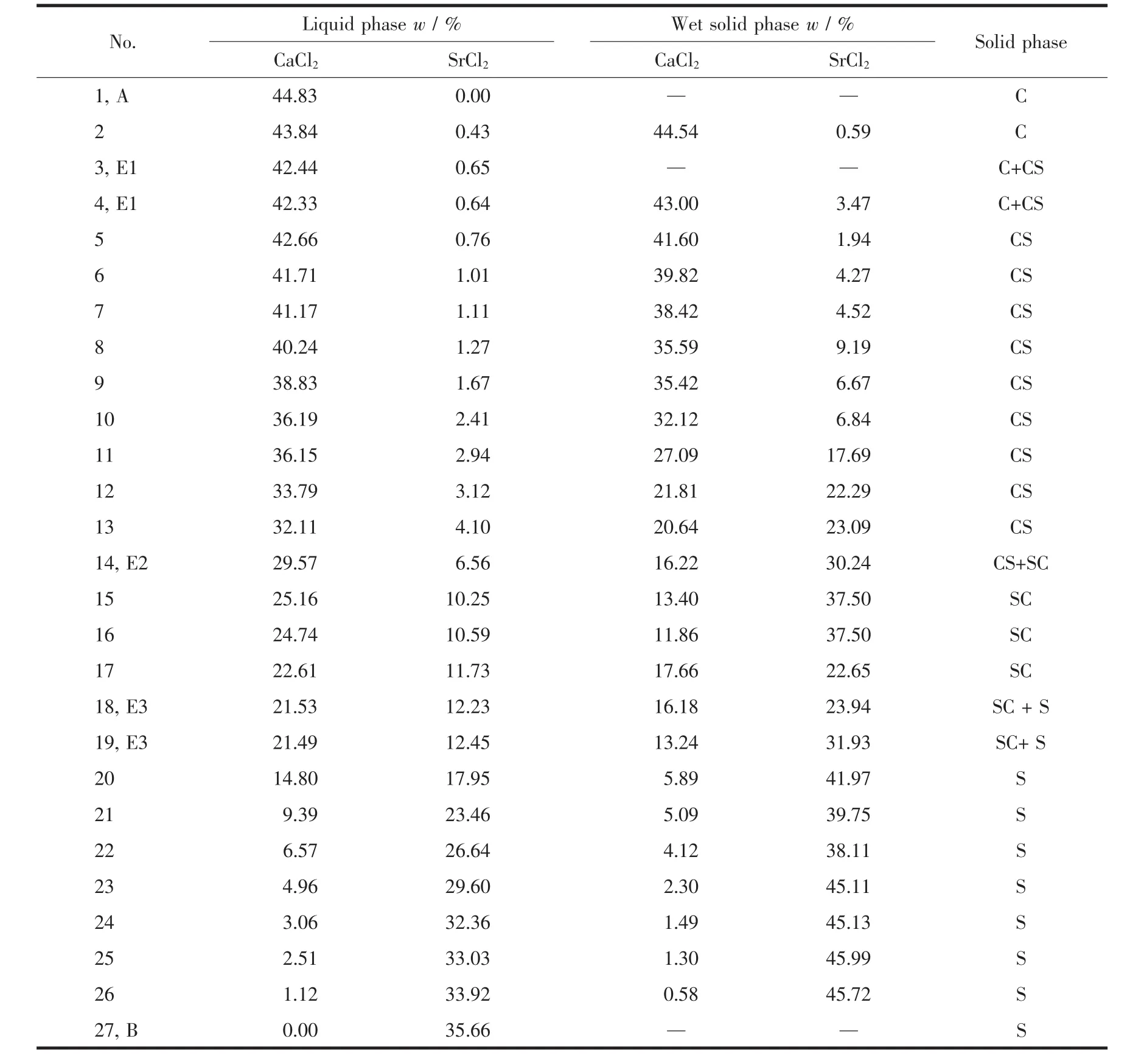
表3 三元体系SrCl2-CaCl2-H2O 25℃时溶解度Table 3 Solubility in the ternary system SrCl2-CaCl2-H2O at 25℃
三元体系SrCl2-CaCl2-H2O 25℃溶解度与相关系及平衡溶液物化性质的研究结果列于表3中。图4为该三元体系25℃等温溶解度相图。根据获得的该体系溶解度和湿固相数据、偏光显微镜照片及XRD衍射结果可以判断,该体系存在3个无变量点,4个盐类结晶区,它们分别对应于CaCl2·6H2O、钙盐为基固溶体、锶盐为基固溶体和SrCl2·6H2O。平衡液相 w(CaCl2)组成在 0%~21.53%之间(图 4中 B至 E3 点),对应的固相为 SrCl2·6H2O。 w(CaCl2)浓度在 21.53%~29.57%之间时(图 4 中 E2 至 E3),形成以 锶盐为基固溶体。w(CaCl2)浓度在29.57%~42.44%之间时(图4中E1至E2),形成以钙盐为基固溶体。 w(CaCl2)浓度在 42.44%~44.83%到之间时(图4中A至E1点),对应的固相为CaCl2·6H2O。
2.2 体系平衡固相确定
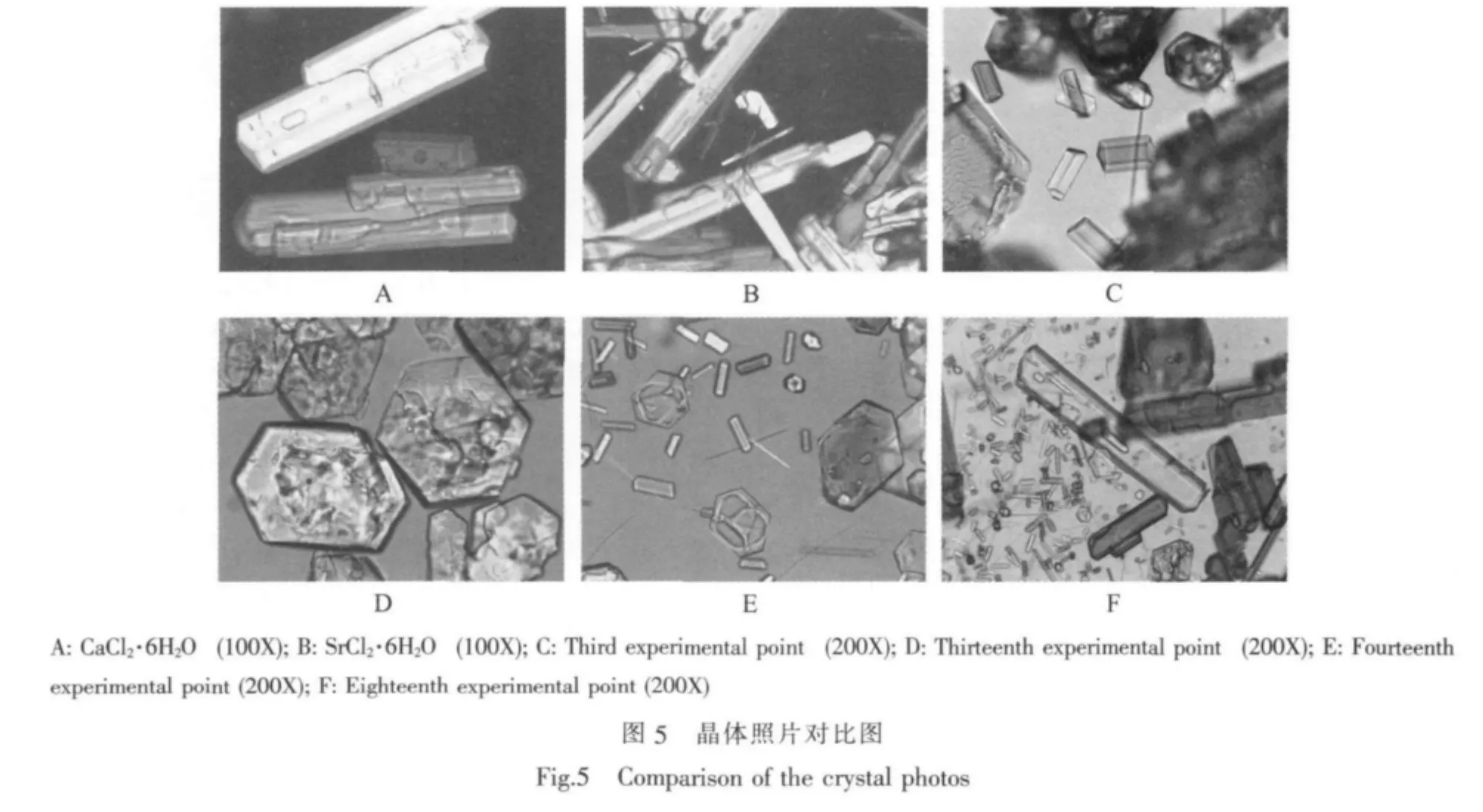
研究水盐体系相平衡时,经常采用湿渣法[17]确定体系中液相对应平衡固相的种类和组成。对于该三元体系中SrCl2·6H2O相区,平衡液相点与对应湿固相连线的延长线,与相图中SrCl2-H2O轴相交,其交点所对应的w(SrCl2)组成,与SrCl2·6H2O在SrCl2-H2O 坐标轴上的理论值(59.46%),本实验 w(CaCl2)在0%~21.53%浓度范围,湿渣交点组成w(SrCl2)与理论值比较接近,最大误差为-2.43%,在实验允许误差(5%)范围内。对比偏光显微镜晶体照片(图5),可以看出该相区平衡固相晶体外貌与SrCl2·6H2O晶体一致。综合以上实验结果及XRD结果,可以确定SrCl2·6H2O 相区的浓度范围为 w(CaCl2·6H2O)组成在 0%~21.53%之间。对于 w(CaCl2)在 21.53%~29.57%浓度范围,平衡液相与湿固相连线的延长线并不相交,湿渣线斜率约为-2.0~-2.3, 湿 渣 交点 为 61.62~68.55,均 大 于SrCl2·6H2O理论组成点。对比平衡固相显微镜照片,体系中对应的平衡固相晶体外貌与纯CaCl2·6H2O(图 5 A)、SrCl2·6H2O(图 5B)均不同。对比 XRD 衍射图,体系对应平衡固相的衍射特征峰逐渐向CaCl2·6H2O方向偏移。结合以上实验结果,可以判断该固相为CaCl2·6H2O与SrCl2·6H2O形成的以锶盐为基固溶体。从图5实验点14和实验点18偏光显微镜照片中,可以看出是细小的晶体颗粒。
w(CaCl2)在 29.57%~42.44%浓度范围,对应的平衡固相为以钙盐为基固溶体。湿渣线斜率约为-1.6~-1.7,湿渣交点逐渐向纯 CaCl2·6H2O 点移动。 对比平衡固相偏光显微镜照片,平衡固相晶体外貌与体系中纯 CaCl2·6H2O(图 5A)、SrCl2·6H2O(图 5B)均不相同,结合XRD衍射图,判定该晶体为以钙盐为基固溶体。从图5实验点13和实验点14的偏光显微镜照片中可以看出,为六角片状晶体。
对于实验点3,从平衡固相晶体照片(图5C)中可以观察出,有短粗的小晶体和较大块状CaCl2·6H2O晶体存在,说明该点为固溶体与CaCl2·6H2O共饱点。 故 w(CaCl2)在 42.44%~44.83%浓度范围,体系对应平衡固相为CaCl2·6H2O。
2.3 液相密度和折光率的计算
应用本实验室之前提出的平衡液相密度和折光率方程[19-22]:

计算出25℃时SrCl2-CaCl2-H2O体系平衡液相的密度和折光率值。 公式(1)和(2)中,d25、d0和 D25、D0分别为25℃时饱和溶液和纯水的密度及折光率,25 ℃时 d0=997.04 kg·m-3;D0=1.332 46[23]。 Wi为溶液中第i种溶质的质量百分数,Ai为对于该盐溶液密度的特征系数,Bi为对于该盐溶液折光率的特征系数。
根据测定的25℃时单盐饱和溶液密度和折光率数据,得到25℃该体系单盐的密度和折光率系数,见表4。根据单盐的密度和折光率系数,计算得到体系中平衡液相的密度和折光率。分别对比密度和折光率的计算值和实验测定值,见表5。该体系中密度的计算值和测定值的最大相对偏差为0.92%;对于折光率,计算值和测定值的最大相对偏差为0.41%。上述偏差较小,表明密度和折光率方程在该体系中具有很好的适用性。
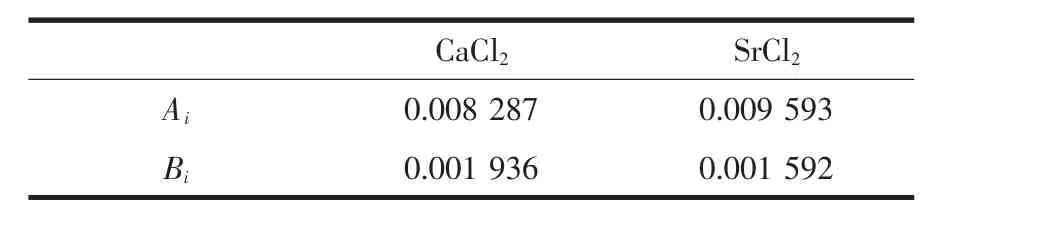
表4 三元体系SrCl2-CaCl2-H2O 25℃单盐的密度和折光率系数Table 4 Single salt coefficients of density and refractive index in the ternary system SrCl2-CaCl2-H2O at 25℃
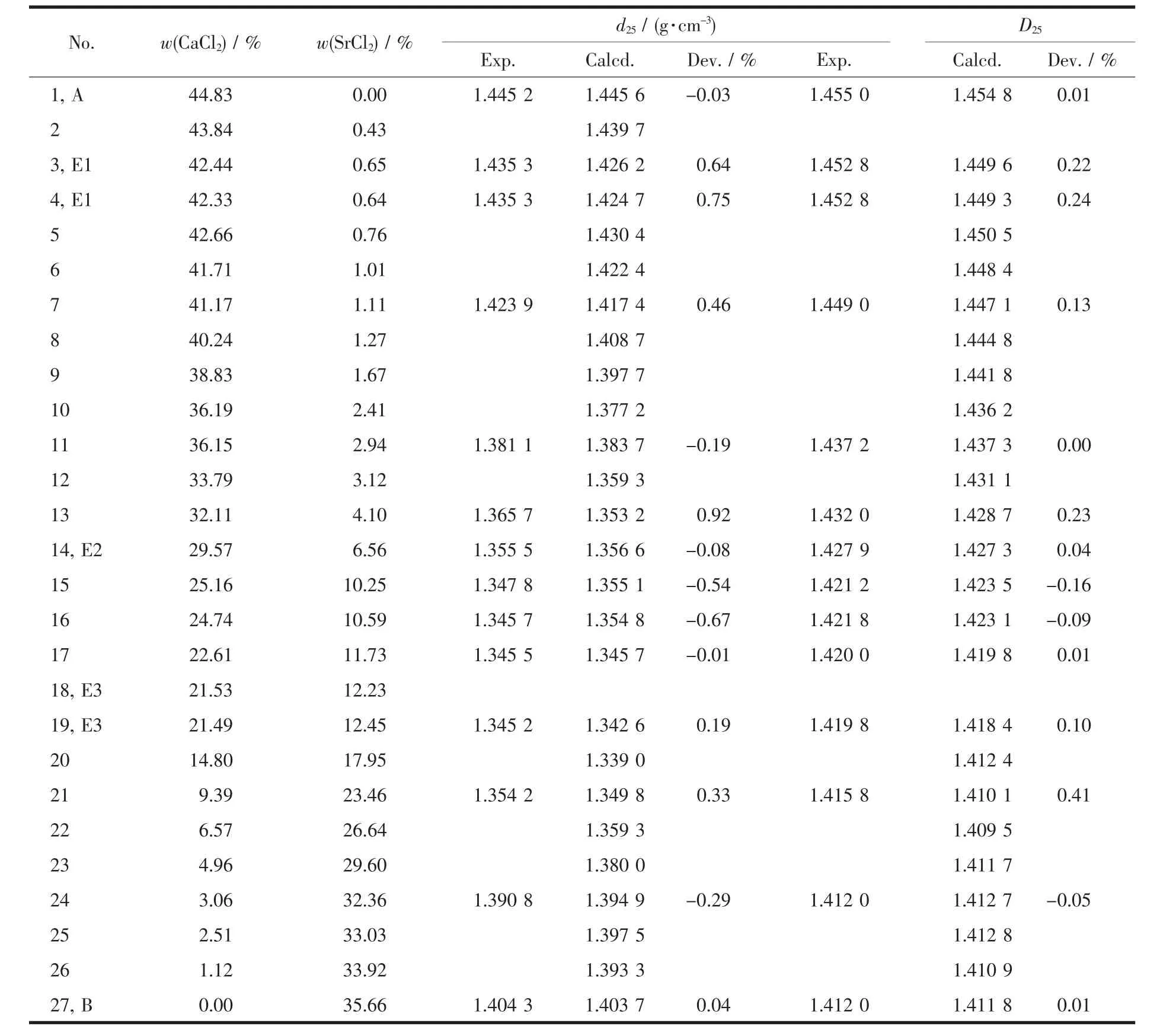
表5 三元体系SrCl2-CaCl2-H2O 25℃时溶液密度和折光率计算值与实验值对比Table 5 Comparison of the calculated and experimental values of density and refractive index in the ternary system SrCl2-CaCl2-H2O at 25oC
2.4 与文献28℃时研究结果的比较
Assarsson[16]在1953年对该体系18~114℃的相平衡进行过研究,但未报道25℃时的研究结果。本文选取与之相近的28℃时的研究结果进行了对比。Assarsson认为28℃时SrCl2-CaCl2-H2O体系在全浓度范围内(除2个单盐饱和点外)平衡固相均为钙锶固溶体。而本文研究结果与其相区分布有较大区别,综合运用湿渣法、偏光显微镜观测法和XRD鉴定,可以判断该体系存在4个相区,分别为CaCl2·6H2O 相区、SrCl2·6H2O 相区、 钙盐为基固溶体相区、锶盐为基固溶体相区。经反复验证,本文数据是可靠的。实验过程中,实验点分布较密,获得的溶解度曲线能更好的反映出体系中盐类溶解度的变化。
3 结 论
采用等温溶解度平衡法,系统研究了25℃时SrCl2-CaCl2-H2O三元体系的等温溶解度曲线,确定了体系的无变量点组成和盐类结晶区的分布。结果表明,平衡液相w(CaCl2)组成在0%~21.53%之间,对应的固相为 SrCl2·6H2O,w(CaCl2)浓度在 42.44%~44.83%到之间时, 对应的固相为 CaCl2·6H2O,w(CaCl2)浓度在 21.53%~29.57%之间时,形成以锶盐为基固溶体,w(CaCl2)浓度在 29.57%~42.44%之间时,形成以钙盐为基固溶体。实验同时测定了25℃下SrCl2-CaCl2-H2O三元体系平衡液相的密度和折光率,通过对比计算值与实验值,表明文献中密度、折光率公式是适用于该体系的。
[1]ZHENG Xi-Yu(郑喜玉),ZHANG Ming-Gang(张明刚),XU Chang(徐昶),et al.China Salt Lake Scripts(中国 盐湖志).2002.
[2]FU Jian-Long(付建龙),YU Sheng-Song(于升松),LI Shi-Jin(李 世金),et al.J.Salt Lake Res(Yanhu Yanjiu),2005,13(3):17-22
[3]Teeple J E.The Industrial Developmet of Searles Lake Brines,withEquilibriumData.New York:ChemicalCatalog Company,1929.
[4]LI Gang(李刚),SUN Bai(孙柏),SONG Peng-Sheng(宋彭生).J.Salt Lake Res.(Yanhu Yanjiu),2002,10(3):13-16
[5]LI Hai-Min(李海民),CHENG Huai-De(程怀德),ZHANG Quan-You(张全友),et al.CN Patent,1255320.2006-05-10.
[6]HUANG Xue-Li(黄雪莉).The Thesis for Doctorate of Dalian University of Technology(大连理工大学博士论文).2007.
[7]WU Wei(吴伟).Thesis for Master of Institute of Salt Lakes,Chinese Academy of Sciences(中国科学院青海盐湖研究所硕士论文).2007.
[8]CUI Xiang-Mei(崔香梅),DONG Ya-Ping(董亚萍),Wu Zhi-Jian(吴志坚),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2008,24(1):73-77
[9]CUI Xiang-Mei(崔香梅),DONG Ya-Ping(董亚萍),NAI Xue-Ying(乃学英),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2009,25(8):1434-1438
[10]LI Qing-Hai(李 青 海),HE Li(何 荔),Yao Yan(姚 燕 ),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2010,26(10):1804-1809
[11]WU Wei(吴伟),LI Bing(李冰),DONG Mai-Qing(董迈青),et al.J.Salt Lake Res.(Yanhu Yanjiu),2007,15(3):48-50
[12]SONG Peng-Sheng(宋彭生),YAO Yan(姚燕),SUN Bai(孙柏),et al.Sci.China,Ser.B,2010,40(9):1286-1296
[13]Pitzer K S.Activity Coefficients in Electrolyte Solutions.2th Ed.London:CRC Press.1991.
[14]Havrie C E,Weare J H.Geochim.Cosmochim.Acta,1980,44:981-997
[15]Prausnitz J M,Lichtenthaler R N,de Azevedo E G,Translated by LU Xiao-Hua(陆小华),LIU Hong-Lai(刘洪来).Molecular Thermodynamics of Fluid-Phase Equilibria.3th Ed.(流体相平衡的分子热力学.3版).Beijing:Chemical Industry Press,2006:335-340
[16]AssarssonGO,BalderA.J.Phys.Chem.,1953,57(7):717-722
[17]SONG Peng-Sheng(宋彭生).J.Salt Lake Res.(Yanhu Yanjiu),1991(1):15-23
[18]Qinghai Institute of Salt Lakes,Chinese Academy of Sciences(中国科学院青海盐湖研究所).Analysis Methods for Brines and Salts.2nd Ed.(卤水和盐的分析方法.2版).Beijing:Science Press,1988:64-66
[19]DING Xiu-Ping(丁秀萍),BI Yu-Jing(毕玉敬),SHI Li-Jie(时历杰),et al.J.Salt Lake Res.(Yanhu Yanjiu),2009,17(3):40-43
[20]SHI Li-Jie(时历杰),SUN Bai(孙柏),DING Xiu-Ping(丁秀萍),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2010,26(2):333-338
[21]SONG Peng-Sheng(宋彭生),DU Xian-Hui(杜宪惠),XU Heng-Cun(许恒存).Chin.Sci.Bull.(Kexue Tongbao),1983,28(2):106-110
[22]DING Xiu-Ping(丁秀萍),SUN Bai(孙柏),SHI Li-Jie(时历杰),et al.Chinese Inorg.Chem.Ind,2010,42(6):9-11
[23]LIU Guang-Qi(刘光启),MA Lian-Xiang(马连湘),LIU Jie(刘杰).Handbook of Data on Physical Property for Chemistry and Chemical Industry:Inorganic Section(化学化工物理性质数据手册:无机卷).Beijing:Chemical Industry Press,2002:43
Phase Equilibrium in Ternary System SrCl2-CaCl2-H2O at 25℃
BI Yu-Jing1,2SUN Bai*,1ZHAO Jing1,2SONG Peng-Sheng1LI Wu1
(1Qinghai Institute of Salt Lakes,Chinese Academy of Sciences,Xining 810008,China)
(2Graduate University of Chinese Academy Sciences,Beijing 100049,China)
Phase equilibrium in the ternary system SrCl2-CaCl2-H2O at 25℃was studied by isothermal method.Physicochemical properties(density and refractive index)of the solution were also determined.The solid phases were confirmed together by wet residue method,microscope observed method and XRD.The phase diagram was plotted according to the experimental values.In the equilibrium phase diagram of SrCl2-CaCl2-H2O,there are three invariant points,four univariant curves and four regions of crystallization:CaCl2·6H2O,calcium chloride base solid solution,strontium chloride base solid solution and SrCl2·6H2O.
phase equilibrium;solubility;calcium chloride;strontium chloride;solid solution
O642.4+2;O645.12
A
1001-4861(2011)09-1765-07
2011-03-18。收修改稿日期:2011-05-16。
国家自然科学基金(No.20773152),青海科技创新能力促进计划(No.2009-Z-725)资助项目。
*通讯联系人。 E-mail:sunb@isl.ac.cn,Tel:0971-6306024
