啤酒生产过程中脱氧雪腐镰刀菌烯醇的控制研究
蔡国林,金 昭,陆 健,*
(1.江南大学工业生物技术教育部重点实验室,江苏无锡214122; 2.江南大学生物工程学院,江苏无锡214122)
啤酒生产过程中脱氧雪腐镰刀菌烯醇的控制研究
蔡国林1,2,金 昭2,陆 健1,2,*
(1.江南大学工业生物技术教育部重点实验室,江苏无锡214122; 2.江南大学生物工程学院,江苏无锡214122)
以感染镰孢霉属真菌的大麦为原料,确定了NaHSO3溶液浸泡的化学脱毒方法(浸泡浓度为10g/L和浸泡时间为50min)和在第一次浸麦阶段接种白地霉孢子106个/g大麦的微生物脱毒方法,并对比研究了两种脱毒方法的效果。对制麦和酿造过程中DON变化及相关理化指标的比较发现,添加白地霉G4的脱毒效果较NaHSO3溶液浸泡好,而采用NaHSO3溶液浸泡处理方法所制得的麦芽、麦汁和啤酒的理化指标相对较好。两种脱毒方式所制得的麦芽的理化指标均符合QB/T1686-2008中啤酒麦芽的要求,成品啤酒的常规理化指标均符合GB 4927-2008中淡色啤酒的理化要求。
脱氧雪腐镰刀菌烯醇,真菌毒素,啤酒,控制
1 材料与方法
1.1 实验材料
白地霉 分离自大麦表面,由本研究室保藏; PDA培养基 取去皮马铃薯200g,切块,加1000mL蒸馏水,煮沸20min后用纱布过滤,补加蒸馏水至1000mL,加入葡萄糖 20g,分装,121℃高压灭菌20min;5°P麦汁培养基 取糖化麦汁,加蒸馏水适量,稀释成5°P,分装,108℃灭菌20min;大麦原料经过挑选的感染镰孢霉属真菌的2008年度某农民散种大麦;甲醇 色谱纯,购自江苏汉邦科技有限公司;乙腈 色谱纯,购自 Fisher Chemicals公司; Whatman 4号定性滤纸 购自上海摩速科学器材有限公司;其它试剂 均为国产分析纯;PuriToxSR呕吐毒素专用净化柱 购自北京锐鑫农科贸有限公司。
1.2 实验方法
1.2.1 白地霉菌株培养条件 白地霉菌株4℃保藏,使用前,连续两次转接到PDA培养基上进行活化,转接至5°P麦芽汁平板上,28℃培养过夜,取一环菌种,加入25mL 5°P麦芽汁培养基中,于28℃、180r/min条件下摇床培养48h。调整菌体浓度为107cfu/mL,用于实验接种。
1.2.2 制麦工艺 浸麦前洗麦两次,浸麦:浸麦6h,断水12h,浸麦2h,断水8h,浸麦2h,共30h,浸麦温度15℃;发芽:15℃发芽4d,湿度控制在90%;焙燥: 40℃ 14h,75℃ 3h,85℃ 3h。
1.2.3 糖化和发酵工艺 糖化和发酵工艺曲线见图1,70℃60min后煮沸麦汁,煮沸时间为40min,煮沸10min时添加酒花,酒花添加量0.003%。发酵所用麦汁为全麦芽麦汁。

图1 糖化工艺曲线(A)和发酵工艺曲线(B)
1.2.4 NaHSO3浸泡去除DON 以感染赤霉病的江苏产散户大麦为原料,浸泡大麦所用NaHSO3溶液的体积为大麦重量的2~3倍,通过霉菌培养计数及发芽率测定来确定NaHSO3溶液的浓度和浸泡时间。NaHSO3溶液浸泡后的大麦按1.2.2工艺进行制麦。
1.2.5 微生物去除DON 除了在第一次浸麦水中添加一定浓度的白地霉孢子外,其它工艺按1.2.2进行。
1.3 分析方法
HPLC方法检测大麦、麦芽和啤酒中的DON[14],大麦或麦芽中DON的检测限为0.03mg/kg,啤酒中DON的检测限为0.4μg/L;麦芽、麦汁和啤酒常规指标的测定:按文献[15-16]中方法。
2 结果与讨论
2.1 NaHSO3溶液浓度和浸泡时间的选择
DON是镰孢霉属真菌的次级代谢产物,通过清洗大麦上的霉菌可以减少发芽过程中DON的产生。NaHSO3不仅可以和DON形成DON磺酸盐,还可以有效地清洗大麦表面的霉菌。不同浓度和浸泡时间对大麦表面霉菌的清洗效果和发芽率影响如表1所示。从表1可知,随着NaHSO3浓度的增加和浸泡时间的延长,大麦表面霉菌的清洗效果有所提高,同时发芽率有所降低。当采用浓度为10g/L的NaHSO3溶液浸泡50min时,大麦表面霉菌的清洗效果较好,且对发芽率的影响较小。

表1 NaHSO3溶液浓度和浸泡时间对霉菌清洗效果和发芽率的影响
2.2 白地霉添加量的选择
微生物脱毒主要通过竞争作用,抑制其它霉菌的生长,尤其是镰孢霉属真菌。表2反映了白地霉不同添加量的脱毒效果。从表2可知,添加白地霉对大麦的发芽率基本上没有影响,但对发芽的整齐度有所提高。当白地霉的添加量为106个/g大麦和107个/g大麦时,成品麦芽中都检测不到DON,但考虑到白地霉生长繁殖快,如果接种量过大,有可能对麦芽和啤酒的品质产生不利的影响。因此,选用106个/g大麦的接种量。
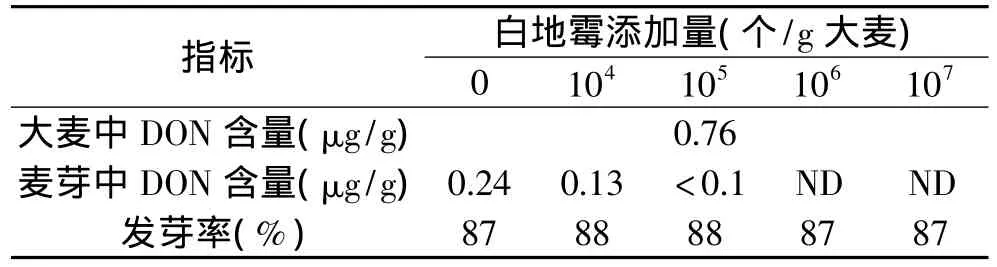
表2 第一次浸麦时添加不同量的白地霉所制的麦芽中DON含量
2.3 制麦过程中DON变化的比较
不同脱毒方式制麦过程中的DON变化情况如图2所示。从图2可以看出,对于未经任何处理的大麦,DON含量经历了一个先减少后增加的过程,最终成品麦芽中DON约为原大麦的57%,这与Schwarz等人的研究结果相似[5]。这是因为DON具有水溶性,浸麦可以去除部分DON和镰孢霉属真菌,而在浸麦和发芽初期,大麦内部未被洗掉的镰孢霉属真菌孢子重新萌发、生长、代谢,再次产生并积累DON。而采用10g/L的NaHSO3溶液浸泡50min可以去除大麦的全部DON,且在制麦过程中重新生成的DON含量也相对减少,最终成品麦芽中的DON含量约为原大麦的13%。接种白地霉的大麦在浸麦结束时,检测到微量的DON(低于定量限),但在发芽过程中、成品麦芽和麦根中均未检测到DON,说明白地霉的生长抑制了镰孢霉属真菌的生长代谢,并最终影响DON的形成与积累。

图2 NaHSO3浸泡和添加白地霉两种方式脱毒效果的比较
2.4 不同脱毒方式麦芽品质的比较
NaHSO3浸泡和添加白地霉两种脱毒方式所制得麦芽的理化指标如表3所示,两种麦芽的理化指标均符合QB/T1686-2008中的啤酒麦芽的要求。

表3 NaHSO3浸泡和添加白地霉两种脱毒方式麦芽理化指标的比较
从表3可知,相对于未经处理的大麦所制得的麦芽,NaHSO3溶液浸泡处理的大麦所制得的麦芽的糖化力、色度和库值等指标比较优良;接种白地霉所制麦芽的总氮和可溶性氮较高。在以前的研究中观察到白地霉可以穿透大麦表皮,进入到胚乳细胞壁间隙,麦芽中的总氮和可溶性氮较高可能与浸麦所接种的白地霉在制麦过程中大量生长有关。
2.5 糖化和发酵过程中DON变化的比较
对两种不同处理方式所制得的麦芽进行了啤酒酿造实验,DON在酿造过程中的变化情况如表4所示,DON的回收率为每一环节结束后DON的总量与麦芽粉中DON总量之比。从表4可以看出,不同麦芽的DON含量在糖化和发酵过程中变化不大。采用NaHSO3溶液浸泡的脱毒方式可以使成品啤酒中的DON含量明显降低,为对照样品的26%,而添加白地霉的脱毒方式所酿造的啤酒中没有检测到DON。
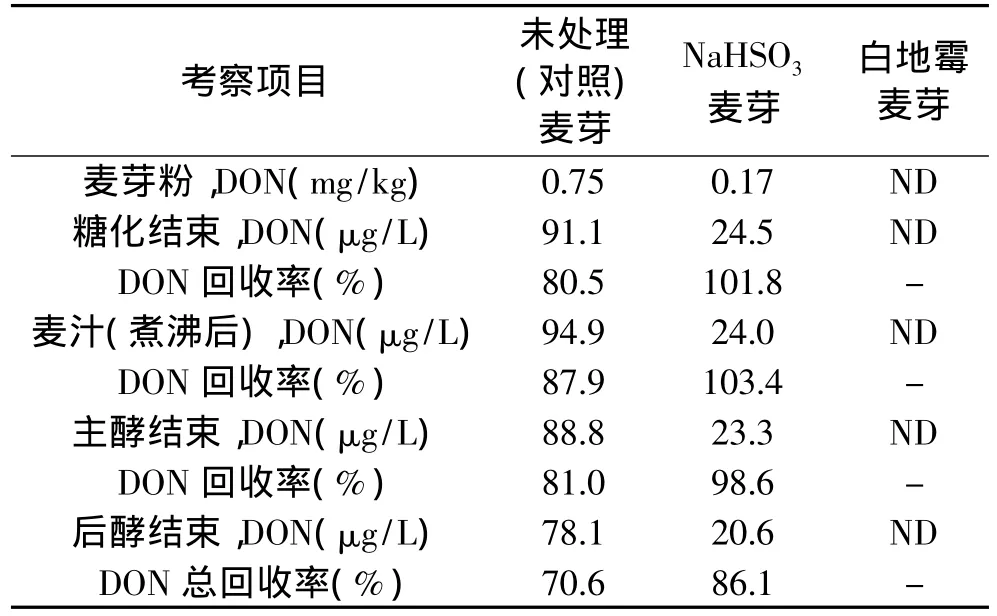
表4 两种脱毒方法所制麦芽在糖化和发酵过程中DON残留情况的比较
2.6 啤酒品质的比较
从表5可以看出,白地霉麦芽啤酒的发酵度和浊度高于对照麦芽啤酒,这应该是由于白地霉麦芽的α-氨基氮高,糖化力强,发酵过程中的酵母代谢旺盛所致。两种处理麦芽所制得啤酒中的色度相对较低,而NaHSO3溶液浸泡脱毒方式所制得啤酒的其他各项指标均较好。采用NaHSO3溶液浸泡和白地霉制麦两种脱毒方式所得啤酒的常规理化指标均符合GB 4927-2008中淡色啤酒的理化要求。

表5 NaHSO3浸泡和添加白地霉两种脱毒方式啤酒理化指标的比较
3 结论
本文以感染镰孢霉属真菌的大麦为原料,对比研究了以NaHSO3溶液浸泡的化学脱毒方法和添加白地霉的微生物脱毒方法的效果。确定了NaHSO3溶液的浓度为10g/L和浸泡时间为50min;在第一次浸麦阶段接种白地霉106个/g大麦。对制麦和酿造过程中DON变化及相关理化指标的比较发现,添加白地霉的脱毒方式脱毒效果较NaHSO3溶液浸泡好,而NaHSO3溶液浸泡方式所制得的麦芽、麦汁和啤酒的指标较好。两种脱毒方式所得麦芽的理化指标均符合QB/T1686-2008中啤酒麦芽的要求,所制得成品啤酒的常规理化指标均符合GB 4927-2008中淡色啤酒的理化要求。采用添加白地霉的脱毒方式可以制备满足啤酒酿造要求的麦芽,同时可以避免化学试剂的残留等潜在影响。通过研究白地霉制麦的机理,进一步优化制麦工艺,获得更高品质的麦芽将不再遥远。
[1]Salas B,Steffenson B J,et al.Fusarium species pathogenic to barley and their associated mycotoxins[J].Plant Dis,1999,83 (7):667-674.
[2]Prom L K,Horsley R D,et al.Development of Fusarium head blight and accumulation of deoxynivanol in barley sampled at different growth stages[J].J Am Soc Brew Chem,1999,57(2): 60-63.
[3]Desjardins A E.Fusarium mycotoxins[M].The American Phytopathological Society,2006:13-19.
[4]陆健,赵海峰.啤酒及其生产原料中的真菌毒素[J].食品工业科技,2006,27(7):185-189.
[5]Schwarz P B,Horsley R D,et al.Quality risks associated with the utilization of Fusarium head blight infected malting barley[J].J Am Soc Brew Chem,2006,64(1):1-7.
[6]Steffenson,B J.Fusarium head blight of barley:research update[Z].Proceedings,Red River Barley Day.American Malting Barley Association,Milwaukee,WI,1996.
[7]Wolf-Hall C E.Mold and mycotoxin problems encountered during malting and brewing[J].Int J Food Microbiol,2007,119 (1-2):89-94.
[8]Faifer G C,Velazco V,Godoy,H M.Adjustment of the conditions required for complete decontamination of T-2 toxin residues with alkaline sodium hypochlorite[J].Environ Contam Toxicol,1994,52:102-108.
[9] Young J C,Blackwell B A,ApSimon J W.Alkaline degradation of the mycotoxin 4-deoxynivalenol[J].Tetrahedron Lett,1986,27:1019-1022.
[10] YoungJC,Trenholm H L,etal.Detoxificationof deoxynivalenol with sodium bisulphate and evaluation of the effects when pure mycotoxin or contaminated corn was treated and given to pigs[J].J Agric Food Chem,1987,35:259-261.
[11]Boivin P,Malanda,M.Improvement of malt quality and safety by adding starter culture during the malting process[J]. MBAA Tech Q,1997,34:96-101.
[12]Lowe D P,Arendt E K.The use and effects of lactic acid bacteria on malting and brewing with their relationships to antifungal activity,mycotoxins and gushing:a review[J].J Inst Brew,2004,110:163-180.
[13]Vaughan A,O'Sullivan T,van Sinderen D.Enhancing the microbiological stability of malt and beer-a review[J].J Inst Brew,2005,111:355-371.
[14]金昭,陆健,蔡国林,孙军勇.HPLC法测定啤酒原料中的脱氧雪腐镰刀菌烯醇毒素[J].啤酒科技,2009(3):44-47.
[15]QB/T 1686-2008.中华人民共和国轻工行业标准:啤酒麦芽[S].
[16]GB/T 4928-2008.中华人民共和国国家标准:啤酒分析方法[S]
.
Study on the control approaches of deoxynivalenol during beer production
CAI Guo-lin1,2,JIN Zhao2,LU Jian1,2,*
(1.Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China; 2.School of Biotechnology,Jiangnan University,Wuxi 214122,China)
The controlapproaches ofdeoxynivalenolduring beerproduction were studied.Two typical representatives of the chemical detoxification method and the microbiological detoxification method,respectively,NaHSO3solution soaking barley before malting and malting with G.candidum,were studied.The results showed that the detoxification effect of latter method was better,and the qualities of malt and beer in the former one were better.However,the qualities of malt and beer produced by above methods could meet the requirements of QB/T 1686-2008 and GB 4927-2008,respectively.
deoxynivalenol;mycotoxin;beer;control
TS262.5
A
1002-0306(2011)07-0203-04
脱氧雪腐镰刀菌烯醇(Deoxynivalenol,DON),又称呕吐毒素,是镰孢霉属真菌的次级代谢产物[1]。DON是毒性较弱的真菌毒素之一,但由于在自然界中广泛存在,已被联合国粮农组织和世界卫生组织确定为最危险的自然发生食品污染物之一。麦芽是大麦在特定的温度和湿度下发芽而制成的,是酿造啤酒的主要原料。DON作为大麦的天然污染物,在大麦的田间生长和储藏过程中都可能产生,并存留在大麦中,在制麦和酿造过程中,残留或重新形成的DON有可能被带进啤酒中[2-4]。在啤酒生产领域,由镰孢霉属真菌感染引起的相关食品安全问题,当前最有效的控制方法就是避免使用此类啤酒大麦。然而,在镰孢霉属真菌感染大麦比较泛滥的年代,这种控制手段将使啤酒大麦的供应趋于紧张;同时,彻底弃用这类大麦也将会给大麦种植区带来严重的经济负担[5]。选育抗镰孢霉属真菌感染的大麦目前正在研究中,但即使抗镰孢霉属真菌感染的大麦品种能够实现,新品种仍需具备符合制麦要求质量的特性,所以,至今仍没有真正的抗镰孢霉属真菌感染的大麦品种面市。因此,通过一些技术手段使一定比例的镰孢霉属真菌感染的大麦得到应用是非常重要的。目前经济、有效地去除大麦DON的物理或化学方法还很少。由于大麦颗粒大小和DON含量的关系不呈正相关,所以适用于小麦、玉米等谷物的剔除干瘪颗粒法是不可靠的,同时由于大麦外壳与内核之间的霉菌和DON含量较高,简单的清洗也不能有效地降低成品麦芽的DON含量[6-7];采用化学试剂可以降解DON或与DON形成无毒结合物,如氨水、臭氧、双氧水和NaHSO3等[8-10],但是,很多酿酒师不能接受这些方法,他们认为这些方法对大麦的质量产生了严重的影响,也不愿意啤酒中残留有化学品或潜在的有害物质。最新的研究认为,DON最佳的脱毒方法是通过筛选有益的微生物,通过竞争的机制抑制镰孢霉属真菌的生长、代谢,从而达到DON脱毒的目的[11-12],但它对麦芽质量的影响仍需进一步的研究。本研究采用NaHSO3溶液浸泡和在浸麦过程中添加白地霉处理镰孢霉属真菌感染的国产啤酒大麦,研究两种不同方法对DON在制麦和酿造过程中变化情况的影响,并综合评价两种脱毒方式对麦芽和啤酒品质的影响,初步探索啤酒生产过程中有效的DON脱毒方式。
2010-05-31 *通讯联系人
蔡国林(1981-),男,工程师,研究方向:酿酒科学与工程。
国家“十一五”支撑计划项目(2007BAK36B01);国家“十一五”支撑重点项目资助(2008BAI63B06);江南大学青年科学基金资助项目(2008LQN016);江苏省“青蓝工程”资助项目。

