大米浓缩蛋白酶法改性与功能性质评价
刘 骥,唐俊妮
(西南民族大学,四川成都610041)
大米浓缩蛋白酶法改性与功能性质评价
刘 骥,唐俊妮*
(西南民族大学,四川成都610041)
以大米浓缩蛋白(rice protein concentrate,RPC)为原料,利用碱性蛋白酶(Alcalase)改性。探讨了在最适条件下,即底物浓度5%、酶与底物比例0.8%、pH8.5、55℃,经过改性制得改性大米浓缩蛋白(modified rice protein concentrate,MRPC)的功能性质:氮溶性指数(NSI)为52.9%、乳化活性(EA=0.101)、乳化稳定性(ES=26.7%)、表面疏水性(2627.6)以及分子量分布。研究表明,经过Alcalase改性后的MRPC与大豆分离蛋白接近,具有作为食品蛋白质添加剂开发的潜力。
大米浓缩蛋白,碱性蛋白酶,改性,功能性质
1 材料与方法
1.1 材料与仪器
大米浓缩蛋白(RPC) 制备方法见参考文献[3],制得RPC溶解性小于0.5%;各类食品级蛋白酶制剂 包括:Neutrase、Alcalase、Protamex和胰蛋白酶Novo,由丹麦Novozymes提供;Papain木瓜蛋白酶 上海聚源生物工程公司;其它试剂 均为国产分析纯。
CS501型超级恒温水浴 上海实验仪器厂; PHS-3C型精密pH计 上海雷磁仪器厂;94-2型定时恒温磁力搅拌器 上海志威电器有限公司;250mL玻璃夹套酶反应器 循环水恒温,定做;ALPHA 1-4型冷冻干燥机 德国制造;722型光栅分光光度计无锡科达智能仪器厂;Waters 2790高效液相色谱仪Waters公司。
1.2 实验方法
1.2.1 实验条件
1.2.1.1 不同蛋白酶对于RPC增溶的效率 各种食品级蛋白酶在说明书推荐最适作用条件下作用于RPC,底物(RPC)浓度为5%,其它条件如下:a.胰蛋白酶Novo:E∶S=2%,pH8.0,45℃;b.Protamex:E∶S= 1%,pH7.0,40℃;c.Neutrase:E∶S=2%,pH7.0,40℃; d.Papain木瓜蛋白酶:E∶S=2%,pH7.0,40℃; e.Alcalase:E∶S=0.8%,pH8.5,40℃。酶反应过程中,用pH-stat法控制反应体系pH在该种酶的最适pH。取上清液通过Folin-酚比色测定不同酶反应时间的蛋白溶出率。
1.2.1.2 Alcalase改性蛋白最适反应条件 参考文献[9]。
1.2.2 MRPC功能性质评价
1.2.2.1 MRPC的溶解性 依据C.V.Morr[10]的方法略做修改:取1g的RPC,加入50mL水,用0.1N HCl或NaOH调节溶液pH至2、3、4、5、6、7、8、9、10、11、12、13,25℃,搅拌1h,定容至100mL,离心(3000r/min,20min),收集上清液,通过Folin-酚比色测定经过不同水解时间后,改性蛋白在不同pH时的溶解性,以及改性蛋白等电点的溶解性。Folin-酚比色法结果用溶出蛋白量(mg/mL)表示。
1.2.2.2 MRPC的乳化活性 采用浊度法,利用乳化界面的面积与浑浊度存在简单相关关系的原理。配制浓度为0.2%的蛋白质溶液(pH的混合磷酸盐缓冲液),取75mL该溶液,加入25mL大豆色拉油,在10000r/min下均质2min,用微量取样器迅速从底部取乳化液10μL稀释于5mL的0.1%SDS溶液中,以0.1%SDS溶液为参比,立即用分光光度计在500nm测定吸光值(A),乳化活性(EA)用吸光值表示。
1.2.2.3 MRPC的乳化稳定性 测定乳化活性后的乳液在80℃水浴中加热30min,冷却至室温,摇匀,按上述方法测定乳化活性(EA80),按下式计算乳化稳定性:乳化稳定性(ES,%)=EA80/EA
1.2.2.4 MRPC的表面疏水性 将水解不同时间的蛋白水解液灭酶,离心,取上清,用0.01mol/L、pH7.0 NaH2PO4-Na2HPO4缓冲液稀释至0.002%、0.004%、0.008%、0.016%,取20μL 1-anilino-8-naphthalene溶液(8mmol/L溶于0.01mol/L磷酸盐缓冲液)加入4mL上述配制的蛋白溶液(注意避光),立即摇匀,在荧光分光光度计中于390nm激发,470nm检测发射荧光强度,用荧光强度对蛋白溶液浓度作图并进行线性回归,以线性回归斜率作为表面疏水性的指标。
1.2.2.5 MRPC的分子量分布 采用高压液相(HPLC)测定MRPC分子量分布:将水解不同时间的蛋白水解液灭酶,离心,取上清,过0.45μm微孔滤膜,进高效凝胶柱Protein KW-803。洗脱液0.05mol/L磷酸盐缓冲液(pH7.0,0.3mol/L NaCl),流速1mL/min,紫外检测波长280nm。
2 结果与讨论
2.1 不同蛋白酶对RPC增溶效率
如图1所示,Trypsin和Alcalase在反应初期和反应5h结束时,RPC溶出量明显大于其它三种酶的作用效果。与Alcalase相比,在Trypsin作用下,反应初期溶出速率较快(曲线斜率较大);在Alcalase作用下的反应末期,溶出速率略大于Trypsin作用下的溶出速率。这种差异可能主要是由于Trypsin酶作用的专一性带来的,在反应初期易被Trypsin作用的敏感键(Arg和Lys的羧基参与形成的肽键)较多,且其水解产物的末端氨基酸侧链带电荷,因而更容易溶出。随着反应的进行,这类肽键大量减少,因此,溶出速率明显下降。然而Alcalase是一种专一性远不如Trypsin的肽链内切酶,在反应末期可能还剩下略多的敏感键(不局限于Arg和Lys的羧基参与形成的肽键),所以在反应末期Alcalase作用下,溶出速率略大(曲线斜率较大)。但是对于为什么反应初期Alcalase作用下,溶出速率低于Trypsin作用下的溶出速率的问题,从敏感键的角度来看,反应初期易被Alcalase作用的敏感键的数量有可能是大于易被Trypsin作用的敏感键数量,分析原因可能如下:蛋白酶法增溶反应中,不能排除如下因素——即使有些肽键被蛋白酶作用断裂,但是蛋白质仍然可能保持在固相中并不溶出。所以,敏感键数量虽多,却并不一定导致蛋白溶出速率更大。这也从一定程度上说明水解度(DH)不适合描述液固两相反应进行的程度。为了工艺上能合理地控制这一条件下的水解反应,并确定反应的程度,在本研究中采用水解时间与蛋白溶出量关系来描述反应进程。
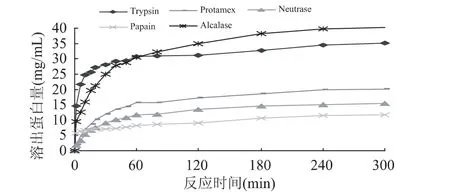
图1 不同蛋白酶的增溶效率
综合考虑生产成本的因素,Alcalase增溶效率较高且价格比Trypsin便宜,从工业应用的角度选择Alcalase更为有利。
2.2 MRPC的溶解性
图2所示,经过短时间Alcalase处理后的RPC,呈现典型的U型溶解曲线,随着时间增加,U形的谷底缓慢消失,最后变为在不同的pH下广泛可溶。图3表明等电点溶解性随酶解时间增加而增加,在反应最初10min时等电点溶解性增加较为显著。随着反应进一步进行至60min,等电点溶解性几乎达到最高。综上可知,仅从RPC增溶程度来看,水解60min可达到提高溶解性的基本要求,不需要水解300min,这样可以降低生产成本。
测定经过60min水解的RPC氮溶性指数(NSI)为52.9%,可见RPC改性后溶解性得到较大的提高(改性前NSI低于0.5%),是一种有应用潜力的食品蛋白添加剂。
2.3 MRPC的乳化活性和乳化稳定性
由图4可见,随着水解时间的增大,乳化活性先增大后减小,然后又略有增大,在维持较长一段时间的平衡后,在水解300min时乳化活性显著增大。与之相反的是,乳化稳定性先减小后增大,随后再减小后增大,在水解300min时乳化稳定性最小。值得注意的是,乳化活性的峰顶正好对应乳化稳定性的峰谷,而乳化活性的峰谷正好对应乳化稳定性的峰顶。这一对应关系较好地说明良好的乳化活性剂未必同时是良好的乳化稳定剂。这是因为具有良好乳化活性的物质应该能快速地扩散到界面上,相应在界面上不会太稳定。而具有良好乳化稳定性的物质,可能在界面上形成一层比较稳定的膜,因此虽然难以快速地扩散并铺展至界面(乳化活性差),但是乳化稳定性较好。

图2 水解时间对RPC溶解性的影响
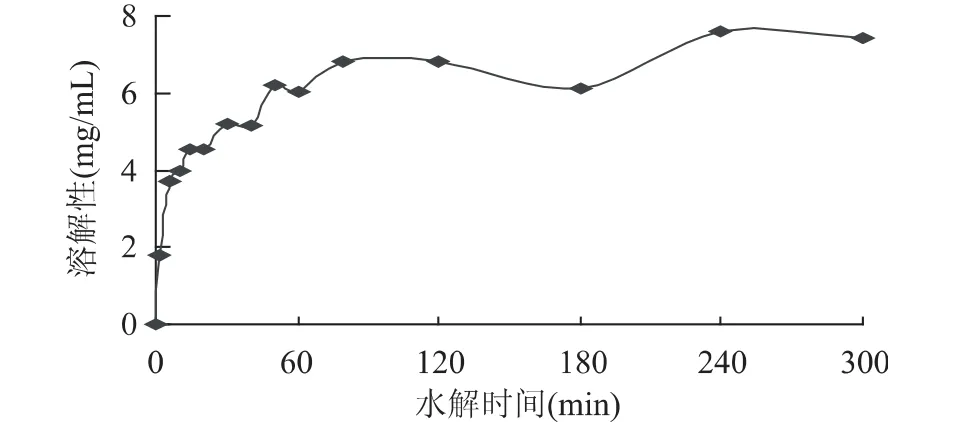
图3 MRPC等电点溶解性

图4 MRPC乳化性和乳化稳定性与水解时间的关系
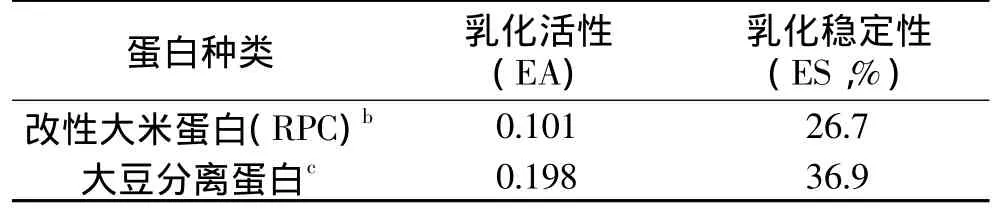
表1 改性RPC与大豆分离蛋白界面特性的比较a
与大豆分离蛋白对比发现:在水解60min时,虽然MRPC乳化活性与乳化稳定性较大豆蛋白略低,这可能与RPC溶解性较低有关;但是仍然不失为一种有开发潜力的廉价的食品乳化剂。
2.4 MRPC的表面疏水性
图5为MRPC的表面疏水性与水解时间的关系,总的看来,表面疏水性随着水解的进行呈下降趋势,但是水解10min后表面疏水性基本不再变化。水解60min时的表面疏水性为2627.6。因此,可以使用蛋白酶水解的方式在一定程度上减小表面疏水性,提高溶解度。

图5 RPC表面疏水性与水解时间的关系
2.5 改性后上清液中RPC的分子量分布
如图6所示,随水解时间增加,MRPC分子量分布有较明显的变化,总的趋势是高分子量部分减少,低分子量部分增大。未水解时(水解0min),根据分子筛分离蛋白原则,分子量分布基本上可分为三个部分,分别为:F1(极高分子量组分)、F3(中等分子量组分)、F4(低分子量组分);水解最初(2min)时,F1消失,同时增加了一个较为明显的F2(高分子量组分)部分,这很可能是F1以及不溶性RPC的水解产物;随着水解的进一步进行,F2减少,相应的F3增加;水解至60min时,F2减少较多,F4部分有所增加;最后在水解至300min时,F3和F4两个部分为水解产物的主要部分。表2说明随着水解的进行,F2部分先增加后减少;F3呈先减少后增加的趋势;F4部分随水解时间的增加不断增加。
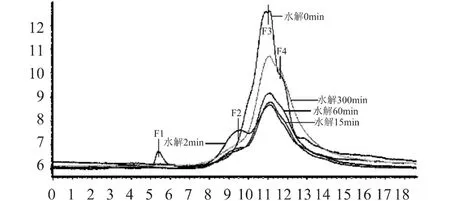
图6 不同水解时间改性后上清液中RPC分子量分布

表2 不同水解时间各部分水解产物的相对含量
3 结论
利用Alcalase在最适条件下,即底物浓度5%、酶与底物比例0.8%、pH8.5、55℃,改性大米浓缩蛋白(RPC),得到产品MRPC氮溶性指数(NSI)为52.9%,乳化活性(EA)为0.101,乳化稳定性(ES,%)为26.7%,与大豆分离蛋白接近;Alcalase作用可以降低大米浓缩蛋白的表面疏水性,同时改进蛋白产品的分子量分布。如果结合其它改性方法,如高压均质及化学改性等方法,可以进一步提高RPC的溶解性;对MRPC的水解产物进一步利用谷氨酰胺转氨酶交联,可以改善RPC分子表面亲水/疏水微区分布,提高乳化活性和乳化稳定性。总之,改性大米浓缩蛋白(RPC)是一种具有开发潜力的功能性食品蛋白质添加剂。
[1]Murata K,Tanaka Y,Kawaguchi T.Comparision between nutritional value of rice and wheat protein[J].Nutrition Reports International,1973,22(6):93-96.
[2]王金华.两种蛋白酶对米渣蛋白的酶促降解作用[J].食品工业科技,2002,23(12):13-15.
[3]刘骥.姚惠源.陈正行.利用米渣为原料制备大米浓缩蛋白[J].食品工业,2004,25(3):11-13.
[4]K C Chang,C C Lee,G Brown.Production and nutritional evaluation of high-protein rice flour[J].J Food Sci,1986,51: 464-467.
[5]Jei-Fu SHAW,Jyh-Rong SHEU.Production of Highmaltose Syrup and flour from Rice by an Enzymatic Method[J]. Biosci Biotech Biochem,1992,56(7):1071-1073.
[6]Frederick F,Shih,Kim W Daigle.Use of Enzyme for the Separation of Protein from Rice Flour[J].Cereal Chem,1997,74 (5):437-441.
[7] Frederick F,Shih,Kim W Daigle.Preparation and characterization of rice protein isolates[J].JAOCS,2000,77(8): 885-889.
[8]刘骥,邓依.高温液化工艺对大米蛋白溶解性的影响[J].河南工业大学学报,2008,29(6):18-21.
[9]刘骥,姚惠源,陈正行.米渣浓缩蛋白酶法增溶机理初探[J].食品科学,2007,28(2):214-219.
[10]C V Morr,B German,J E Kinsella,et al.A collaborative study to develop a standardized food protein solubility procedure[J].J Food Sci,1985,50(6):1715-1718.
[11]黄友如.醇洗豆粕对大豆分离蛋白的提取及其功能性质的影响[D].无锡:江南大学,2003:40-41.
Enzymatic modification of rice protein concentrate and functional properties of the hydrolysates
LIU Ji,TANG Jun-ni*
(School of Life Science and Technology,Southwest University for Nationalities,Chengdu 610041,China)
A potential food protein additive of rice protein concentrate(RPC),was modified by Alcalase at the optimal conditions(concentration of substrate 5%,the ratio of enzyme to substrate 0.8%,pH 8.5,55℃)to improve its functionality in food system.Our research revealed that the functionalities of RPC,including nitrogen solubility index(NSI=52.9%),emulsifying activity(EA=0.101),emulsifying stability(ES=26.7%),surface hydrophobicity (2627.6)and distribution of molecule weight,were promoted by Alcalase hydrolysis and the application of MRPC was extended.
rice protein concentrate(RPC);Alcalase;modification;functionality
TS210.1
A
1002-0306(2011)08-0206-04
虽然大米蛋白的营养价值高于小麦蛋白质[1],但是由于大米中蛋白含量较低(6%~9%),且主要是溶解性较差的谷蛋白和醇溶蛋白,因此从大米中直接提取米浓缩蛋白和分离蛋白成本太高,且蛋白产品的功能性质也较差,无商业价值。研究证实,从米淀粉深加工的副产物米渣中制备大米浓缩或分离蛋白(纯度达90%),具有经济可行性[2-8],但是由于米蛋白在淀粉高温液化工艺过程中,受到长时间的热处理,溶解性能显著降低。为了进一步提高从米渣中制备RPC在食品工业中的应用范围,应对其进行改性。酶反应动力学研究表明,RPC在Alcalase作用下遵守液固两相反应的动力学。碱性蛋白酶(Alcalase)降解不溶性蛋白组分可能符合“Zipper Reaction”模型[9]。因此,用水解度(DH)表征水解反应进程受到限制。为了更好地控制这一条件下的水解反应,并确定反应的程度,在本研究中采用水解时间与蛋白溶出量的关系来描述反应进程。本研究针对从米淀粉深加工副产物中制备的RPC为原料,进行蛋白酶法改性,并对改性产品功能性质进行评价,研究高效廉价的改性方法,为进一步拓宽大米蛋白应用奠定基础。
2010-08-02 *通讯联系人
刘骥(1978-),男,硕士,讲师,研究方向:食品资源开发与利用。
国家自然基金项目(31071515);西南民族大学中央高校基本科研业务费专项(09NZYZJ04)。

