猪传染性胃肠炎病毒Sa 基因的克隆与序列分析
温海燕 (菏泽学院动物科学系 山东 菏泽 274015)
猪传染性胃肠炎病毒Sa 基因的克隆与序列分析
温海燕 (菏泽学院动物科学系 山东 菏泽 274015)
将猪传染性胃肠炎病毒接种ST细胞进行增殖,待细胞出现明显的病变后,将细胞反复冻融3次收获病毒。根据GenBank中已发表的猪传染性胃肠炎病毒S基因的序列,设计合成了1对扩增S基因包含A抗原位点724bp基因片段(Sa)的引物,引物两端分别有HⅠ和dⅢ的酶切位点。以感染细胞提取的病毒RNA为模板,经RT-PCR扩增得到目的片段,然后将其克隆到pMD18-T载体上,经蓝白斑筛选和酶切鉴定选择阳性克隆进行序列测定,构建成功的重组质粒命名为pMD18-T-Sa。用DNAstar软件将其与GenBank上的序列进行同源性比较,结果表明,核苷酸同源性为97%以上,氨基酸同源性为93%以上。根据猪传染性胃肠炎病毒Sa基因核苷酸序列绘制的系统进化树,结果表明,试验株与TH-98株亲缘性最近。
胃肠炎病毒 Sa基因 克隆 序列分析
猪传染性胃肠炎病毒(Transmissible gastroenteritis virus of swine,TGEV)隶属于冠状病毒科冠状病毒属,是引起仔猪病毒性腹泻的重要病原,由其引起的猪传染性胃肠炎(Transmissible gastroenteritis of swine,TGE)是一种急性、高度接触性肠道传染病,是世界动物卫生组织(OIE)法典中B类疫病中必检的猪传染病。不同年龄和品种的猪均易感,尤其以仔猪最易感,2周龄以内的仔猪致死率高达100%,以呕吐、腹泻、脱水、高死亡率为典型症状,成年猪死亡率较低,但是会造成机体消瘦,降低饲料利用率等[1]。目前该病已遍布全世界各国,给养猪业造成了巨大的经济损失。
TGEV由4种结构蛋白和3种非结构蛋白构成,其中S蛋白为大的糖蛋白,形成病毒突起,携带主要的B淋巴细胞抗原决定簇,是唯一能诱导机体产生中和抗体和提供免疫保护作用的结构蛋白;含有宿主细胞氨肽酶受体(PAPN)的识别位点,在决定宿主细胞亲嗜性方面起关键作用[2]。S基因长度为4.35×103bp,包括A、B、C、D4个位点,其中A位点又可分为Aa、Ab、Ac 3种亚位点,A位点暴露于病毒的表面,主要诱导中和抗体的产生,并且不同分离株的A位点保守性强[3,4]。
目前国际上已培育多种弱毒疫苗,有德国的BI-30疫苗株,匈牙利的CKP弱毒株,美国的TGE-Vac株等等,国内哈尔滨兽医研究所也培育成功华株弱毒疫苗[5]。弱毒株大多是经不同方式的人工致弱而成,一般的弱毒疫苗均有一定的残余毒力与致病性,在动物体内增殖诱发免疫力的同时又有毒力返强的可能。而灭活疫苗接种后虽能诱导机体产生比弱毒疫苗更高的循环抗体,但因机体缺乏局部的黏膜免疫,不能有效地抵抗外界野毒的侵袭[6]。鉴于此,本研究对猪传染性胃肠炎病毒Sa基因进行克隆与序列分析,为猪传染性胃肠炎病毒新型基因工程疫苗的研制奠定基础。
1 材料与方法
1.1 试剂与材料 1640培养基(购自美国HyClone公司),新生牛血清购自上海华美公司、Taq DNA聚合酶、TAKARADNA Fragment Purification Kit 、DNA 分子量标准 DL2000、限制性内切酶HⅠ和dⅢ、T4DNA 连接酶、胶回收纯化试剂盒购自大连宝生物工程有限公司,X-gal、IPTG购自Merk 公司、DEPC购自Sigma公司、胰蛋白胨和酵母提取物购自OXOID公司,ST细胞、DH5α、猪传染性胃肠炎病毒均有传染病实验室保存,pMD18-T Vector购自大连宝生物工程有限公司。
1.2 引物的设计与合成 根据GenBank中已发表的基因序列,应用Primer5.0软件自行设计合成了一对能扩增724bp基因片段(包括S基因A抗原位点)的引物,两端分别含有HⅠ和dⅢ的酶切位点及保护性碱基,序列:P1:5’ACGTCA TTG AAC ACA ACG GGT GGT GTC 3’HⅠ;P2:5’ AGCCTG TGG CAT CTA AAA CGT CCG T3’dⅢ。送北京赛百盛基因技术有限公司合成。
1.3 病毒RNA的抽提 将病毒液接种到ST单层细胞上,72h后,待细胞出现明显的细胞病变,将细胞反复冻融三次。10000rpm离心10min,取上清,获得的病毒液参照Trizol(一步法总RNA提取试剂)试剂盒说明书进行操作。
1.4 RT-PCR (1)cDNA的合成参照M-MLV Reverse Transcriptase 说明按下列体系进行反转录:RNA模板1μl,0.5μl下游引物P2,9μl RNase Free H2O,70℃温浴5min结束后立即放在冰上。继续添加4μl 5×M-MLV RTase buffer,2μl 100Mmdtt,2μl dNTP(2.5mM),0.5μl RNase inhibitor,1μl M-MLV RTase,37-42℃温浴1h,得到的反应液可立刻用于PCR反应或-20℃保存备用。(2)Sa基因的PCR扩增。按常规方法进行PCR反应,冰上操作,采用25μl体系,PCR 管中依次加入以下试剂:3μl cDNA模板,2.5μ1 0×PCR Buffer,0.5μl上游引物P1(20pmoL/μl),0.25μl Taq DNA聚合酶(5U/μl),18.75μl ddH2O,优化后的PCR反应条件:94℃ 5min,94℃ 1min、69.4℃ 1min、72℃ 1min进行30个循环,72℃10min。PCR结束后,PCR产物用1%琼脂糖凝胶进行电泳,观察结果。
1.5 目的片段的回收、纯化及序列测定 参照超薄琼脂糖凝胶DNA回收试剂盒说明回收纯化目的片段,然后将其与pMD18-T载体连接,将连接产物转化感受态细胞DH5α,挑斑,扩大培养,抽提重组质粒进行酶切鉴定和PCR鉴定,将鉴定为阳性克隆的菌液送宝生物(大连)有限公司测序。
1.6基因序列分析 利用DNAstar 软件对所测定的基因的核苷酸序列及推导的氨基酸序列进行编辑,并与GenBank中的序列进行同源性比较,然后用ProtScale软件对编码的Sa蛋白的空间进行模拟分析。
2 结果与分析
2.1 TGEV Sa基因的RT-PCR扩增 以TGEV RNA为模板,应用引物P2,反转录合成第一链cDNA,以P1和P2为引物扩增Sa基因,所获得的PCR产物在1.0%琼脂糖凝胶电泳上呈单一条带,大小与预期724bp相符(图1)。
2.2 质粒的双酶切鉴定 重组质粒经HⅠ和dⅢ双酶切后,得到约760bp的插入片段和约2656bp的载体片带,证明所挑取的克隆为正确的重组转化子,将得到的重组质粒命名为pMD18-T-Sa(图2)。
2.3 重组质粒的PCR鉴定 将重组质粒pMD18-T-Sa转化入大肠杆菌DH5α感受态细胞,获得大量转化子。从中随机挑选几个重组子单菌落,用PCR方法进行鉴定,琼脂糖凝胶电泳结果显示,以引物P1和P2扩增出了大小为724bp的特异片段,表明所检测的克隆中均含有外源目的片段的插入(图3)。
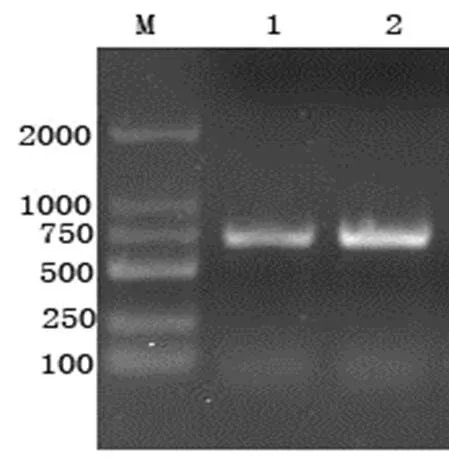
图1 RT-PCR扩增结果
M:DNA标准DL2000;1-2:RT-PCR扩增产物

图2 重组质粒pMD18-T-Sa双酶切鉴定结果
M:DNA标准DL2000;1-2:双酶切鉴定结果

图3 重组质粒pMD18-T-Sa PCR鉴定
M:DNA标准DL2000;1-2:重组质粒pMD18-T-Sa PCR 鉴定
2.4 Sa基因的序列测定及分析 将疑似阳性克隆的菌液送宝生物(大连)公司进行测序,用DNAstar软件将测定序列与GenBank中的序列进行同源性比较,结果表明:试验株Sa基因与GenBank中毒株TH-98、HN2002、SC-Y、133、TS的基因核苷酸同源性分别为99.3%、97.9%、99.6%、97.7%、97.9%,氨基酸同源性分别为97.9%、95.0%、98.8%、93.8%、95.0% (表1),再根据它们的核苷酸序列绘制系统进化树(图4),结果表明:试验株与TH-98毒株在进化上亲缘关系最近,最后利用DNAstar软件对Sa片断的抗原表位进行分析,由图可见第178-231(即S基因A位点)位点抗原性好(图5)。

表1 不同病毒株Sa基因的核苷酸及氨基酸同源性比较(%)
注:*表示同源性为100%
3 讨论
(1)猪传染性胃肠炎病毒感染具有明显的肠嗜性,病毒粒子表面的纤突蛋白(S蛋白)与存在于肠上皮细胞顶膜的氨基肽酶(APN)的结合是感染发生的首要条件,因此,S蛋白是免疫预防和诊断研究的重点。TGEV只有1个血清型,而变异却使TGEV各毒株之间产生了抗原差异。彭树英等[7]将TSX毒株S全基因序列与其他毒株相比,虽在核酸和氨基酸序列上存在一定差异,但形成4个抗原位点的核酸和氨基酸序列并未发生变异,Aa、Ab、Ac位点仍高度保守,并且A位点的缺失可导致S蛋白丧失产生中和抗体的能力。因此,本研究设计引物扩增了一段包含TGEV S基因A位点的片段,为猪传染性胃肠炎基因工程疫苗的研制奠定了良好基础。(2)TGEV病毒通过消化道进入仔猪体内,其靶细胞都是肠绒毛上皮细胞,引起肠绒毛的萎缩脱落,导致动物消化紊乱、酸中毒和脱水。在预防上,如果在肠腔内经常有抗体存在,就可以不断中和猪体摄入的病毒,从而起到保护作用。因此,黏膜免疫是本病特异性免疫应答的主要特征,而肠道黏膜表面SIgA含量的高低直接决定临床疾病的发生和疾病严重程度[8]。针对本病的特点,采用口服免疫是较为理想的预防途径,口服免疫突出的优点是可有效地刺激肠道局部免疫细胞产生SIgA,尤其适应于肠道黏膜传染病,而探索安全、有效、廉价、可以诱导黏膜免疫产生的新型疫苗显得尤为重要。本试验成功地克隆得到了TGEV Sa基因,结合枯草芽孢杆菌基因的功能特点,构建新的跨膜体系,为研制有效诱导黏膜免疫产生的新型疫苗奠定基础。

图4 根据猪传染性胃肠炎病毒不同毒株Sa基因核苷酸序列绘制的系统进化树

图5 利用DNAstar软件对TGEV Sa片断的抗原表位分析
[1] 陈秀强,刘建华.猪传染性胃肠炎[J].福建畜牧兽医,2000, (22) 16: 36-37.
[2] DeLmas B, GeLfi J, Laude H. Antigenic structure of transmissibLe gastroenteritis virus. II. Domains in thepepLomergLycoprotein [J]. JGen Viro,L 1986, 67: 1405-1408.
[3] Sanchez C M,Izeta A,Sanchez-Morgad J M,etaL.Targeted recombination demonstrates that the spike gene of transmissibLe gastroenteritis coronavirus is a determinant of its enterictropism and viruLence[J].J ViroL,1999,73:7607-7618.
[4] Soo J K,Jeong H H,Hyuk M K.PartiaL sequence of the spike gLycoprotein gene of transmissibLe gastroenteritis viruses isoLated in Korea[J]. Veterinary MicrobioLogy, 2003, 94: 195-206.
[5] 吴锋,黄毓茂.猪传染性胃肠炎疫苗的研究进展[J].畜牧与兽医,2009,41(12):97-99.
[6] Mesteck J, Lamm ME, etaL Handbook of mucosaL immunoLogy[M].MucosaL immunogLobuLin, 1994: 79-98.
[7] 彭树英,吕宁,何晓宁,等.猪传染性胃肠炎病毒纤突蛋白全基因的克隆与序列分析[J].西北农林科技大学学报,2007,7(5):1-5.
[8] Brandtzaeg P. Distribution and characteristics of mucosaL immunogLobuiLin-producing ceLLs. In: Handbook of immunoLogy [M]. Boston:Academic Press, 1994: 251-279.
(2011–02–26)
S852.65+9.4
A
1007-1733(2011)04-0001-03

