630例医疗器械不良事件分析报告
王 志
湖南省岳阳市食品药品监督管理局药品不良反应监测中心,湖南岳阳 414000
630例医疗器械不良事件分析报告
王 志
湖南省岳阳市食品药品监督管理局药品不良反应监测中心,湖南岳阳 414000
目的通过对630例上报的医疗器械不良事件进行统计、分析和评价,为更好开展MDAE监测提供借鉴。方法630例有效MDAE使用Excel软件导出并分析数据。结果MDAE报告主要来源于医疗机构,20~40岁女性占总数的35.49%,Ⅲ类报告和严重报告数占总数的80.63%,但非“必填项目”内容缺失较多。结论MDAE报告质量有待提升,通过加强培训、有效监管、强化质量,确保用械安全。
医疗器械不良事件;分析报告
开展医疗器械不良事件(meical device adverse events,MDAE)监测,是依法对已批准上市的医疗器械进行安全性监督和监测、有效减少医疗器械危害的重复发生、保障公众用械安全的重要手段[1]。加强基层MDAE监测,一方面有利于提高医务人员对MDAE的正确认识,规范用械;另一方面可警示器械生产企业对生产的器械追踪监测,改进生产工艺,提高质量,完善《医疗器械使用说明书》;同时,还可为医疗器械监管部门提供依据。我国MDAE监测工作基础薄弱,特别是在基层,此项工作尚处于启动阶段。本研究拟结合岳阳市2010年开展MDAE的工作实际,对630例MDAE进行分析总结,从而找出差距,制定对策与办法,为基层MDAE监测工作提供借鉴。
1 对象与方法
1.1 研究对象
2010年1月1日~11月30日岳阳市所有上报的MDAE报告630份,通过Excel软件导出并分析数据。2010年全市共收集可疑医疗器械不良事件有效报告表共计630份,比去年同期上报数量略有减少,质量有所提高,网上直报注册单位共计50家,其中实际网报报告单位27家。报告涉及全市市直、各县(市)、各区180家医疗机构和医疗器械经营单位。辖区内生产单位未予上报,报告主要来源于医院、诊所、计生服务站、器械经营公司。各县药监局负责辖区内报告的收集和网报工作,市级医疗机构网上直报基本覆盖。2010年岳阳市全市MDAE报告来源于医疗机构588份,占报告总数的93.1%; 来源于经营单位40份,占6.4%;来源于个人3份,占0.5%。
1.2 方法
统计数据为国家“医疗器械不良事件监测系统”中岳阳市2010年1月1日~11月30日收集上报并审核规整后的MDAE报告表630份,使用Excel软件导出并分析数据。
2 结果
2.1 患者年龄和性别情况
630份中报告表涉及男性患者共284人,女性患者347人,通过对630份MDAE报告分析,事件发生年龄主要分布在20~60岁,占总报告数的70.95%, 20岁以下占18.09%,60岁以上占13.17%。男女比例为0.81︰1,女性患者发生率高于男性患者22.18%,其中20~40岁女性患者占报告总数的35.49%,这与育龄妇女使用宫内节育器和使用美瞳、隐形眼镜引起的不良事件有关。
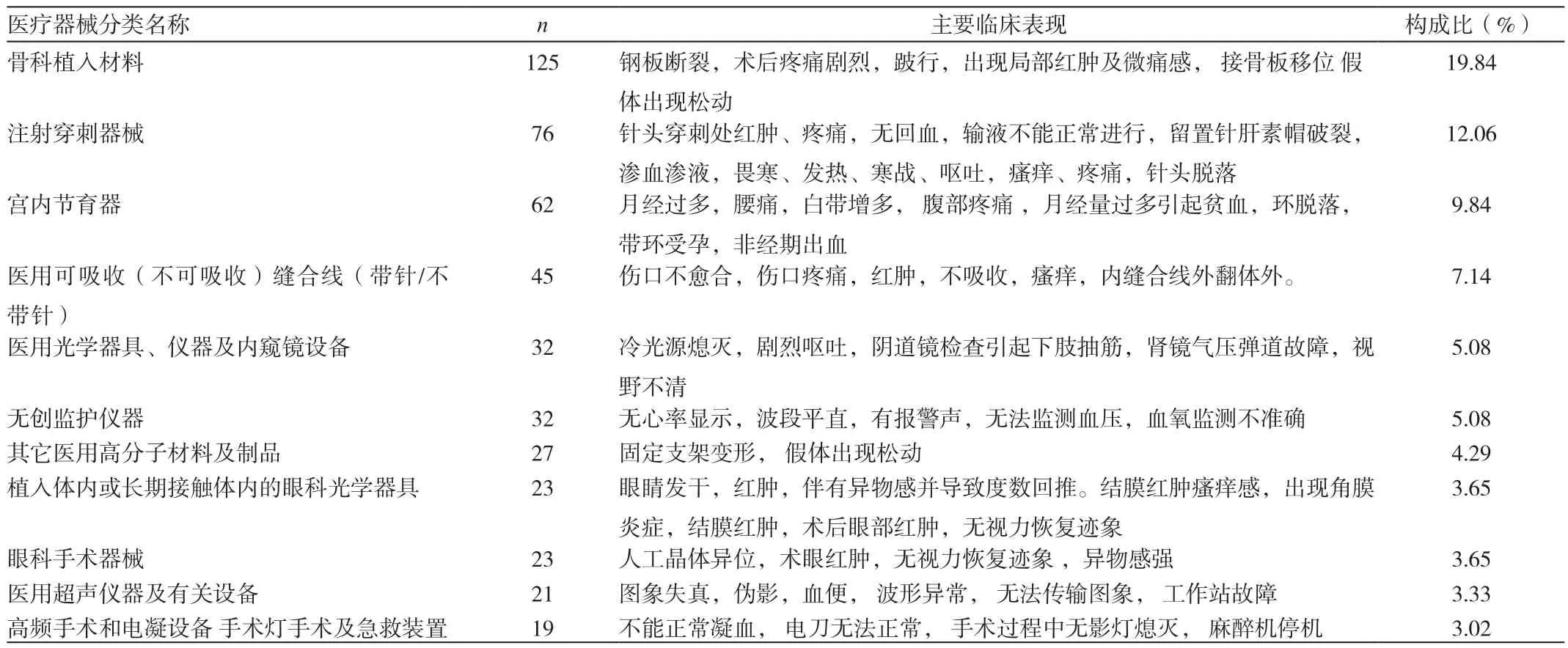
表1 前10位不良事件涉及器械品种、临床表现、例数及构成比
2.2 不良事件涉及器械分类数量及构成比
在上报的630份医疗器械不良事件报告中,共涉及医疗器械品种29类,125种医疗器械,上报数据显示,骨科植入材料、注射穿刺器械、宫内节育器、医用可吸收缝合线(带针/不带针)、医用光学器具、仪器及内窥镜设备、无创监护仪器,分别列报告数量的前5名,报告例数即构成比分别为125例(19.84%);76例(12.06%);62例(9.84%);45例(7.14%);32例(5.08%)。
2.3 MDAE涉及具体品种及临床表现
630份MDAE报告中所涉及病种和临床表现较为复杂,骨科植入材料,注射穿刺器械,宫内节育器,医用可吸收缝合线(带针/不带针),医用光学器具,仪器及内窥镜设备、无创监护仪器不良事件发生比例较高,居前10位涉及器械品种及临床表现、例数及构成比见表1。
2.4 医疗器械不良事件报告中三类和严重的比例
在上报的630份医疗器械不良事例报告中,严重共508份,占总报告数的80.63 %。Ⅰ类报告共51份, 占总报告数的8.09 %;Ⅱ类报告共74份,占总报告数的11.75 %;Ⅲ类报告共505份,占总报告数的80.15%。
2.5 结果分析
2.5.1 MDAE报告事件后果分析 对630份MDAE报告进行分类统计,结果如下:事件后果、上报例数、构成比分别为危及生命50例(7.94%);需要内、外科治疗避免上述永久损伤376例(59.68%);可能导致机体功能永久性损伤82例(13.02%);其他122例(19.36%)。
2.5.2 MDAE报告的质量分析 对2010年网报的630份MDAE报告缺失项进行分析,发现国家“医疗器械不良事件监测系统”中带“*”的科目是必填项目,项目中自带数据库规范,Excel导出后便于数据的统计和使用;但其他非“必填项目”项下内容缺失较多。具体分布和对应数量见图1。
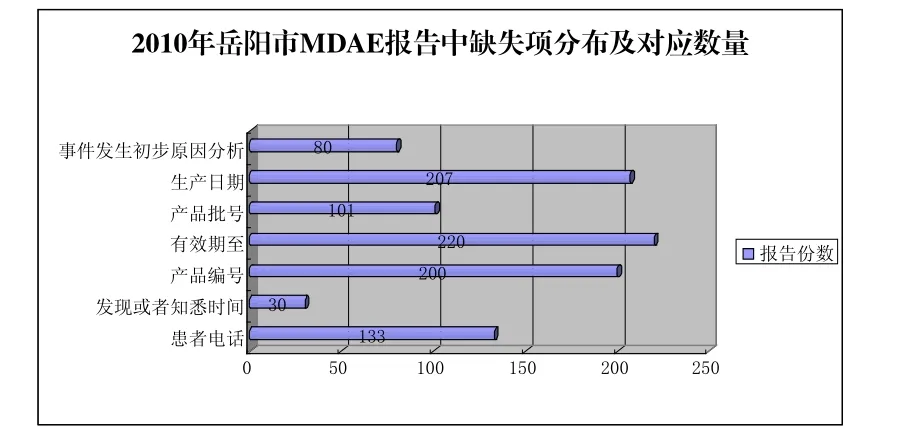
图1 2010年岳阳市MDAE报告中缺失项分布及对应数量分布
3 讨论
3.1 报告数量与来源构成
由于年初工作计划中对Ⅲ类报告和严重报告的上报率有具体要求。故全年报告中2项指标比去年同期有较大的提升,占总报告数的比例均达到了80%以上。从报告数量来看2010年上报数量比去年同期略有下滑,原因在于各县级药监局处于机构改革的交接时期,市级医疗机构上报人员频繁变动引起。但各上报单位通过几年的培训,基本建立了相应的报告制度和规范文件,且配备了专(兼)职人员。今后还需加强和发挥行政部门的督导作用,全面高效的开展该项监测工作。从数据分析中可以看出,MDAE 报告主要来源于医疗机构;而上报单位主要为各县(市)食药监局和市直医疗机构[2]。各县(市)药监局主要负责辖区内器械报告的收集和上报,各县(市)级医院自主上报的积极性尚需提高。市内各区该项工作为区卫生局主管,工作都已开展但积极性不高。
3.2 MDAE事件报告中存在的问题
2010年医疗器械不良事件监测报表质量填写需进一步规范,但主要存在以下4种缺陷情况:①报告来源:各县药监局代为上报部分报告中,单位名称未填写清楚;②联系方式不详细,没有联系电话;③事件陈述:使用时间、目的、依据、情况及出现的不良事件情况、对受害者影响、采取的治疗措施等不详细;④医疗器械情况:生产日期、产品批号、有效期至、产品编号等不够详细。
3.3 建议
加强专业培训,提高监测主动性。一是明确医疗器械不良事件定义。阐明医疗器械不良事件发生的原因,消除思想顾虑和认识上的误区。二是提高认识,让涉械人员充分认识到医疗器械不良事件的危害性、开展此项工作的意义及监测报告的重要性,以提高他们对报告不良事件监测主动性。三是加强可疑医疗器械不良事件报告表的规范填写,尽量减少无效报告和无效信息的数量。各县(市)局应在执法过程中深入基层医疗机构加强对医疗器械不良事件报告监测人员的现场培训,举办医疗器械不良事件监测报告培训班,提高监测人员工作水平[3]。同时加强与卫生主管部门和医疗器械生产、经营、使用单位之间的沟通、协调与合作,赢得他们的理解和支持。要求上报单位做到报表填写完整、规范,具有可追溯性。完整、准确、及时的医疗器械不良事件报告对于医疗器械早期预警工作的有效开展非常重要,医疗器械生产、经营和使用单位对监测工作的认识和态度直接关系到报告的质量。医疗器械不良事件监测中心对可疑医疗器械不良事件报表要逐一审查,分析评价,对填写不规范、有疑问的应及时进行了解、补充和修改,做到既提高医疗器械不良事件上报率,又减少漏报、错报和不规范报告。强化行政监管的效能,2011年要加强国家通报品种、重点监测品种和不良事件发生率较高的品种的监测。各县(市)局应认真做好医疗器械不良事件的分析及处理工作。各医疗器械生产、经营、使用单位要认真根据《岳阳市药品不良反应监测工作目标管理细则》[4],《可疑医疗器械不良事件报告表》[5]的要求于10个工作日内报县(市)局,各局汇总后按月上报岳阳市药品不良反应监测中心。发现突发、群发的死亡或严重伤害事件,应立即报市局和市药品不良反应监测中心。
[1]宓现强,王聪,潘尔顿,等. 我国医疗器械不良事件监测管理中的问题和对策 [J].中国医院管理,2008,28(12):29-30.
[2]董放.医疗器械不良事件监测对医疗器械重新注册的必要性[J].中国药物警戒,2010,7(10):601-602.
[3]刘爱萍,张黎明,闫炜,等.医务工作者报告医疗器械不良事件的影响因素[J].中国医疗器械杂志,2008,32(1):47-49.
[4]孟刚,王兰明,王亚东,等.对我国医疗器械不良事件监测技术体系工作机制和能力的初步调查[J].中国医疗器械信息,2006,12(4):24-26.
[5]邱贵兴.骨科植入物医疗器械不良事件监测[J].中国药物警戒,2005,2(1):23.
F203
B
2095-0616(2011)15-136-02
2011-04-25)

