马铃薯分离蛋白溶液的流变学性能研究
张文会,王玉华,齐 斌
(1.吉林农业大学食品科学与工程学院,吉林长春130118;2.常熟理工学院生物与食品工程学院,江苏常熟215500)
马铃薯分离蛋白溶液的流变学性能研究
张文会1,王玉华1,齐 斌2,﹡
(1.吉林农业大学食品科学与工程学院,吉林长春130118;2.常熟理工学院生物与食品工程学院,江苏常熟215500)
以新鲜马铃薯为原料,用等电点法提取马铃薯分离蛋白,研究了马铃薯分离蛋白的流体力学性能和影响因素。通过实验结果可以得出,马铃薯分离蛋白溶液表现为剪切稀化的流体性能,属于非牛顿流体。马铃薯分离蛋白溶液浓度越高,剪切稀化现象越明显。体系的温度、剪切时间和溶液的配制时间对马铃薯分离蛋白溶液的流体性能都有影响。
马铃薯,分离蛋白,流变性
1 材料与方法
1.1 材料与设备
自制马铃薯分离蛋白[27-28]冻干后4℃保存;HCl、NaOH、Na2SO3、Na2HPO4、NaH2PO4江苏强盛化工有限公司,分析纯。
CR22GⅡ高速冷冻离心机 日本东京日立KoKi有限公司;W201数控恒温水浴锅 上海申顺生物科技有限公司;pH计 瑞士梅特勒-托利多仪器(上海)有限公司;HR1724飞利浦搅拌机 珠海经济特区飞利浦家庭电器有限公司;DHG-9243BS-Ⅲ电热恒温鼓风干燥箱 上海新苗医疗器械制造有限公司;SZ-97自动三重纯水蒸馏器 上海亚荣生化仪器厂;Vortex Genie 2涡旋器 美国Scientific industries Inc;Christ冷冻干燥机 德国Christ公司;MCR301流变仪 奥地利Anton Pear。
1.2 实验方法
1.2.1 马铃薯分离蛋白的成分检测
1.2.1.1 灰分测定 GB/T 5009.4-2003。
1.2.1.2 水分测定 GB/T 5009.3-2003。
1.2.1.3 蛋白质含量测定 GB/T 5009.5-2003。
1.2.1.4 脂肪测定 GB/T 5009.6-2003。
1.2.2 马铃薯分离蛋白流变学特性的测定[29-31]
1.2.2.1 马铃薯分离蛋白溶液浓度对流体性能的影响 用pH=8的磷酸盐缓冲溶液配制浓度为0.05%、0.1%、0.5%和1%的马铃薯分离蛋白溶液,用MCR301流变仪测定不同浓度的马铃薯分离蛋白溶液的表观黏度-剪切速率曲线。测定条件如下:温度:恒温25℃;锥板:直径50mm、1°;测定模式:Flow Curve;以剪切速率为变量,范围为0.1~1000s-1,模式为线性扫描,变量点取30个。
1.2.2.2 温度对马铃薯分离蛋白溶液流体性能的影响 配制浓度为1%的马铃薯分离蛋白溶液,用MCR301流变仪测定马铃薯分离蛋白溶液的表观黏度-温度曲线。测定条件如下:温度:20~80℃;锥板:直径50mm、1°;测定模式:Flow Curve;扫描时间:10min;变量点取50个,剪切速率为500s-1。
1.2.2.3 剪切时间对马铃薯分离蛋白溶液流体性能的影响 配制浓度为1%的马铃薯分离蛋白溶液,测定其表观黏度-剪切时间曲线。测定条件如下:温度:25℃;锥板:直径50mm、1°;测定模式:Flow Curve;以剪切时间为变量,变量点取50个,剪切速率为700s-1,比较其流体性能受剪切时间的影响。
1.2.2.4 配制时间对马铃薯分离蛋白溶液流体性能的影响 配制浓度为1%的马铃薯分离蛋白溶液,分成两份,一份在配制后1h内测定表观黏度-剪切速率曲线,另一份在放置过夜后测量其表观黏度-剪切速率曲线。以剪切速率为变量,范围0.1~1000s-1,扫描模式为线性,变量点取50个,比较其流体性能受配制时间的影响。
2 结果与讨论
2.1 马铃薯分离蛋白成分
制备的马铃薯分离蛋白基本成分见表1。

表1 马铃薯分离蛋白的基本化学组成
2.2 马铃薯分离蛋白溶液浓度对流体性能的影响
描述假塑性和膨胀性的非牛顿流体行为,可以用幂律函数方程来表示:η=Krn-1。其中,η为溶液的表观黏度;r为剪切速率;K为流体稠度,K值越大,流体越粘稠;n为溶液的流动指数,也称非牛顿指数,它可用来判断流体与牛顿型流体的差别程度。n值离整数1越远,则呈非牛顿性越明显。对于牛顿流体,n= 1,此时K相当于牛顿黏度;对于假塑性流体,n<1,表现为表观黏度随剪切速率的增加而下降;对于胀塑性流体,n>1,表现为表观黏度随剪切速率的增加而增加[32]。
经动态流变仪MCR301测得蛋白溶液的黏度随剪切速率的变化,如图1所示。

图1 马铃薯分离蛋白溶液表观黏度-剪切速率曲线
利用仪器自带的分析软件,自动拟合Ostwald幂律方程,计算得出相关参数见表2。

表2 Ostwald幂律方程中各参数值及R2
由图1可以看出,马铃薯分离蛋白溶液的表观黏度随着浓度的增大而升高,不同浓度的马铃薯分离蛋白溶液的黏度都随着剪切速率的增加而减小,都表现为假塑性流体行为。由表2得出,随着浓度的增加,稠度系数K随之升高,表明浓度对马铃薯分离蛋白流动行为的影响增大。流动指数n随着马铃薯分离蛋白溶液浓度的增大而降低,可见浓度越低,n越接近1,马铃薯分离蛋白溶液越接近于牛顿流体。马铃薯分离蛋白溶液浓度越高,n越偏离1,表现为假塑性流体行为越明显。
2.3 温度对马铃薯分离蛋白溶液流体性能的影响
随着温度的升高,高分子间的相互作用力减弱,黏度下降。高分子溶液黏度对温度的依赖性可用阿伦尼乌斯(Arrhenius)方程来表示:η=AeEa/RT,该式反映了溶液黏度随温度的改变而发生的变化,η表示溶液表观黏度;A为黏度常数(Pa·s);R为气体常数,8.32J/(mol·K);T为绝对温度;Ea为活化能(J/ mol),反映了高分子链流动时用于克服分子间作用力的大小。实验测定了不同浓度条件下,马铃薯分离蛋白溶液的表观黏度随温度的升高而变化的曲线,利用分析系统拟合(Arrhenius)方程,结果见图2、图3和表3。
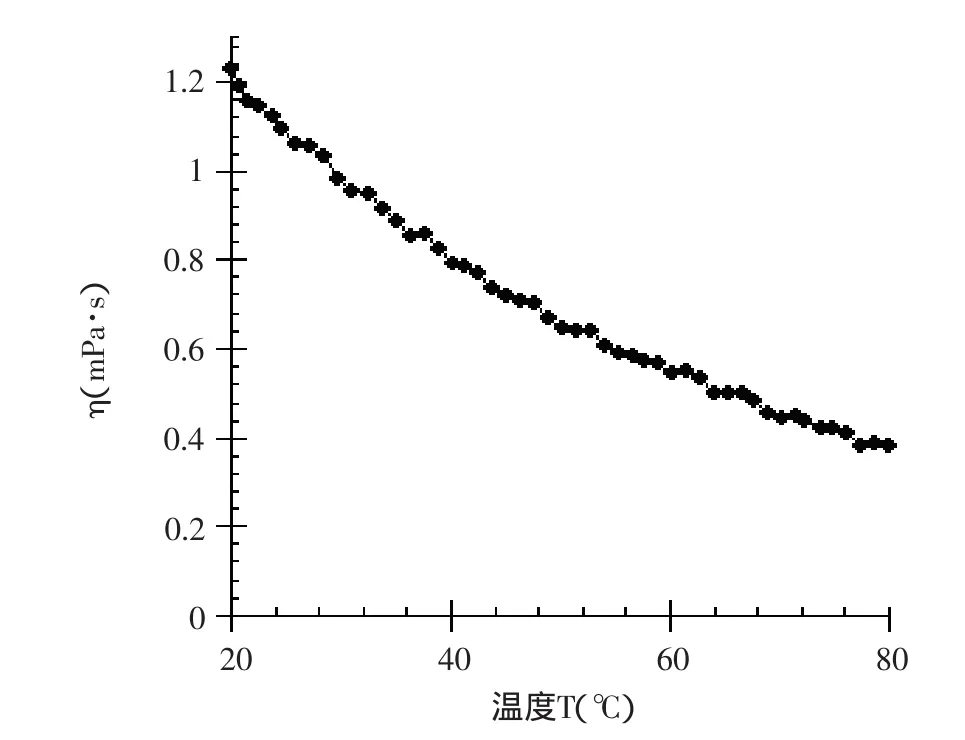
图2 浓度为0.1%的蛋白溶液的黏度-温度曲线
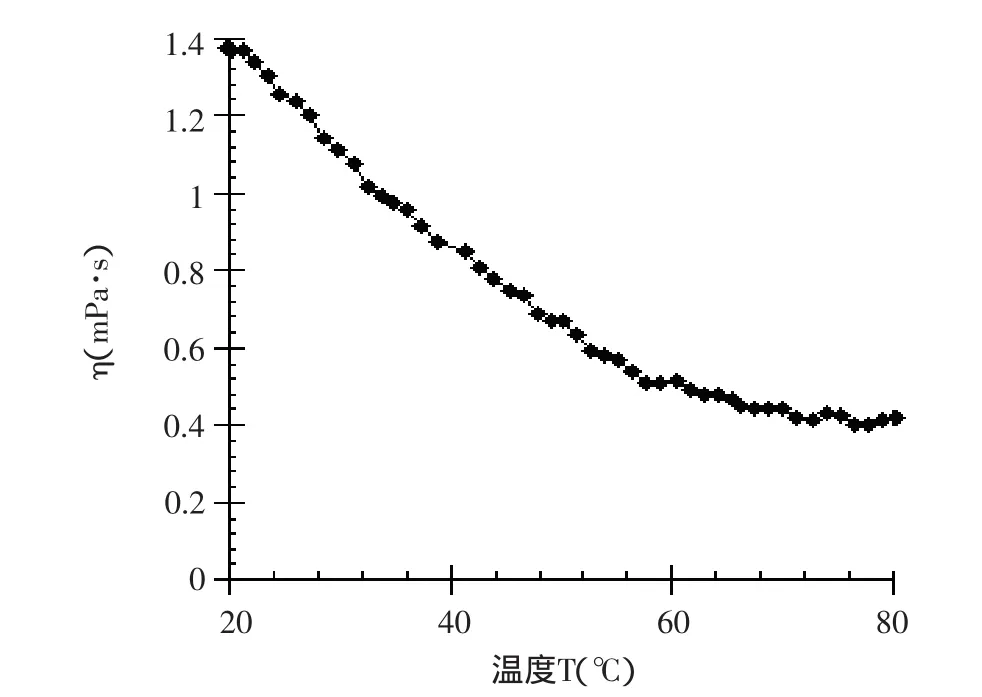
图3 浓度为1%的蛋白溶液的黏度-温度曲线

表3 不同浓度的马铃薯分离蛋白溶液的Arrhenius方程及活化能Ea
由图2、图3和表3可以看出,不同浓度的马铃薯分离蛋白溶液的表观黏度都随着温度的升高而降低,这是由于体系温度的升高而使马铃薯分离蛋白分子链之间作用力减弱,导致黏度的下降。经分析软件拟合(Arrhenius)方程后可以发现,剪切速率为500s-1时,1%的马铃薯分离蛋白溶液的活化能是浓度为0.1%的马铃薯分离蛋白溶液的活化能的4.34倍,由此可见马铃薯分离蛋白溶液浓度越高,活化能越大。当温度升高时,黏度下降也越明显。
2.4 剪切时间对马铃薯分离蛋白溶液流体性能的影响
实验条件下,测定在剪切速率为700s-1时,马铃薯分离蛋白溶液的黏度随着剪切时间的增加而发生的变化,结果见图4。
由图4可以看出,马铃薯蛋白溶液的黏度在较高的剪切速率下,随着剪切时间的延长而逐渐减小,说明在高速、连续的剪切作用下,有可能破坏马铃薯分离蛋白分子间的相互作用。
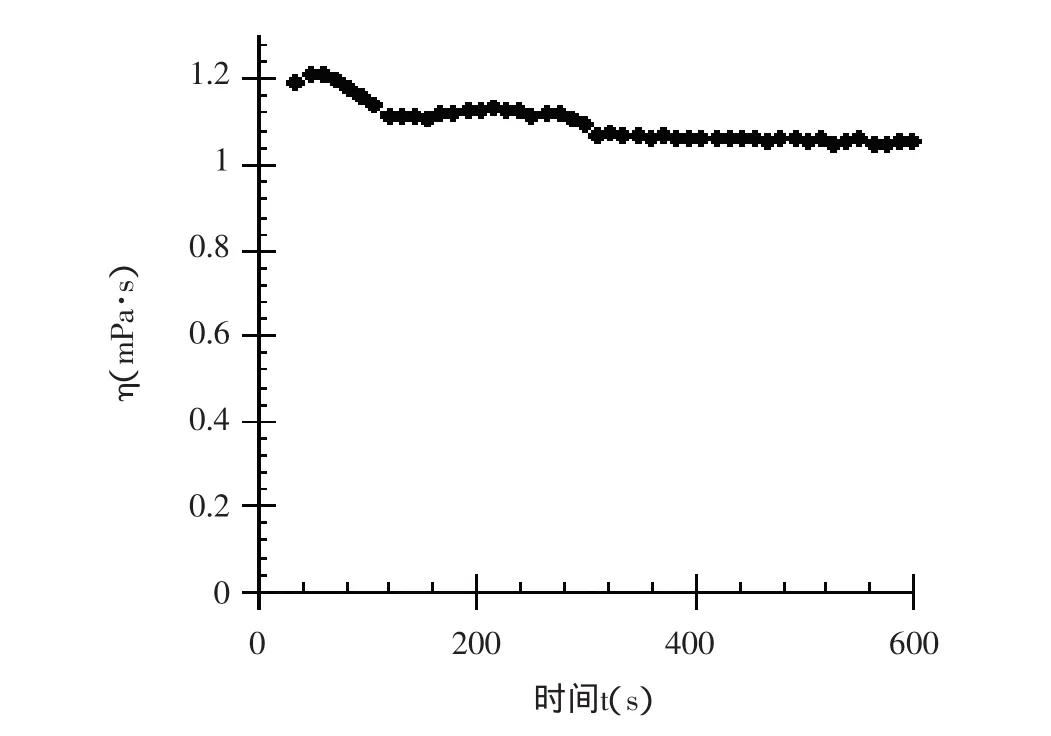
图4 浓度为1%的蛋白溶液的黏度随剪切时间的变化
2.5 配制时间对马铃薯分离蛋白溶液流体性能的影响
配制浓度为1%的马铃薯分离蛋白溶液,分别测定配制后在1h之内和放置过夜后的黏度-剪切速率曲线,观察放置时间对马铃薯分离蛋白溶液的黏度的影响,结果见图5。

图5 放置时间对黏度的影响
由图5可以看出,马铃薯分离蛋白溶液在配制1h之内和放置过夜后,溶液的流体特征趋势没有明显变化,但溶液的表观粘度稍有下降,这说明马铃薯分离蛋白分子间所形成的结构不是很稳定,随着溶液放置时间的增加,蛋白分子水合作用增强,其蛋白-蛋白分子间作用力下降,从而导致了马铃薯分离蛋白溶液表观黏度的下降。
3 结论
通过研究马铃薯分离蛋白的浓度、体系的温度、持续的剪切时间和放置时间等因素,采用MCR流变仪对马铃薯分离蛋白溶液进行研究,得出以下结论。
3.1 马铃薯分离蛋白溶液属于非牛顿流体,表现为:随着剪切速率的增加,溶液表观粘度随之降低。随着蛋白浓度的增加,溶液的黏度也增加。蛋白溶液浓度的升高,其剪切稀化现象也越明显。
3.2 随着体系温度的升高,溶液的表观黏度逐渐降低,这是由于体系温度的升高而使马铃薯分离蛋白分子链之间作用力减弱,导致黏度下降。马铃薯分离蛋白溶液浓度越高,活化能越大,溶液流动时产生的阻力也越大。温度升高时,黏度下降也越明显。
3.3 由于在连续较高的剪切条件下,蛋白分子之间相互作用被破坏,而使蛋白溶液黏度下降。
3.4 蛋白-蛋白分子间所形成的结构不是很稳定,随着溶液放置时间的增加,蛋白分子水合作用增强,其蛋白-蛋白分子间作用力下降,从而导致了马铃薯分离蛋白溶液表观黏度的下降。
[1]Meister E,Thompon N R.Protein quality of precipitate from waste effluent of potato chip processing measured by biological methods[J].Agric Food Chem,1995(245):924-926.
[2]KaIdy M S,Markakis L.Amino acid composition of selected potato varieties[J].Food Sci,1972,37:375.
[3]KALDY M S.Protein yield in various crops as related to protein value[J].Economical Botany,1972,26:142-144.
[4]MARKAKIS P.In:FRIEDMAN M(Ed).Protein nutritional quality of food and feeds.Part II[J].New York:Marcel Dekker Inc,1978:471-487.
[5]KAPOOR A C,DESBOROUGH S L,LI P H.Potato tuber proteins and their nutritional quality[J].Potato Research,1975,18: 469-478.
[6]VAN GELDER,W M J,VONK C R.Aminoacid composition of coagulable protein from tubers of 34 potato varieties and its relationship with protein content[J].Potato Research,1980,23: 427-434.
[7]Knorr D,Kohler G O,Betschart A A.Potato protein concentrates:the influence of various methods of recovery upon yield,compositional and functional characteristics[J].Journal of Food Process&Preservation,1977:235-246.
[8]Strolle E O,Aceto N C,Stabile R J.Recovering useful by products from potato starch factory waste effluents-a feasibility study[J].Food Technology,1980,34:90-95.
[9]Kinsella J E.Functional properties of proteins in foods:a survey[J].CRC Critical Reviews in Food Science and Nutrition, 1976,7:219-280.
[10]Straekvern K O,Løkra S,Olander M A.Food-grade protein from industrial potato starch effluent recovered by an expanded bed adsorption process[J].Journal of Biotechnology,2005,118(S1): 33.
[11]Streakvern K O,Schwarz J G,Wiesenborn D P.Expanded bed adsorption for recovery of patatin from crude potato juice[J]. Bioseparation,1999,7(6):333-345.
[12]Løkra S,HellandM H,Straekvern K O.Chemical characterization and functional properties of a potato protein concentrate prepared by large scale expanded bed adsorption chromatography [J]. Lebensmittel-Wissenschaft Und -Technologie-Food Science and Technology,2008,41:1089-1099.
[13]Holm F,Eriksen S.Emulsifying properties of undenatured potato protein concentrate[J].Journal of Food Technology,1980, 15:71-83.
[14]Knorr D.Effect of recovery methods on yield,quality and functional properties of potato protein concentrates[J].Journal of Food Science,1980,45(5):1183-1186.
[15]Zwijnenberg H J,Kemperman A J B,Boerrigter M E,et al. Native protein recovery from potato fruit juice by ultrafiltration [J].Desalination,2002,144:331-334.
[16]van Koningsveld,G A,Walstra P,et al.Effects of protein composition and enzymatic activity on formation and properties of potato protein stabilized emulsions[J].Journal of Agricultural and Food Chemistry,2006,54(17):6419-6427.
[17]Ralet M C,Gueguen J.Fractionation of potato proteins: solubility,Thermal coagulation and emulsifying properties[J]. Lebensmittel-Wissenschaft Und-Technologie-Food Science and Technology,2000,33(5):380-387.
[18]David Racausen,Murry Foote.A major soluble glycoprotein of potato tubers[J].Journal of Food Biochemistry,1980,4:43-52.
[19]AndreM POTS,Harmen H J,DE JONGH,et al.Heatinduced conformational changes of patatin,the major potato tuber protein[J].Eur J Biochem,1998,252:66-272.
[20] AndreM Pots, Harry Gruppen,et al. Isolation and Characterization of Patatin Isoforms[J].Agric Food Chem,1999, 47:4587-4592.
[21]Claudia Tonón,Gustavo Daleo,Claudia Oliva.An acidic β-1,3 glucanase from potato tubers appears to be pata tin[J].Plant Physiol Biochem,2001,39:849-854.
[22]Neelam Sharma,Hope A Gruszewski,et al.Purification of an isoform of patatin with antimicrobial activity against Phytophthora infestans[J].Plant Physiology and Biochemistry, 2004,42:647-655.
[23]陈克复,卢晓江,金醇哲,等.食品流变学及其测量[M].北京:轻工业出版社,1989:1-4.
[24]Tatiana D.Dimitrova Fernando Leal-Calderon.Rheological properties of highly concentrated protein stabilized emulsions[J]. Advances in Colloid and Interface Science,2004:108-109,49-61.
[25]周宇英,唐伟强.食品流变特性的研究进展[J].粮油加工与食品机械,2001(8):7-9.
[26]史琦云.流体食品粘度的测定与分析[J].食品科学,1996,17 (8):7-11.
[27]Mu T-H,Tan S-S,Xue Y-L.The amino acid composition, solubility and emulsifying properties of sweet potato protein[J]. Journal of Food Chemistry,2009,112:1002-1005.
[28]朴金苗,都凤华,齐斌.马铃薯分离蛋白的溶解性和乳化性研究[J].食品科学,2009,30(17):91-94.
[29]汪海波,徐群英,舒静.水溶性米糠蛋白的溶液流变学性能研究[J].食品科学,2008,29(3):131-135.
[30]汪海波,徐群英,汪芳安.低酯果胶的流变学性能研究[J].农业工程学报,2006(11):223-227.
[31]田少君,雷继鹏,孙阿鑫.大豆蛋白的流变特性及其粘度的数学模型研究[J].中国粮油学报,2005,20(2):53-56.
[32]徐佩弦.高聚物流变学及其应用[M].北京:化学工业出版社,2003,7:49-52.
Study on rheological behavior of potato protein isolates solution
ZHANG Wen-hui1,WANG Yu-hua1,QI Bin2,*
(1.College of Food Science and Engineering,Jilin Agriculture University,Changchun 130118,China;2.College of Biology and Food Engineering,Changshu Institute of Technology,Changshu 215500,China)
Using fresh potato to obtain potato protein isolate(PPI)by isoelectric precipitation.The property of hydrodynamics and influential factor on PPI solution were studied.The results indicated that the PPI solution displays shear-thinning behavior which belonged to non-Newtonian fluid.The shear-thinning behavior was more obviously with the increased of concentration of PPI solution.The rheological behavior of PPI was influenced by the temperature and shear time of the system and the time of preparing solutions.
potato;protein isolates;rheological behavior
TS215
A
1002-0306(2011)10-0194-04
马铃薯蛋白质可明显促进动物的生长发育,其食物利用率、生物价、蛋白质净利用率、蛋白质功效比值等评价指标均与酪蛋白接近。维持人体氮平衡的实验证明,马铃薯蛋白优于其它作物蛋白[1]。马铃薯蛋白质的必需氨基酸含量占氨基酸总量的47.9%,其必需氨基酸含量与鸡蛋蛋白(49.7%)相当,明显高于FAO/WHO的标准蛋白(36.0%)[2]。因此,马铃薯蛋白是天然的优良蛋白,营养价值优于酪蛋白,可加以开发和利用[3-6]。近年来有关马铃薯分离蛋白的研究主要集中在提取、分离[7-12]和功能性质上,天然马铃薯蛋白浓缩物有良好的溶解性、起泡性和乳化性[13-17]。国外对于马铃薯蛋白的分离纯化方面研究也较多[18-22]。但对马铃薯分离蛋白的流变性质研究国内外还未见报道。流变性,可以简单的理解为,物体在力学作用下发生的形变,在流动过程中表现出来的性质[23]。理解和掌握流体行为,是生产、运输、储存和应用中的一个重要问题[24]。由于食品物料的流变性质与食品的质地稳定性和加工工艺等有重要的关系,所以通过对食品流变性的研究,可以了解食品的组分、内部结构和分子形态等,能为产品配方加工工艺、设备选型及质量检测等提供方便和依据[25]。随着食品工业的发展,人们对食品流变学的兴趣也日益增长,食品流变学的研究愈来愈广泛,目前食品流变学已发展成为一门食品工业不可缺少的边缘学科,因此,流变特性的检测已成为食品加工及生产过程中必不可少的检测手段之一[26]。本文主要研究了马铃薯分离蛋白的流变性随着分离蛋白的浓度、体系温度、剪切速率和剪切时间的变化。
2010-08-24 *通讯联系人
张文会(1983-),男,硕士研究生,研究方向:食品微生物与功能性食品。

