干扰素诱导蛋白IFIT1的克隆与原核可溶性表达*
李洪涛,粟永萍△,徐建明,冉新泽,王军平,艾国平,程天民
(1.第三军医大学军事预防医学院全军复合伤研究所,创伤、烧伤与复合伤国家重点实验室,重庆400038;2.Dept.of Molecular and Cellular Biology,Baylor College of Medicine,77030 Houston USA)
干扰素诱导蛋白IFIT1的克隆与原核可溶性表达*
李洪涛1,粟永萍1△,徐建明2,冉新泽1,王军平1,艾国平1,程天民1
(1.第三军医大学军事预防医学院全军复合伤研究所,创伤、烧伤与复合伤国家重点实验室,重庆400038;2.Dept.of Molecular and Cellular Biology,Baylor College of Medicine,77030 Houston USA)
目的 研究干扰素诱导蛋白IFIT1的原核可溶性表达。方法 通过逆转录聚合酶链反应(RT-PCR)获得IFIT1编码序列,克隆入原核表达载体,电穿孔转化大肠杆菌,筛选阳性克隆,诱导细菌表达,蛋白凝胶电泳观察。结果 构建的原核表达平台实现了较丰富的麦芽糖结合蛋白融合IFIT1(MBP-IFIT1)可溶性表达。结论 MBP-IFIT1的原核可溶性表达为后续IFIT1蛋白结合分析及免疫分析提供了材料及方法学基础。
创伤和损伤;细胞应激;重组;原核表达
IFIT1(interferon induced factor with tetratricopeptide repeats-1,IFIT1)受Ⅰ型干扰素诱导迅速合成,且含有多个串联排列的 TPR模体(tetratricopeptide repeats motif),所以得名[1]。IFIT1分子中的 TPR模体为34个简并氨基酸构成的重复结构,具有介导蛋白分子间结合及蛋白复合物组配的作用[2]。相关的研究报道 IFIT1借其 TPR模体,通过结合细胞内靶蛋白,发挥生物效应[3-6];作者前期的酵母双杂交实验,发现IFIT1可能与糖皮质激素受体(glucocorticoid receptor,GR)结合,参与调节 GR的转录活性[7];为进一步研究 IFIT1的功能,本文进行了鼠源细胞株 IFIT1 cDNA全长编码序列的克隆、其原核表达载体的构建及重组融合蛋白可溶性原核表达的实验,报道如下。
1 材料与方法
1.1 细胞株、菌株与质粒 小鼠腹腔巨噬细胞株 RAW264.7(ATCC TIB-71)、菌株 E.coli BL21(DE3)、原核表达质粒p GEX-4T-1为作者所保存,原核表达质粒pMAL-C2X为New England Biolab(NEB)公司产品。
1.2 试剂 细胞固体培养基、标准胎牛血清购自 Hyclone公司,细菌脂多糖(lipopolysaccharide,LPS)、IPTG购自 Sigma公司,RNA抽提试剂(Tripure isolation reagent)购自Roche,逆转录-聚合酶链反应(RT-PCR)试剂盒 ——RNA LA PCR kit、限制性内切酶 EcoRⅠ、BamHⅠ及 T4连接酶购自 Takara公司,质粒抽提试剂盒、PCR产物纯化试剂盒、胶回收试剂盒购自O-mega Bio-tech,引物委托 Takara公司合成,酵母提取物和胰蛋白胨为Oxiod公司产品。
1.3 自鼠源性细胞株逆转录扩增IFIT1编码序列 DMEM培养基中加入10%胎牛血清,5%CO2,37℃培养RAW264.7细胞,至80%细胞汇合时,向培养基中加入LPS,至终浓度0.1 μg/mL,以诱导IFIT1的转录[10],刺激6 h后收获细胞。提取细胞总RNA,即向培养细胞中直接加入RNA抽提试剂,裂解细胞,加入定量氯仿,漩涡振荡,室温静置,12 000 r/min离心15min,取上层水相,加入定量异丙醇,低温12 000 r/min离心15min,收集沉淀的RNA,75%的乙醇洗涤,50μL RNase free dH2O溶解RNA,在紫外分光光度仪测RNA浓度。按Takara RNA PCR kit的说明,进行 RT-PCR操作,先进行逆转录反应。反应体系:4μL MgCl2,2μL 10×RNA buffer,8.5μL RNase free dH2O,2μL dNTP Mixture,0.5μL RNase Inhibitor,1μL AMV reverse transcriptase,1μL Oligo dT(15 mers),0.1μg total RNA,20μL total volume。反应条件:30 ℃10min,50℃50min,99℃5min。然后,逆转录产物与6μL MgCl2,8μL 10×PCR buffer,0.5μL Takara pyrobest Taq,1.0μM IFIT1引物,61.5μL dH2O混合,组成100μL反应体系。进行后续PCR反应,扩增IFIT1全长编码序列(coding sequence,CDS)。PCR反应条件:94℃2min(1个循环),94℃30 s,63℃50 s,72℃1.5min(35个循环)。0.8%的琼脂糖凝胶水平电泳显示实验结果。IFIT1引物序列:引物1:5′CGG AAT TCA TGG GAG AGA ATG CTG ATG GTG AC3′;引物 2:5′CGG GAT CCT CAG AAT GCA GGG TTC ATT TCC CC3′(斜体部分为引入的侧翼碱基,下划线部分为引入的限制性内切酶 EcoRⅠ、BamHⅠ位点)。
1.4 小鼠IFIT1克隆入原核表达载体pMAL-C2X 参照O-mega Bio-tech的操作流程,纯化 PCR产物。扩增、抽提pMAL-C2X质粒。对两者同时进行 EcoRⅠ、BamHⅠ的双酶切反应。产物以0.8%的琼脂糖凝胶电泳回收IFIT1及载体片断。按1∶3的摩尔比混合载体片断与插入片断,以 T4连接酶进行连接反应。连接产物经乙醇沉淀,去除溶液中离子。然后电穿孔,转化大肠杆菌BL21(DE3)。转化菌株接种于氨苄青霉素抗性的培养板,次日挑取克隆,混悬于10μL双蒸水中,取1μL菌液,以其煮沸裂解后产生的质粒DNA为模板,掺入引物1和引物2进行 PCR反应,筛选重组子转化克隆。扩增、提取阳性克隆的质粒DNA,进行 EcoRⅠ、BamHⅠ的酶切鉴定,并进行插入片段的测序。
1.5 阳性克隆的诱导表达 配制氨苄青霉素抗性的LB液体培养基,并加入葡萄糖至终浓度0.2%,抑制背景表达。挑取pMAL-C2X-IFIT1转化的BL21(DE3)单菌落,37℃250 r/min振荡培养过夜。取1 mL培养物,接种于50 mL培养基中,37℃250 r/min振荡培养8 h,至OD6000.4时,向培养物中加入IPTG至终浓度0.3 mM,30℃250 r/min继续振荡培养6 h,诱导融合蛋白的表达。随即4℃5 000 g离心10min收集菌体,PBS洗涤,超声破碎,进行 SDS-PAGE分析。
2 结 果
2.1 IFIT1的扩增、载体构建及阳性克隆的鉴定 小鼠IFIT1全长编码序列自起始密码子ATG至终止密码子U GA,共1 392 bp。提取经LPS诱导的小鼠腹腔巨噬细胞株RAW264.7的总 RNA,采用具有3′→5′外切酶活性的耐热DNA聚合酶,进行高保真的 RT-PCR反应,得到了全长编码序列产物(图1)。通过限制性酶切→连接反应,IFIT1 CDS定向克隆于原核融合表达质粒pMAL-C2X中,形成原核融合表达载体pMALC2X-IFIT1(图2),其中担体——麦芽糖结合蛋白(maltose binding protein,MBP)融合于IFIT1分子的N端。连接产物直接转化至 E.coli BL21(DE3),挑取7个单菌落,以引物1、引物2进行PCR反应,筛选出2个重组质粒转化阳性克隆(图3)。将其扩增,抽提质粒,进一步以限制性酶切反应鉴定(图4),单酶切反应产物较pMAL-C2X空载体(6.64 kb)增加了约1 kb,双酶切反应产物出现2个条带,分别对应线性化pMAL-C2X空载体及插入片断IFIT1 CDS,初步证实成功构建了IFIT1融合表达质粒pMAL-C2X-IFIT1。进一步对重组质粒进行硷基测序,结果与 Genebank数据库中小鼠 IFIT1 cDNA的序列信息100%吻合。
2.2 重组蛋白的原核可溶性表达 通过观察诱导时间(2~6 h),诱导温度(25 ℃~37 ℃),IPTG浓度(0.05~1 mM);等不同的诱导条件下融合蛋白MBP-IFIT1的表达情况,发现0.3 mM的IPTG,30℃诱导6 h可获得较好的可溶性表达(图5),此时可溶性表达与细菌包涵体内折叠蛋白(图5)比例接近1∶1。继续降低温度及 IPTG浓度并不增加可溶性蛋白的比例,反而降低目的蛋白MBP-IFIT1总的表达量,进而降低可溶性蛋白的产量。
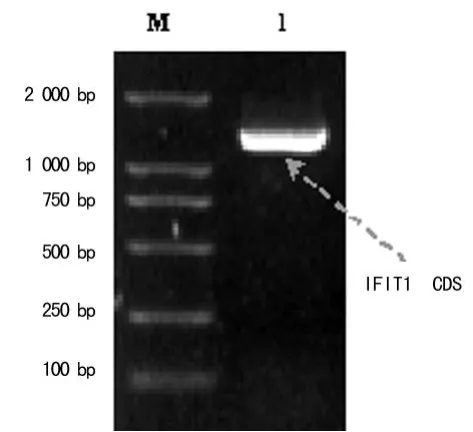
图1 小鼠腹腔巨噬细胞RT-PCR的琼脂糖凝胶电泳结果

图2 原核表达载体pMAL-C2X-IFIT1的质粒结构图
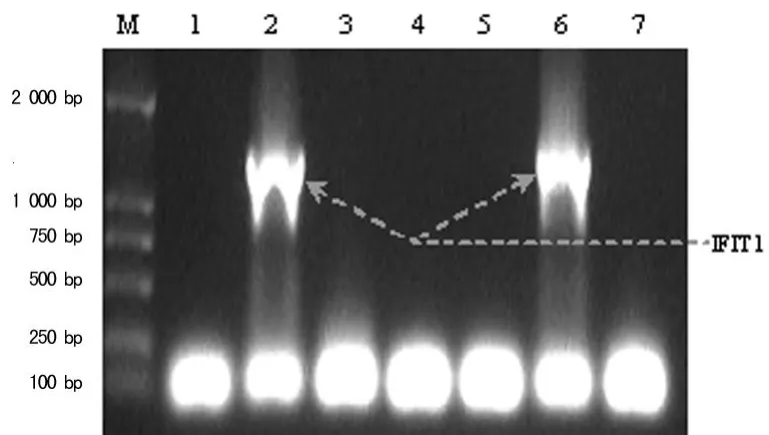
图3 琼脂糖凝胶电泳显示菌落PCR方法筛选阳性转化克隆的结果
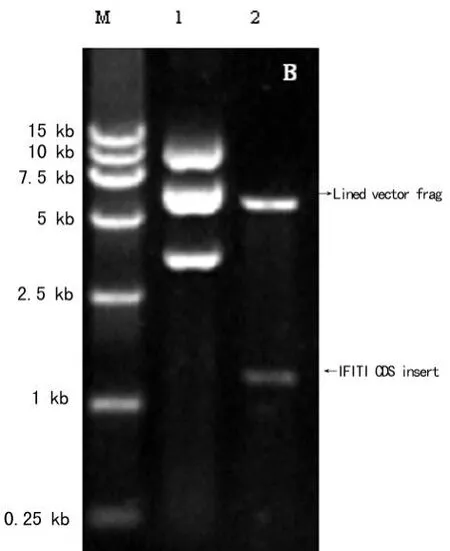
图4 转化阳性克隆的限制性酶切产物的琼脂糖凝胶电泳结果
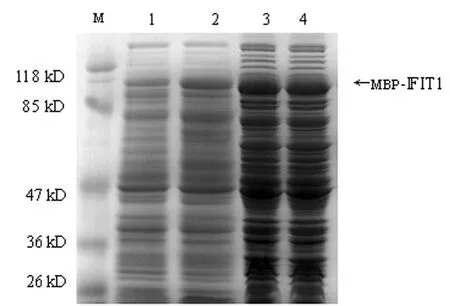
图5 蛋白凝胶电泳分析转化大肠杆菌中MBP-IFIT1的表达情况
3 讨 论
相关的研究报道IFIT1因病毒感染及旁分泌的干扰素的诱导而表达,进而结合并干扰了真核细胞翻译起始因子的活性,因而抑制病毒颗粒的组装,是真核细胞一种内在的抵御病毒感染的途径[3-4]。但 IFIT1并非只因病毒而激活,Wathelet等[5]以细菌LPS刺激3T3细胞,也获得了 IFIT1的迅速高表达。白细胞介素-1、视黄酸同样可诱导细胞高表达 IFIT1[6]。而本文观察到实验性严重创伤早期 IFIT1的表达也迅速升高[8]。在烧伤早期小鼠中,IFIT1在肝、脾、肺脏等的转录迅速激活,mRNA及蛋白分子水平在正常对照小鼠很低或不能检出,伤后则明显提高,并持续数天至1周;颅脑冲击伤小鼠伤后早期的多脏器观察中,也发现IFIT1 mRNA水平的类似变化。严重创伤继发炎症反应,细胞暴露于高炎性介质刺激下,IFIT1此时的迅速表达,表明高炎性介质应激,也可诱导 IFIT1表达[9-14]。预示IFIT1不仅是病毒感染应激分子;除抵御病毒感染机制外,该分子可能具有其他的功能。
为进行IFIT1的功能研究,作者首先希望得到IFIT1的可溶性分子,籍此进行亲和分子的筛选,借IFIT1结合靶蛋白功能的指向,寻找进一步功能研究的线索。对于细菌而言,重组质粒编码蛋白为外源性蛋白,虽然在细菌内能正确编码,但能否正确折叠而形成可溶性功能蛋白,常不能事先预料,一旦不能正确形成二、三级结构,疏水基团外露即会凝聚沉淀,而形成细菌包涵体。作者前期构建了以 GST作为担体的原核融合表达质粒p GEX-4T-IFIT1,尽管实现了重组融合蛋白 GST-IFIT1的原核表达,但几乎均为包涵体蛋白(结果未列出),没有可溶性蛋白出现,无法进行后续实验的研究。随后改用MBP作为担体,构建原核融合表达质粒pMAL-C2X-IFIT1,结果表明原核表达的重组蛋白MBP-IFIT1,不仅有可溶性表达,而且表达量丰富,接近总量的50%,因此,利于亲和纯化,用作抗原,制备针对天然蛋白的高特异性抗体[15],进行 IFIT1的免疫分析等。进一步以其为诱饵,体外筛选结合靶分子,根据结合靶分子探明IFIT1的功能。
重组分子——麦芽糖结合蛋白融合 IFIT1(MBP-IFIT1)在适当诱导条件下可实现较丰富的原核可溶性表达,为进一步的蛋白结合分析及免疫分析提供了材料及方法学基础。
[1]Wathelet M,Moutschen S,Defilippi P,et al.Molecular cloning,full-length sequence and preliminary characterization of a 56-kDa protein induced by human interferons[J].Eur J Biochem,1986,155(1):11-17.
[2]Sikorski RS,Boguski MS,Goebl M,et al.A repeating amino acid motif in CDC23 defines a family of proteins and a new relationship among genes required for mitosis and RNA synthesis[J].Cell,1990,60:307-317.
[3]Sen GC.Novel functions of interferon-induced proteins[J].Semin Cancer Biol,2000,10(2):93-101.
[4]Smith JB,Herschman HR.The glucocorticoid attenuated response genesGARG-16,GARG-39,andGARG-49/IRG2 encode inducible proteins containing multiple tetratricopeptide repeat domains[J].Arch Biochem Biophys,1996,330(2):290-300.
[5]Wathelet MG,Clauss IM,Nols CB,et al.New inducers revealed by the promoter sequence analysis of two interferon-activated human genes[J].Eur J Biochem,1987,169(2):313-321.
[6]Ye S,Pang H,Gu YY,et al.Protein interaction for an interferon-inducible systemic lupus associated gene,IFIT1[J].Rheumatology,2003,42(10):1155-1163.
[7]Li SR,Su YP,Liu XH,et al.The interferon induced protein P56 interact with glucocorticoid receptor and regulate GR transcriptional activity[J].Prog Biochem Biophys,2004,31(9):791-795.
[8]李洪涛,粟永萍,徐建明,等.烧伤小鼠 IFIT1表达的初步观察[J].第三军医大学学报,2006,28(22):2250-2252.
[9]李淑蓉,粟永萍,邓正阳,等.烧伤小鼠早期 P56与 IFN mRNA表达变化及麻醉或 KPV对其表达的影响[J].第三军医大学学报,2008,30(5):367-369.
[10]邓正阳,李淑蓉,王蒙,等.人 P56蛋白及其各种缺失突变体酵母表达质粒的构建及鉴定[J].第三军医大学学报,2004,26(7):561-564.
[11]任泂,粟永萍,李洪涛,等.JAB1表达下调对LPS诱导炎性因子 TNF-α和IL-26的影响[J].第三军医大学学报,2007,29(16):1552-1554.
[12]陆建华,陶军,叶建宁,等.颈交感神经阻滞对放烧复合伤小鼠HPA轴的调节及相关机制研究[J].第三军医大学学报,2006,28(21):2111-2113.
[13]王明海,粟永萍,程天民,等.糖皮质激素受体基因RNA干扰的生物学效应研究[J].第三军医大学学报,2004,26(20):1795-1798.
[14]Li HT,Su YP,Cheng TM,et al.The interaction between interferon-induced protein with tetratricopeptide repeats-1 and eukaryotic elongation factor-1A[J].Mol Cell Biochem,2010,337:101-110.
[15]郭晓姝,李洪涛,方海立,等.小鼠 IFIT1多克隆抗体的制备[J].第三军医大学学报,2007,29(15):1462-1464.
Cloning and soluble prokaryotic expression of IFIT1*
L i Hongtao1,Su Yongping1△,Xu J ianming2,Ran Xinze1,Wang J unping1,Ai Guoping1,Cheng Tianming1
(1.State Key L aboratory ofTrauma,B urns and Combined Injury,Institute of Combined Injury,College ofPreventive Medicine,Third Military Medical University,Chongqing,400038,China;2.Dept.of Molecular and Cellular Biology,Baylor College of Medicine,Houston,TX77030,U.S.A.)
Objective To investigate the soluble prokaryotic expession of interferon induced factor with tetratricopeptide repeats-1.Methods By reverse transcription PCR,murine IFIT1 cDNA coding sequence was acquired,and cloned into the prokaryotic expression vector.Then the E.coli was transformed by electroporation with the recombinant.The screened positive cloning was induced to express target recombining protein which was observed with SDS-PAGE.Results The aplenty soluble fusion proteins MBP-IFIT1 could be obtained by this prokaryotic expression construction.Conclusion Accomplishment of the soluble expression of MBP-IFIT1 provides basements of the IFIT1 follow-up functional studies.
wounds and injuries;cell-stress;recombinants;prokaryotic expression
10.3969/j.issn.1671-8348.2011.19.001
A
1671-8348(2011)19-1873-03
国家973创伤项目05课题基金资助项目(2005CB522605);海外青年学者合作研究基金资助项目(30328025)。△
,Tel:13608393962;E-mail:suyp2003@yahoo.com.cn。
2011-01-09
2011-03-15)
——走进第三军医大学大坪医院眼科专科医院

