转基因玉米59122品系的特异性检测
许文涛,杨 蓉,陆 姣,张 南,罗云波,何 景,黄昆仑,*
(1.中国农业大学食品科学与营养工程学院食品安全实验室,北京 100083;
2.农业部转基因产品检验监督测试中心(北京),北京 100083)
转基因玉米59122品系的特异性检测
许文涛1,2,杨 蓉2,陆 姣1,张 南1,2,罗云波1,何 景1,2,黄昆仑1,2,*
(1.中国农业大学食品科学与营养工程学院食品安全实验室,北京 100083;
2.农业部转基因产品检验监督测试中心(北京),北京 100083)
使用反向聚合酶链式反应(PCR)技术克隆了转基因玉米59122的外源基因与玉米基因组之间的两段侧翼序列,并据其左侧侧翼序列设计了具品系特异性的引物,运用半巢式PCR技术建立了59122的品系特异性二重PCR检测方法,扩增片段100bp,横跨pat终止子与转基因玉米侧翼基因之间。以转基因玉米59122、MON863、MON810、GA21、NK603,转基因大豆Roundup Ready和转基因油菜GT73等为材料,证明本方法与其他转基因作物具有高特异性。本方法在检测59122时,确定出连接体系中线性DNA的最佳质量浓度为1ng/μL左右,检出限达到0.1%,灵敏度为38个单倍体基因组拷贝数。因此可准确、快速、高效地检测转基因玉米及其产品,或作为常规PCR定性检测后的验证方法。
转基因作物;品系特异性检测;半巢式聚合酶链式反应;反向聚合酶链式反应;二重聚合酶链式反应
随着转基因作物的不断商业化,新型转基因食品的安全性问题逐渐成为公众关注的焦点。为此,各国都加强了管理[1]。除了向公众公布相关信息、增加透明度外,关键问题是建立相应的科学检测方法来分析鉴别转基因产品。
目前,转基因产品的检测技术[2]很多,分为基于核酸水平的检测技术、基于蛋白水平的检测技术以及其他检测技术。在定性检测中基于蛋白水平的检测[3]不能区别转入同一蛋白的两种不同的转基因植物,对于经过深加工、抗原发生变性的转基因产品也无法检测,通常不作为首选方法。而基因芯片[4]这一类检测技术尚处研究阶段并不成熟。因此,应用最广的为基于核酸水平的PCR定性检测技术,包括对转基因产品通用元件检测的筛查法[5],对目的基因进行检测的基因特异性方法[6],对转化载体进行检测的构建特异性方法[7]以及对转基因产品中侧翼序列进行检测的转化事件特异法[8]。与转化事件特异法相比,前3种方法的特异性都比较低,多会出现假阳性以及无法辨别具有相同外源DNA的不同转基因作物等问题。另外在进出口贸易中,除了要确定送检商品是否含有转基因成分,还要确定该成分是否被输入国所批准,即进行转化事件鉴定,该项检测内容已经成为国际上转基因产品检测技术的发展趋势[2]。
转基因玉米转化的主要改良性状为抗虫和耐除草剂等[1,8],转基因玉米59122兼具抗虫害及耐除草剂两种特异性转化事件,是通过农杆菌介导技术将质粒载体PHP17662导入玉米转化事件Hi-Ⅱ基因组筛选得到的基因改造玉米。PHP17662包含选自Bacillus thuringiensis strain PS149B1的cry34Ab1与cry35Ab1(delta-endotoxin)抗虫基因以及抗除草剂pat(phosphinothricin-N-acetyltransferase,膦酸乙酰转移酶)基因。
本实验根据GeneBank中获得的ubiquitin启动子(登录号CS165465)和pat(登录号DQ156557)基因序列,利用反向聚合酶链式反应(inverse polymerase chain reaction,I-PCR)来确定转基因玉米59122的侧翼序列。随后,在侧翼序列相邻的T-DNA(转基因载体)和玉米基因组上各设计一条引物,此对引物就可以对该转基因玉米59122进行转化事件特异性检测。建立定性检测体系,并验证该检测方法的特异性和灵敏度。
1 材料与方法
1.1 材料、试剂与仪器
转基因玉米59122及其非转基因亲本 美国DuPont公司;转基因玉米MON8 63、MON8 10、GA21、NK603、转基因大豆Roundup Ready、转基因油菜GT73孟山都公司;限制性内切酶、Taq DNA聚合酶、T4DNA连接酶、dNTP 大连宝生物工程有限公司;Hind Ⅲ限制性内切酶 美国Promega公司;RNase A酶、DNA Marker DL 2000、CTAB、Tris、EDTA、IPTG、氨苄青霉素等 美国Sigma公司;蛋白胨、酵母粉等制备细菌培养基试剂 鼎国公司;DNA回收试剂盒 北京佰亿新创科技有限公司。
DU 640核酸蛋白分析仪 美国Beckman Coulter公司;UV-2450 紫外分光光度计 日本岛津公司;GelDoc-It 紫外凝胶成像仪 美国UVP公司。
1.2 制备不同转基因含量的59122玉米样品
将转基因玉米59122和其非转基因亲本按质量比相混合,制成6个不同转基因含量(10%、5%、1%、0.5%、0.1%、0.05%)的样品。
1.3 基因组DNA的提取[3]
称取100mg于液氮中研磨成粉末状的种子材料,按CTAB法提取样品总DNA。提取的总DNA溶于30~50μL ddH2O中,经核酸蛋白分析仪测定其浓度,最终稀释成100ng/μL和50ng/μL备用。用紫外分光光度计测定DNA溶液的OD260与OD280,并计算OD260/OD280的比值来评价提取的质量,本研究中所用DNA其OD比值均在1.6~1.9范围。
1.4 反向PCR(I-PCR)
1.4.1 总DNA的酶切与酶切片段的环化
取约1μg基因组DNA加入1×缓冲液和10U限制性内切酶形成60μL的反应体系,选择在ubiquitin内含子内部没有酶切位点的常用限制性内切酶SacⅠ和BamHⅠ以及在pat基因序列中没有酶切位点的常用限制性内切酶Hind Ⅲ和EcoRⅠ,分别于37℃消化玉米基因组3h,接着用酚-氯仿/异戊醇(Tris-饱和酚:氯仿:异戊醇的体积比为25:24:1)抽提法纯化DNA(除去由限制性内切酶释放的短的寡聚核苷酸),最后将基因组DNA溶于25μL ddH2O中。此后向含约16ng经过消化的基因组DNA中加入1×缓冲液,6U T4连接酶形成50μL反应体系,在T4连接酶的作用下于4℃过夜连接成环。于75℃处理15min后洗涤沉淀溶于20μL ddH2O中。
1.4.2 反向PCR引物
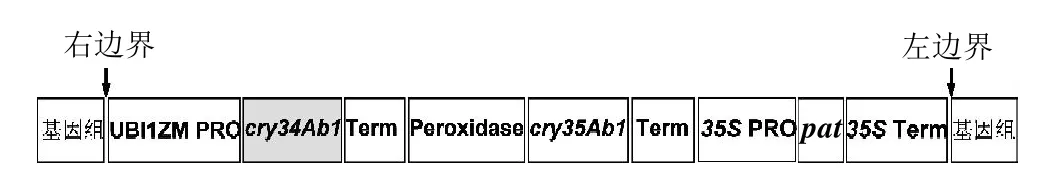
图1 59122玉米基因整合图谱Fig.1 Schematic diagram of the genomic arrangement of event 59122 maize

反向PCR的引物Ubi-F1/R1/R2和Pat-F1/R1/R2分别根据玉米ubiquitin启动子和pat基因设计;由ABI Prism Primer Express Version 2.0软件设计,宝生物工程(大连)有限公司合成。Ubi-F1/R1/R2用以扩增右边侧翼序列,Pat-F1/R1/R2用以扩增左边侧翼序列。玉米自身Ivr[9]基因作为内源参照。
1.4.3 反向PCR
反应体系(30μL):1×Pyrobest缓冲液;0.2mmol/L dNTP mix;0.3μmol/L正向引物和反向引物;2.5U Pyrobest DNA 聚合酶;2μL连接成环的DNA。
第一轮反应程序:94℃预变性5min;94℃变性30s,58℃退火40s,72℃延伸1min40s,共30个循环;72℃延伸10min。第二轮反应程序:94℃预变性5min;94℃变性30s,59℃退火40s,72℃延伸2min,共35个循环;72℃延伸10min。
取两次PCR产物各10μL进行2%琼脂糖凝胶电泳(含有0.1μg/mL EB),用凝胶成像仪扫描并进行TIFF图像分析。
1.4.4 PCR产物测序
为保证测序结果的真实性,本实验将扩增的PCR产物纯化后连接到pGEM-T Easy载体,经转化、阳性克隆鉴定等几个步骤后,用1%琼脂糖凝胶电泳检测结果之后,送于宝生物工程(大连)有限公司测序。
1.5 转化事件特异性定性PCR检测
根据左边侧翼序列,设计特异性引物LD-F1/R1,其中LD-F1位于CaMV35S终止子内部,LD-R1位于玉米基因组内部,其扩增产物大小为100bp。同时以玉米自身Ivr[9]基因作为内源参照,建立二重PCR体系对转基因玉米59122进行转化事件特异性定性检测。

二重PCR反应体系(30μL):1×PCR缓冲液;0.2mmol/L dNTP mix;2.5U Taq DNA聚合酶;1.5mmol/L MgCl2;引物Ivr-F1与引物Ivr-R1各0.3μmol/L;引物LD-F1与引物LD-R2各0.6μmol/L;100ng模板DNA。
反应程序:94℃预变性5min;94℃变性10s,59℃退火20s,72℃延伸30s,共35个循环;72℃延伸5min。所有PCR反应在热循环仪上进行扩增,每个反应重复3次,每次设置3个平行。
2 结果与分析
2.1 确定侧翼序列
基因组DNA经四种限制性内切酶消化后,分别用半巢式引物Ubi-F1/R1/R2和Pat-F1/R1/R2扩增。结果表明,基因组DNA用BamHⅠ和Hind Ⅲ消化后,经两轮PCR扩增和电泳检测没有出现扩增条带;而基因组经SacⅠ消化,用半巢式引物Ubi-F1/R1/R2扩增,通过琼脂糖凝胶电泳检测发现得到大于3kb的条带。与此同时,经EcoRⅠ消化的基因组,以Pat-F1/R1/R2为引物扩增,电泳检测出大于2kb的一条带。
回收扩增条带,分别将两个片段克隆到pGEM T-Easy载体,转化到DH5α感受态细胞中,转化子经过筛选、酶切鉴定、测序分析后结果表明,基因组经SacⅠ消化,反向引物Ubi-F1/R1/R2扩增后,获得3388bp片段,经EcoRⅠ消化,反向引物Pat-F1/R1/R2扩增后,获得2525bp片段。
通过DNAMAN软件和NCBI数据比对所测序列,分析S a cⅠ酶切位点前后的序列,推测出酶切位点前1361~1643总共282个碱基序列来自未知的玉米基因组。测序及分析见图2。

图2 反向PCR(I-PCR)扩增右边侧翼序列Fig.2 Inverse PCR (I-PCR) amplified right flanking sequence
用同样的分析方法分析左侧翼序列,推测出酶切位点后783~1896之间的1114个碱基序列来自未知的玉米基因组。测序及分析见图3。

图3 反向PCR(I-PCR)扩增左边侧翼序列Fig.3 Inverse PCR (I-PCR) amplified left flanking sequence
为了得到连接体系中线性DNA的最佳质量浓度,本实验在连接体系中了添加不同量的线性DNA。通过后续的PCR确定线性DNA的适宜质量浓度为1ng/μL左右。
2.2 转基因玉米59122转化事件特异性定性检测
为了检测体系的特异性,本实验同时以转基因玉米59122、MON863、MON810、GA21、NK603、转基因大豆Roundup Ready和转基因油菜GT73为模板进行扩增。结果显示,大小为100bp的转化事件特异性扩增产物仅在以转基因玉米59122为模板时出现,而以其他转基因玉米转化事件,转基因大豆Roundup Ready和转基因油菜GT73为模板时没有扩增出现该特异性扩增产物(图4),大小为226bp的玉米内源参照基因Ivr[9]的扩增条带在所有以玉米为模板的扩增中均出现,这说明PCR反应体系没有受到抑制(图4)。

图4 转化事件特异性定性检测体系的特异性Fig.4 Specificity of event-specific qualitative detection
此外,为了验证该检测体系的灵敏度。以按质量比混合制备所得的6种不同转基因含量(10%、5%、1%、0.5%、0.1%、0.05%)的样品DNA为模板进行检测。结果显示,Ivr[9]基因在所有的样品中均可以检测到,侧翼序列在除了0.05%含量的样品外均可以检测到(图5)。这表明最低检测限至少为0.1%,根据玉米基因的单拷贝质量大约为2.73pg[10],检测下限大约为38个单倍体拷贝。
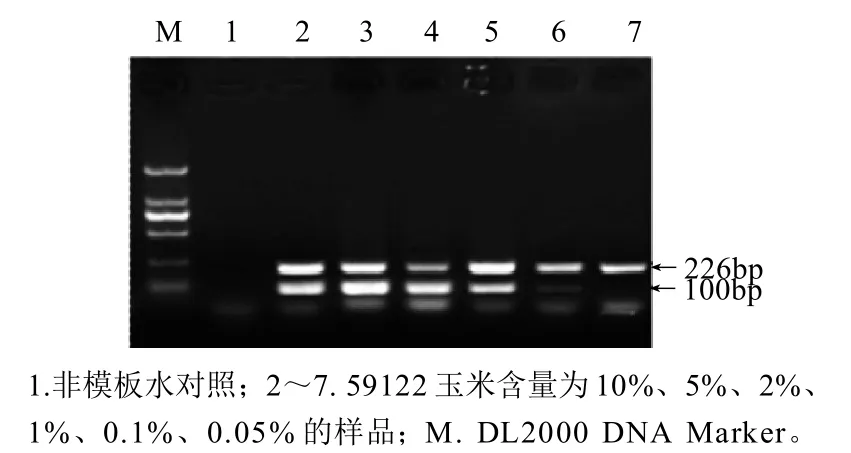
图5 转化事件特异性定性PCR检测体系的灵敏度Fig.5 Sensitivity of event-specific qualitative detection
3 讨 论
转化事件特异法是通过扩增侧翼序列(受体基因组和插入DNA的连接区域)来鉴定含有相同外源DNA的不同转基因生物(genetically modified organism,GMO)[8]。侧翼序列对于被检测的转基因产品具有很好的特异性,所以当一个外源基因能引起几种不同插入情况时,就可扩增其侧翼序列。为了快速获得可靠的实验结果,本实验采用反向的互补引物来扩增两引物以外的未知序列片段的反向PCR技术[11]确定了转基因玉米59122的侧翼序列。
转基因产品的定性检测中,常采用特异性较高的巢式PCR与半巢式PCR[12]。本实验设计了两套半巢式引物进行了两轮PCR扩增。经电泳检测,只有第二轮PCR扩增能检测到扩增条带。这说明半巢式PCR能够增加反应的特异性,它不但减少了假阳性的出现,而且使检测的下限下降了几个数量级。另外黄昆仑等[13]在应用巢式PCR和半巢式PCR检测转基因大豆及其深加工品的研究中也表明,巢式PCR和半巢式PCR的灵敏度高,在DNA受到严重破坏的产品中仍能检测出转基因成分。
另外,在转基因检测中多重PCR也常被采用,它不仅可以提高检测效率,节省时间和试剂,而且可以提供内部对照,只是模板的数量与质量[14]。本实验建立了检测转基因玉米59122的二重PCR体系。理论上,多重PCR有一些缺陷[15]:扩增每种目的片段需要的反应条件如温度、试剂浓度等可能不同;在同一体系内扩增多个目的片段时,起始拷贝数多的片段会占优势,片段间产生竞争。因此,建立多重PCR体系需要仔细的摸索验证。本实验经过反复摸索后,成功地建立了转基因玉米的转化事件特异性二重定性PCR检测体系。
本研究通过验证转基因玉米的转化事件特异性定性PCR检测体系的特异性[13]和灵敏性,说明特异性引物LD-F1/R1用于检测转基因玉米59122转化事件特异性定性检测是可行的,同时,成功地建立了针对转基因作物59122的转化事件特异性PCR检测体系,这将为准确、快速、高效地检测转基因作物及其产品的标准制定和试剂盒的开发提供技术支持,具有重大的应用价值。
[1] 李静, 李红芳, 张换样, 等. 全球转基因作物的产业化发展[J]. 山西农业科学, 2009, 37(1): 3-8.
[2] 许文涛, 白卫滨, 罗云波, 等. 转基因产品检测技术研究进展[J]. 农业生物技术学报, 2008, 16(4): 714-722.
[3] 张富丽, 雷绍荣, 刘勇. 转基因作物及加工品检测技术概述[J]. 生物技术通讯, 2009, 20(5): 733-737.
[4] DONG Wei, YANG Litao, SHEN Kailin, et al. Database GMDD: a database of GMO detection methods[J]. BMC Bioinform, 2008, 9:260-267.
[5] ANKLAM E, GADANI F, HEINZE P, et al. Analytical methods for detection and determination of genetically modified organisms in agricultural crops and plant-derived food products[J]. Eur Food Res Technol,2002, 214(1): 3-26.
[6] YANG Rong, XU Wentao, LUO Yunbo, et al. Event-specific qualitative and quantitative polymerase chain reaction detection of roundup ready event GT73 based on the 3′-transgene integration sequence[J]. Plant Cell Repots, 2007, 26(10): 1821-1831.
[7] XU Wentao, BAI Weibin, LUO Yunbo, et al. Research progress in detection technique for genetically modified organisms[J]. Chinese Journal of Agricultural Biotechnology, 2009, 6(1): 1-9.
[8] 张亚炜, 姜美丽, 于绍山. 关于转基因食品的安全性评价[J]. 农业工程技术: 农产品加工业, 2009(8): 50-53.
[9] 王国英. 植物基因工程技术[M]. 北京: 北京农业科技文献出版, 1998.
[10] EHLERS B, STRAUCH E, GOLTZ M, et al. Nachweis gentechnischer verfinderungen in mais mittels PCR[J]. Bundesgesundheitsbl, 1997, 97(4): 118-121
[11] 施向东, 林新勤, 梁惠宁. 转基因食品检测技术探讨[J]. 中国公共卫生管理, 2008, 24(1): 49-50.
[12] ANTAL Z, RASCLE C, FEVRE M, et al. Single oligonucleotide nested PCR: a rapid method for the isolation of genes and their flanking regions from expressed sequence tags[J]. Curr Genet, 2004, 46(4): 240-246.
[13] 黄昆仑, 罗云波. 用巢式和半巢式PCR检测转基因大豆Roundup Ready及其深加工食品[J]. 农业生物技术学报, 2003, 11(5): 461-466.
[14] 高玉龙, 焦芳婵, 徐照丽. 多重PCR 在烟草转基因检测中的应用[J].生物技术通报, 2008(2): 140-142.
[15] 张秀丰, 苏旭东, 张伟. 五重PCR检测转基因大豆[J]. 中国粮油学报, 2008, 23(3): 194-198.
Event-specific Transgenic Detection of Genetically Modified Maize 59122 with Flanking Sequence
XU Wen-tao1,2,YANG Rong2,LU Jiao1,ZHANG Nan1,2,LUO Yun-bo1,HE Jing1,2,HUANG Kun-lun1,2,*
(1. Food Safety Laboratory, College of Food Science and Nutritional Engineering, China Agricultural University,Beijing 100083, China;2. Supervision, Inspection and Testing Center of Genetically Modified Organisms (Beijing),Ministry of Agriculture, Beijing 100083, China)
We report the cloning of two flanking sequence of the integrated gene construct of genetically modified maize 59122 by inverse PCR method and the design of even-specific primers based on the left flanking sequence with the aim of developing of a duplex PCR assay for the event-specific transgenic detection of genetically modified maize 59122 using semi-nested PCR,result ing in an amplification fragment of 100 bp in length stretching from the terminator of the pat gene to the 59122 flanking genes.This assay has been successfully applied to detect genetically modified maizes 59122, MON863, MON810, GA21, NK603,genetically modified Roundup Ready soybeans and genetically modified oilseed rape GT73, with high specificity. The optimum concentration of linear DNA in a connection system for detecting genetically modified maize 59122 by this assay was around 1 ng/μL, which exhibited a limit of detection of 0.1% and a sensitivity of 38 copies of haploid genome. Therefore, the developed PCR assay is applicable to detect genetically modified maize and its derivates accurately, fast and efficiently, and can serve to verify routine PCR qualitative detection.
genetically modified crop;event-specific transgenic detection;semi-nested polymerase chain reaction;inverse polymerase chain reaction;duplex polymerase chain reaction
Q789;S513
A
1002-6630(2011)04-0139-04
2010-03-13
国家“863”计划项目(2006AA10Z440);国家自然科学基金项目(30800770);国家转基因生物新品种培育重大专项(2008ZX08012-001)
许文涛(1979—),男,副教授,博士,研究方向为食品安全。E-mail:cauxwt@yahoo.cn
*通信作者:黄昆仑(1968—),男,教授,博士, 研究方向为食品安全。E-mail:hkl009@163.com

