芦苇叶类黄酮高效液相色谱分析
孙丽芳,刘邻渭*,吕俊丽,李 旋
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
芦苇叶类黄酮高效液相色谱分析
孙丽芳,刘邻渭*,吕俊丽,李 旋
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
目的:分析芦苇叶类黄酮的组分。方法:制备芦苇叶类黄酮提取浓缩过程中形成的析出物和浓缩液再经大孔树脂纯化后产生的初纯物,优化两种样品中类黄酮苷转化为苷元的水解条件,采用高效液相色谱(HPLC)法测定两种样品和其水解样品类黄酮的组分。结果:析出物和初纯物的总黄酮含量分别为57.1%和18.5%,酸浓度1.4mol/L、温度80~90℃条件下水解4h可获得相对最好的水解效果;HPLC测定表明,析出物含32种组分,其中7种得到确定,初纯物含22种组分,其中5种得到确定;水解析出物含28种组分,其中7种得到确定,水解初纯物含25种组分,其中7种得到确定。结论:芦苇叶含有芦丁、野黄芩苷、橙皮苷、木犀草素、槲皮素、芹菜素、山奈酚、异鼠李素(或橙皮素)、异甘草素和黄芩素,其中芹菜素含量最高,还有许多未确定的类黄酮。
芦苇叶;类黄酮;水解;高效液相色谱(HPLC)
芦苇(Phragmites communisTrin)为多年生禾本科芦苇属植物,它生长力强、分布广,具有“第二森林”的美誉[1]。芦根为一种中药材,芦叶、芦花、芦茎也含有丰富的药理成分,如戊聚糖、薏苡素、两种糖醛酸以及VB1、VB2、VC等[2]。在芦苇的现代科学研究中,类黄酮是关注点之一。据报道,芦苇中含有木犀草素、槲皮素以及异鼠李素等黄酮苷元与葡萄糖等单糖以O-糖苷键和C-键直接链接而成的类黄酮,是极好的天然抗氧化剂[3-4]。
有关研究说明,类黄酮苷被水解成苷元后,其生物利用率和清除人体自由基的生物活性明显提高。这是因为类黄酮进入人体代谢时,其苷元形式可以直接被吸收进入血液中,而大部分类黄酮苷不能通过小肠壁直接进入血液,需在肠内益生菌分泌的水解酶作用下水解成苷元,再被吸收进入血液[5-7]。
在曾对芦苇叶总黄酮提取分离并测定了其体外抗氧化功能的基础上[8-10],本研究选择芦苇叶总黄酮提取液浓缩时析出的结晶物和浓缩液再经大孔树脂纯化后所得的类黄酮初纯物为样品,将两种样品进行盐酸水解条件的优化,应用高效液相色谱对两种样品水解前后的色谱图进行类黄酮组分分析,部分确定其中的类黄酮苷和苷元,为进一步探索和利用芦叶类黄酮提供科学依据。
1 材料与方法
1.1 材料与试剂
芦苇叶于5、6月份采自西安市杨凌区渭河滩,室温自然干燥,粉碎。
芦丁、野黄芩苷、橙皮苷、槲皮素、芹菜素、异鼠李素、异甘草素、黄芩素、山奈酚、橙皮素、木犀草素(均为标准品,纯度≥98%) 四川维克奇生物技术有限公司;盐酸、甲醇、乙酸乙酯(均为分析纯)中国医药集团(上海)化学试剂有限公司。
1.2 仪器与设备
1.3 方法
1.3.1 样品的制备
1.3.1.1 芦苇叶类黄酮提取液浓缩时析出物的制备
称取芦苇叶粉末350g,按料液比1:50加入70%乙醇,于70℃水浴提取3次,第1次提取1h,第2次和第3次分别提取30min,提取液抽滤后合并,40℃旋转蒸发浓缩,此过程中有黑色固体析出,将其收集,于50℃烘干,粉碎成粉末待用(以下简称析出物)。
1.3.1.2 芦苇叶类黄酮初纯物的制备
将1.3.1.1节的浓缩液用石油醚萃取,除去叶绿素和蜡质,然后转入AB-8大孔吸附树脂柱,当浓缩液流入柱床中后,关闭柱出口,静态吸附1h,然后用3倍柱床体积的蒸馏水洗除水溶性杂质,再用3倍柱床体积的70%乙醇溶液洗脱,收集洗脱液,40℃浓缩干燥,得芦苇叶类黄酮初纯物,粉碎成粉末待用(以下简称初纯物)。
1.3.2 样品的水解及前处理
精确称取析出物和初纯物粉末各10mg,分别放入不同水解管中,各管加入8mL甲醇和2mL一定浓度的盐酸,密封后分置于一定温度的恒温水浴锅中水解一定时间后,取出冷却,抽滤后,用甲醇定容至50mL,旋转蒸发浓缩后,将残余溶液用乙酸乙酯萃取(30mL×3次),合并乙酸乙酯相,定容至100mL,进行紫外测定,然后将其于40℃浓缩蒸干后,用10mL甲醇溶解,再用0.45μm滤膜过滤后,作为液相测定样品。
1.3.3 未水解样品的前处理
按照1.3.2节的步骤,但以蒸馏水代替盐酸,且省去保温水解步骤,并将溶解乙酸乙酯萃取物的甲醇由10mL改为6mL,得到析出物和初纯物的前处理液的紫外测定结果和液相测定样品。
1.3.4 样品水解条件的优化
1.3.4.1 盐酸浓度的优选
按照1.3.2节的方法,盐酸浓度分别选为4、5、6、7、8mol/L,水浴温度恒为80℃,水解时间恒为2h,对析出物和初纯物分别进行5组水解处理,根据处理液在365nm吸光度的大小优选盐酸浓度。
1.3.4.2 水解时间的优选
按照1.3.2节的方法,水解时间分别选为1、2、3、4、5h,盐酸浓度恒为7mol/L,恒温水浴温度恒为80℃,对析出物和初纯物分别进行5组水解处理,根据处理液在365nm吸光度的大小优选水解时间。
1.3.4.3 水解温度的优选
按照1.3.2节的方法,水浴温度分别选为50、60、70、80、90℃,盐酸浓度恒为7mol/L,水解时间恒为4h,对析出物和初纯物分别进行5组水解处理,根据处理液在365nm吸光度的大小优选水解温度。
1.3.5 色谱分析
1.3.5.1 色谱条件[11]
色谱柱:C18(150mm×4.6mm,5μm);流动相:20min的20%~40%乙腈溶液(用三氟乙酸调pH2.5)梯度洗脱;流速:1.0 mL/min;柱温:2 5℃;检测波长:365nm;进样量:20μL。
1.3.5.2 标准图谱的制作
1)第1组混和标准样品为芦丁、木犀草素、槲皮素、芹菜素、山奈酚、异甘草素、黄芩素,质量浓度分别为 0.02、0.016、0.023、0.02、0.021、0.0168、0.023mg/mL甲醇溶液。
2)第2组混和标准样品为芦丁、野黄芩苷、橙皮苷、槲皮素、异鼠李素、山奈酚、橙皮素,质量浓度分别为 0.02、0.022、0.021、0.023、0.016、0.021、0.022mg/mL甲醇溶液。
3)上机分析:开机预热20min,设置色谱条件和参数,首先以20%乙腈溶液清洗柱子,待基线稳定后,手动进样,转入梯度洗脱,由仪器工作站绘出标准图谱,此后转用20%乙腈水溶液清洗柱子,准备下次进样。
1.3.5.3 样品测定
按照标准图谱制作时同样的上机分析方法对1.3.2节制出的水解析出物和初纯物样液及1.3.3节制出的析出物和初纯物样液进行测定。
2 结果与分析
2.1 样品制备
由1.3.1节制出的析出物为黑色粉末,总黄酮含量为57.1%,初纯物为棕色粉末,总黄酮含量为18.5%。这说明,在芦苇叶类黄酮提取液的浓缩过程中产生的析出物比初纯物的总黄酮含量还高,所以,它和初纯物都应当作为制取芦苇叶类黄酮重要物质。
2.2 样品水解条件优化
2.2.1 盐酸浓度的优选
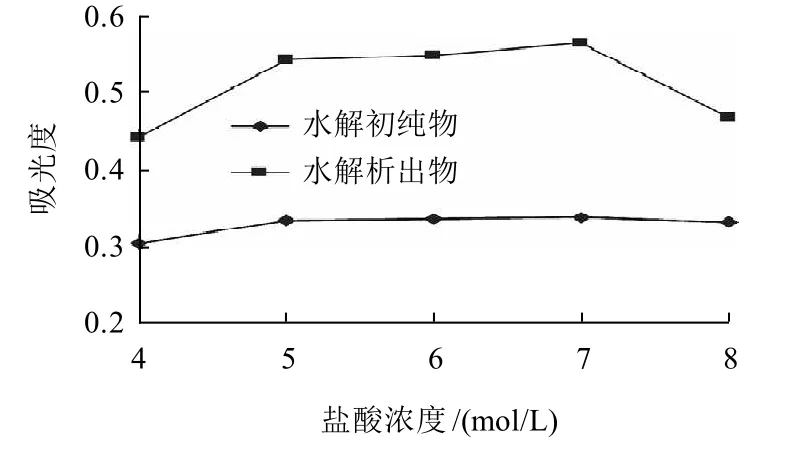
图1 盐酸浓度对水解的影响Fig.1 Effect of HCl concentration on hydrolysis degree
由图1可知,使用的盐酸浓度在7mol/L时,析出物和初纯物水解样液的吸光度均最高。当盐酸浓度大于7mol/L时,吸光度转而下降。365nm吸光度为测定多种类黄酮含量时常用的检测指标,在本实验中,其值的高低表明水解样液中类黄酮、特别是其苷元浓度的高低。因此,选择7mol/L的盐酸用于调整水解液的酸度最佳,即水解液酸浓度控制为1.4mol/L。
2.2.2 水解时间的选择
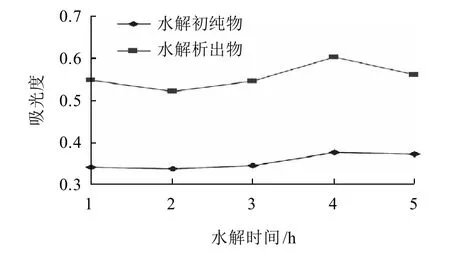
图2 水解时间对水解的影响Fig.2 Effect of hydrolysis time on hydrolysis degree
由图2可知,在水解时间为4h的条件下,析出物和初纯物水解样液的吸光度均最高。水解时间少于和多于4h时吸光度均较小。这说明4h的水解过程即可保证水解基本完成,又不因时间过长而加剧类黄酮和其苷元的损失。故选择4h作为最佳水解时间。
2.2.3 水解温度的选择

图3 水解温度对水解的影响Fig.3 Effect of hydrolysis temperature on hydrolysis degree
由图3可知,随着水解温度逐渐升高,析出物和初纯物水解样液的吸光度也逐渐升高,说明温度的升高有利于水解反应的进行;当温度升至90℃时,析出物水解样液的吸光度达到最高,初纯物水解样液的吸光度反而低于80℃时的,说明水解温度也不宜太高,过高易造成类黄酮破坏。所以,析出物和初纯物的最佳水解温度分别选择为90℃和80℃。
2.3 水解前后样品HPLC图谱分析
2.3.1 类黄酮标准品的HPLC图谱
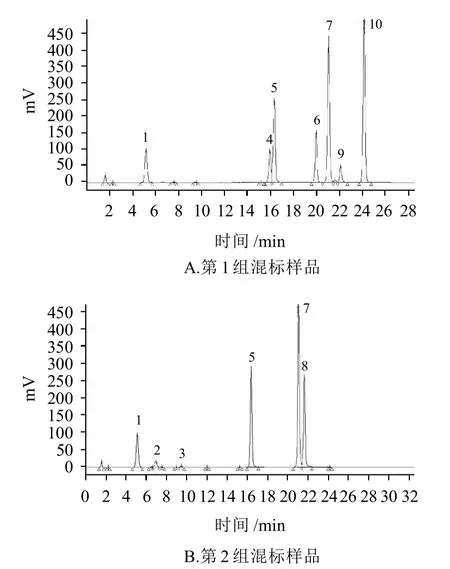
图4 标准样品的HPLC色谱图Fig.4 HPLC chromatogram of standard sample
由图4可知,11种标准物质的色谱峰间基本清晰分离,两次重复测定(色谱图省略)的结果说明:芦丁、野黄芩苷、橙皮苷、木犀草素、槲皮素、芹菜素、山奈酚、异鼠李素、橙皮素、异甘草素和黄芩素的保留时间分别为 5.146~5.179、7.001~7.094、9.515~9.701、15.971~16.164、16.354~16.393、19.875~20.138、21.088~21.223、21.645~21.741、21.673~21.741、22.136~22.244min和24.182~24.288min,其中异鼠李素和橙皮素之间在此色谱条件下难以分离。
2.3.2 水解前后析出物的HPLC图谱分析
按1.3.5.3节制作的样品图谱见图5、6。

图5 析出物(A)和水解析出物(B)的HPLC色谱图Fig.5 HPLC chromatograms of crude extract (A) and hydrolysates of crude extract (B)
由图5A可知:析出物中含有芦丁、野黄芩苷、橙皮苷、槲皮素、芹菜素、异鼠李素(或橙皮素)、异甘草素、黄芩素这7种物质,且芹菜素的含量最高,异鼠李素(或橙皮素)的含量次之,另外还有大约25种物质有待进一步研究确定。由图5B可知:水解析出物的样液含有野黄芩苷、橙皮苷、木犀草素、槲皮素、芹菜素、山奈酚、异鼠李素(或橙皮素)这7种物质。另外还有大约21种物质有待进一步研究确定。
比较图5A、5B可知:水解前后均有保留时间短于4.5min的物质稳定存在;水解前保留时间在5.7~12.2min的物质,水解后大部分消失或减少,说明此类物质大部分可以被水解,极可能是类黄酮-O-糖苷(包括木犀草素、槲皮素苷、芹菜素苷、山奈酚苷等);水解后保留时间在14min之后的一些物质峰面积增加,对照标准图谱可以确定这些物质包含木犀草素、槲皮素、芹菜素、山奈酚和异鼠李素(或橙皮素);析出物水解后的样品图谱中出现了保留时间在26~28min的两种物质,虽无法确证,但极可能是比黄芩素极性还小的苷元。
2.3.3 水解前后初纯物的HPLC图谱分析

图6 初纯物(A)和水解初纯物(B)的HPLC色谱图Fig.6 HPLC chromatographs of primarily purified sample (A) and hydrolysates of primarily purified samples (B)
由图6A可知:初纯物中含有芦丁、野黄芩苷、橙皮苷、芹菜素、异鼠李素(或橙皮素)这5种物质,另外还有大约17种物质有待进一步研究确定。由图6B可知:水解初纯物中含有野黄芩苷、橙皮苷、木犀草素、槲皮素、芹菜素、山奈酚、异鼠李素(或橙皮素)这7种物质,且芹菜素的含量最高。另外还有大约18种物质,有待进一步研究确定。
比较图6A、6B可知:水解前后均有保留时间短于4.2min的物质稳定存在;水解前保留时间在4.6~12.15min之间出现的物质水解后大部分减少(如野黄芩苷、橙皮苷)或消失(如芦丁),而木犀草素、槲皮素、芹菜素、山奈酚、异鼠李素(或橙皮素)都比未水解时增加,同时新出现了保留时间为5.740、6.186min的两种物质。提示初纯物中的此类物质大部分可以被水解,应该是O-糖苷键链接的类黄酮苷,这些苷包含芦丁、野黄芩苷和橙皮苷。
2.3.4 对色谱图中未确定峰的讨论
Mahmoud等[12]发现芦苇花中含有日当药黄素和异日当药黄素的C-糖苷,含有日当药黄素-3-O-龙胆双糖苷、日当药黄素-3-O-葡萄糖苷、鼠李亭-3-O-芸香糖和鼠李亭-3-O葡萄糖苷。Maurice等[13]发现芦苇叶中含有4种黄酮醇糖苷、1种黄酮糖苷和6种C-黄酮糖苷;后者中包含7,3-二甲基异东方廖黄素。戴军等[3]从芦苇叶中检测出9种类黄酮,其中包括木犀草素-6-C-双葡萄糖甙和木犀草素-5-C-三葡萄糖甙。根据这些报道,本实验中的析出物和初纯物所含有的保留时间在12min以前的峰所对应的物质很可能包含这些苷类。另外,根据木犀草素-6-C-双葡萄糖甙和木犀草素-5-C-三葡萄糖甙的结构估计本实验中的析出物和初纯物均含有保留时间在4min左右的两个不可水解的物质极可能就是这两种物质。
3 结 论
3.1 依据色谱分析可以确定芦苇叶中含有芦丁、野黄芩苷、橙皮苷、木犀草素、槲皮素、芹菜素、山奈酚、异鼠李素(或橙皮素)、异甘草素和黄芩素。其中野黄芩苷、橙皮苷、芹菜素、山奈酚、异甘草素和黄芩素在其他文献中尚未见报道。析出物比初纯物的组成复杂,但二者均含有芦丁、野黄芩苷、橙皮苷以及保留时间短于4min且不可水解的类黄酮苷。
3.2 芦苇叶类黄酮的适宜水解条件为:料液比为1:1(mg/mL),溶剂为甲醇-盐酸溶液(8:2,V/V),酸浓度为1.4mol/L,温度为90℃(析出物)和80℃(初纯物),时间为4 h。该水解条件下,芦丁、野黄芩苷、橙皮苷可以水解,水解后的样品中木犀草素、槲皮素、芹菜素和山奈酚含量增加。
[1] 郑曦, 朱峰, 魏磊. 芦苇叶水提物对三种植物种子萌发和幼苗生长的影响[J]. 江苏农业学报, 2006, 22(3): 233-237.
[2] 余晓红, 许伟, 邵荣, 等. 富含黄酮的芦苇提取物的抑菌性和抗氧化性研究[J].食品科学, 2009, 30(23): 185-188.
[3] 戴军, 王洪新, 华春雷. HPLC分析芦苇叶中天然抗氧化成分黄酮类化合物[J]. 无锡轻工业学院学报, 1994, 1(13): 34-37.
[4] 伍毅, 王洪新, 朱松.β-葡萄糖苷酶法与盐酸法水解银杏黄酮制备黄酮苷元的比较[J]. 食品科学, 2008, 29(7): 146-150.
[5] 杨雪鸥, 郁建华, 何照范. 酸法水解银杏黄酮的工艺条件[J]. 山地农业生物学报, 2006, 25(2): 181-184.
[6] 周凤超, 于殿宇, 关海军, 等. 大豆异黄酮水解物制备及放大实验[J].食品工业科技, 2007(11): 152-156.
[7] ERLUND I, KOSONEN T, ALFTHAN G, et al. Pharamaco kinetics of quercetin from quercetin and rutin in healthy volunteers[J]. Eur J Clin Phamacol, 2000, 56(8): 545-553.
[8] 李瑞光, 刘邻渭, 郑海燕. 芦苇黄酮提取液体外抗氧化特性研究[J].西北农业学报, 2009, 18(4): 310-314.
[9] 李瑞光, 刘邻渭, 郑海燕, 等. 大孔树脂分离纯化芦苇叶总黄酮[J].食品研究与开发, 2009, 30(3): 60-64.
[10] 郭庆彬, 刘邻渭, 刘盼红, 等. 芦苇叶中类黄酮提取工艺的研究[J].食品研究与开发, 2007, 28(12): 59-62.
[11] CROZIER A, JENSEN E, LEAN M, et al. Quantitative analysis of flavonoids by reversed-phase high-performance liquid chromatography[J]. Journal of Chromatography, 1997, 761(2):315-321.
[12] MAHMOUD A M N, HASSAN I E S, HEBA H B. The flavonoids of phragmites australis flowers[J]. Phytochemistry, 1980, 19(8): 1854-1856.
[13] MAURICE J, MARIE-ROSE V. Les flavonoides des feuilles du Phragmites australis: essai de définition du profil polyphénolique de l'espéce[J]. Phytochemistry, 1980, 19(12): 2627-2628.
HPLC Analysis of Flavonoids from Reed Leaves
SUN Li-fang,LIU Lin-wei*,Jun-li,LI Xuan
(College of Food Science and Technology, Northwest A & F University, Yangling 712100, China)
Objective: To analyze the compositions of flavonoids from reed leaves. Methods: The crude extract was prepared during the condensation of reed leaf extract. The primarily purified flavonoids were prepared by macro-porous resin. The hydrolysis conditions of flavonoids were optimized. Two samples were hydrolyzed to obtain two hydrolysis products.The compositions of flavonoids were determined by HPLC. Results: The contents of total flavonoids in crude extract and primary purified flavonoids samples were 57.1% and 18.5%, respectively. The optimal hydrolysis conditions for reed leaf flavonoids were hydrolysis temperature of 80-90 ℃, HCl concentration of 1.4 mol/L and hydrolysis time of 4 h. Totally 33 components were separated by HPLC from the crude extract and 8 components were identified based on their retention time. A total of 22 components were separated by HPLC from the primarily purified sample and 5 components were identified. A total of 28 components were separated from the hydrolysates and 7 components were identified. Similarly,25 components were separated from the hydrolyzed primarily purified samples and 7 components were identified.Conclusion: Reed leaves contained rutin, scutellarin, hesperidin, luteolin, quercetin, apigenin, kaempferol, isorhamnetin or hesperetin, isoliquiritigenin, baicalein, and other unknown flavonoids. The content of apigenin among these components was the highest.
reed leaf;flavonoids;hydrolysis;HPLC
O657.7
A
1002-6630(2011)10-0241-05
2010-07-23
孙丽芳(1984—),女,硕士研究生,研究方向为食品化学。E-mail:slf13389207701@163.com
*通信作者:刘邻渭(1953—),男,教授,博士,研究方向为食品科学。E-mail:linweiliu8@hotmail.com

