菠萝蛋白酶工业化提取工艺的改良及酶学性质研究
王 燕,赵力超,陈洁兰,刘晓娟,刘 欣
(华南农业大学食品学院,广东广州 510642)
菠萝蛋白酶工业化提取工艺的改良及酶学性质研究
王 燕,赵力超,陈洁兰,刘晓娟,刘 欣*
(华南农业大学食品学院,广东广州 510642)
以菠萝茎为原料,利用微滤除杂、超滤浓缩分离得菠萝蛋白酶浓缩液,再通过硫酸铵法进行沉淀,最后进行真空冷冻干燥制取菠萝蛋白粗酶;而为了验证其酶学性质,采用Sephadex G-100柱层析和DEAE-52离子交换层析制得纯度较高的菠萝蛋白酶。结果表明:菠萝茎打浆后原液通过微滤除杂、超滤浓缩,再采用90%硫酸铵沉淀等工序后,纯化倍数达1.44,是目前工厂制酶的1.19倍,酶活收率与原液相比只降低9%,具有工业化生产的优越性;经Sephadex G-100柱层析和DEAE-52柱层析后,达到电泳纯,可满足医药用酶所需,存在很好的市场应用价值;且该菠萝蛋白酶的酶学性质与有关报道基本一致,最适反应pH在5~6之间,最适温度60℃,重金属离子如Cu2+、Fe2+、Pb2+等对菠萝茎蛋白酶活抑制较大,而Na+、K+、Ca2+则表现出不同程度的激活作用。
菠萝茎蛋白酶,提取,纯化,酶学性质
我国菠萝资源丰富,菠萝茎是菠萝采收后留下的副产物,每公顷产量达37.5~45t[1],除少量用于提取菠萝蛋白酶外,大部分未得到利用。目前用于工业化生产菠萝蛋白酶的主要方法为传统工艺的高岭土吸附法和单宁沉淀法,以及新工艺的超滤浓缩法。其中高岭土吸附法工艺操作步骤繁琐,消耗原材料较多,设备要求较高,且酶活总回收率低[2-3];单宁沉淀法工艺操作相对高岭土吸附法简单,原材料消耗少,所需设备少,但酶活回收率较低[2-3];超滤法操作步骤少,条件温和,降低了酶活损失,但所得酶制品中含有杂蛋白较多[2-4],所得酶活性不足以满足医药级别及食品中对酶活要求较高的应用。而常规蛋白分子的分离提取常用硫酸铵沉淀法[5],其对于蛋白(酶)具有显著的盐析作用,可以通过控制硫酸铵加入量,以分级盐析的方式对粗提液中的酶进行预提纯。目前,硫酸铵沉淀法已普遍用于多种酶的工业化生产中,如大蒜蒜酶中试生产[6]、果胶酶浓缩工艺[7]等,但是仅仅利用硫酸铵沉淀法对酶进行纯化,酶活回收率较低,不利于工业化生产。本文先利用微滤除杂、超滤浓缩分离得菠萝蛋白酶浓缩液,再结合硫酸铵沉淀法,建立一整套菠萝蛋白酶工业化生产工艺。超滤膜浓缩后采用硫酸铵沉淀,可减少样品体积,大大减少硫酸铵的用量,而硫酸铵沉淀得酶膏,可减少真空冷冻的干燥预冷和干燥时间,降低生产成本。通过方法的组合,优化菠萝茎蛋白酶提取工艺,得到纯度和酶活回收率均高于原工厂酶的食品级用酶。同时,本文还对新工艺制得的酶的性质进行了测定,以期证明采用该工艺得到的菠萝蛋白酶能保持目前使用的菠萝蛋白酶原有的性质,且纯化倍数和酶活回收率均较高,更有利于工业化生产。菠萝蛋白酶分离提取技术的开发及其应用,可提高菠萝废弃物的综合利用价值,加快菠萝蛋白酶产业的发展。
1 材料与方法
1.1 材料与设备
菠萝茎、原工厂酶 由湛江徐闻县美仑生物制品有限公司提供;其它试剂 均为分析纯。
752 型紫外可见分光光度计 上海精密科学仪器有限公司;FD-1PF真空冷冻干燥机 北京德天佑科技发展有限公司;Vivaflow 200超滤系统及其超滤离心管 Vivascience AG公司;ф1.6×80cm层析柱 上海嘉鹏科技有限公司;恒流泵、紫外检测仪 上海清浦沪西仪器厂;MINI-PROTEANⅡ型电泳仪 Bio-RAD公司;日立UV-3010型紫外可见分光光度计日本日立公司。
1.2 实验方法
1.2.1 工艺流程 菠萝茎→压榨→原液→低速离心→清液→微滤→透过液→超滤→浓缩液→硫酸铵沉淀→酶膏→透析脱盐→真空冷冻干燥→精制酶
1.2.2 工艺要点
1.2.2.1 压榨 将菠萝茎洗净,用压榨机压出汁液,然后用纱布过滤。
1.2.2.2 离心和微滤 5000r/min离心10min,上清液采用0.22μm膜进行过滤,得浅黄色菠萝茎蛋白酶清液。
1.2.2.3 超滤 参考王平诸[4]的方法。先将截留分子量10000u的中空纤维超滤膜用水洗0.5h→碱洗0.5h→水洗0.5h,用去离子水测水通量(J0),菠萝茎清液经5000r/min离心10min,0.22μm膜过滤后进行超滤浓缩,在泵提供的动力下,调节至固定流速,在一定操作温度下,调节进出口压力,溶液经微滤后进入超滤膜中。反复循环,浓缩至体积约为原体积的1/10。结束后,用水循环洗涤超滤膜0.5h,再用碱洗0.5h,最后再用水洗涤至恢复原来的水通量。
1.2.2.4 硫酸铵沉淀法 一级沉淀:取适量浓缩液,加入适量的硫酸铵,使其饱和度分别为10%、20%、30%、40%、50%、60%、70%、80%、90%,于低温下静置0.5h。10000r/min离心5min,沉淀用与样品等体积的0.02mol/L pH=7.0 PBS溶解,分别测定上清液和沉淀的酶活和蛋白含量,计算收率和纯化倍数,确定分级沉淀的初始和最终饱和度。分级沉淀:取适量浓缩液,转入离心管中,按一级沉淀得到的分级沉淀的初始和最终饱和度加入硫酸铵,使其分别达到分级沉淀硫酸铵初始和最终饱和度,于低温下静置0.5h,之后操作同一级沉淀,测定酶活和蛋白含量。
1.2.3 纯化方法
1.2.3.1 Sephadex G-100层析 取适量酶粉溶于1mL 0.02mol/L pH=7.0 PBS缓冲液,10000r/min冷冻离心5min,取上清液通过SephadexG-100层析(1.6cm×60cm),用0.02mol/L pH=7.0 PBS缓冲液进行洗脱,洗脱液流速为0.5mL/min,分别测定酶活和蛋白A280,计算收率和纯化倍数。
1.2.3.2 DEAE-52离子交换柱层析 取Sepadex G-100层析酶活管,混合,测定体积,低温冻结,真空冷冻干燥后溶于1mL 0.02mol/L pH=7.0 PBS缓冲液,10000r/min冷冻离心5min,取上清液上柱(1.6cm×40cm)。采用梯度洗脱的方式,洗脱液A:0.02mol/L pH=7.0 PBS缓冲液,洗脱液B:0.02mol/L pH=7.0 PBS缓冲液(内含0.5mol/L NaCl),各100mL,线性洗脱,洗脱液流速为1mL/min,测酶活和蛋白A280,计算收率和纯化倍数。
1.2.4 测定方法
1.2.4.1 蛋白质含量的测定 参考裴显庆[8]采用的考马斯亮蓝G-250法,以牛血清蛋白做标准蛋白,与Bradford试剂作用,用分光光度计在595nm处测定吸光度,样品同样处理,再通过标准曲线测定并算得蛋白含量。
1.2.4.2 菠萝茎蛋白酶酶活测定 参考施特尔马赫[9]采用的酪蛋白法。1min内酶水解酪蛋白释放出相当于1μg/mL酪氨酸在275nm波长处的吸收度为1个活力单位。
1.2.4.3 SDS-PAGE电泳 参考丁宵霖等[10]的方法,将蛋白质样品适量与5×上样缓冲液(Loading Buffer)在离心管中混合,100℃加热2~10min,8000r/min离心5min,用微量注射器将样品20μL加入样品孔中。采用浓缩胶75V,分离胶80~100V,电泳约2.5h,直到溴酚蓝指示剂电泳到距胶边缘1cm时停止电泳。小心取下凝胶,用考马斯亮蓝R-250染液染色30min,用考马斯亮蓝R-250脱色液脱色过夜,观察结果。
2 结果与讨论
2.1 菠萝茎蛋白酶浓缩液的制备
压榨后的菠萝茎蛋白酶原液需迅速过滤后放入-20℃保存,防止酶活力降低。提取前将处于-20℃保存的菠萝茎蛋白酶原液解冻,5000r/min离心10min,以除去不溶性杂质。上清液采用0.22μm膜进行预过滤,以除去微生物、一些大分子蛋白和多糖等胶体物质,得浅黄色菠萝茎蛋白酶清液。再将清液进行超滤浓缩,一方面溶液中的小分子物质经中空纤维膜的内壁渗透出来成为超滤液而排出;另一方面,料液通过蠕动泵循环打入超滤膜,溶液中的酶蛋白等大分子物质得以保留并得到浓缩。
2.2 硫酸铵盐析法提取菠萝茎蛋白酶
菠萝蛋白酶是典型的巯基蛋白酶,是一种分子量为33000u的蛋白质[9]。硫酸铵是强电解质,有强烈的水化作用,可破坏蛋白质颗粒表面的水化膜,并能中和蛋白质颗粒所带的电荷,使蛋白质在溶液中凝聚而析出。但只有达到蛋白质等电点时,其才易于沉淀,不同蛋白质有不同等电点,即硫酸铵盐析浓度不同,且不同蛋白质硫酸铵盐析的最佳次数不同[10],因此,需对其进行硫酸铵一级沉淀和分级沉淀实验。
2.2.1 硫酸铵一级沉淀结果 经超滤浓缩后酶液进行硫酸铵一级沉淀,实验结果如图1和图2所示。

图1 上清酶活收率和纯化倍数的变化
由图1可知,菠萝茎蛋白酶浓缩液上清部分的酶活收率随硫酸铵饱和度的增加呈现逐步下降的趋势,当硫酸铵的添加量达到70%时,上清的酶活收率为4.51%,上清已基本没有酶活;当硫酸铵浓度达到50%时,上清纯化倍数达到最高值1.57倍,但酶活收率只有38.08%;硫酸铵添加浓度为20%时,上清酶活收率为90.42%,纯化倍数为1.15倍。综合考虑上清酶活收率和纯化倍数,确定两步沉淀的初始硫酸铵浓度为20%。

图2 沉淀酶活收率和纯化倍数的变化
由图2可知,随着硫酸铵浓度的增加,沉淀部分的酶活收率呈现逐步上升的趋势,在硫酸铵浓度达到70%时,沉淀部分酶活收率达到最大值95.49%,随后酶活收率趋于稳定;就沉淀部分的纯化倍数而言,10%、20%浓度硫酸铵所得沉淀的纯化倍数较高,分别为2.29和1.58倍,但酶活收率分别只有10.70%和9.58%,30%~70%浓度硫酸铵所得沉淀的纯化倍数均小于1,纯化效果不好,而90%浓度硫酸铵沉淀的纯化倍数相对较高,为1.43倍,酶活收率达94.21%。综合考虑沉淀酶活收率和纯化倍数,确定硫酸铵浓度为90%作为分级沉淀的终浓度。
2.2.2 硫酸铵分级沉淀结果 在一级沉淀确定的初浓度和终浓度下,进行硫酸铵分级沉淀,并与一级沉淀结果进行对比,实验结果如表1所示。
由表1可知,采用20%~80%分级沉淀所得的酶活收率和纯化倍数均比一级沉淀的低,而采用90%一级沉淀所得酶纯化倍数最高,酶活收率仅降低0.36%。综合考虑酶活收率和纯化倍数,浓缩液一级沉淀使用90%硫酸铵所得结果最好。同时比较工厂精制酶,90%硫酸铵沉淀所得酶纯度是工厂酶的1.19倍,该精制酶代表工厂目前生产的最高水平,因此本工艺提取的酶在纯度上具有优越性。

表1 硫酸铵沉淀结果
2.2.3 硫酸铵沉淀酶液的电泳结果 在进行了硫酸铵一级和分级沉淀确定最优工艺后,为确定纯化效果,进行了不同处理酶的电泳实验,结果如图3所示。
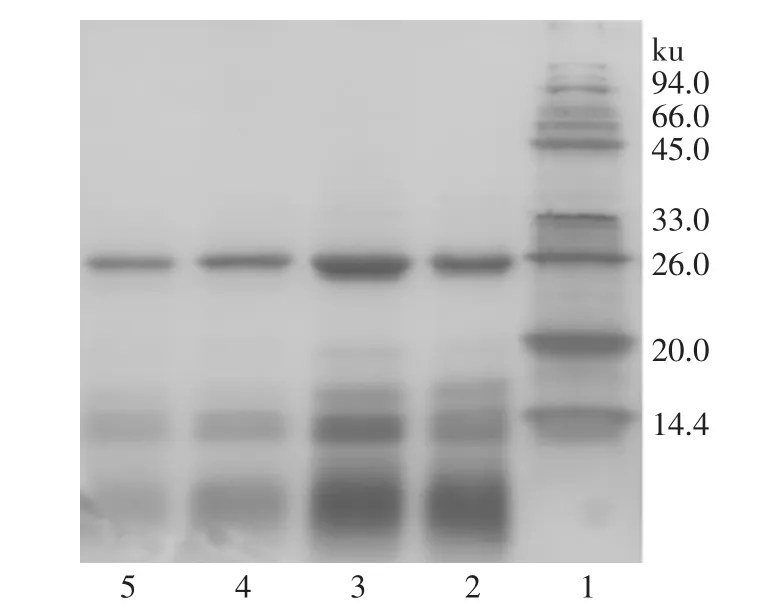
图3 浓缩液硫酸铵沉淀电泳图
由图3可知,菠萝茎原液中含有较多的杂蛋白;浓缩液80%和90%硫酸铵沉淀中,分子量大于目标蛋白的杂带已消失,分子量小于20ku的杂带也明显减少,这说明浓缩液经过硫酸铵沉淀后纯化效果明显。从电泳图上也可看出,浓缩液80%和90%硫酸铵沉淀所得酶纯度较工厂精制酶高,主要表现为分子量小于20ku杂带区域颜色较工厂精制酶浅,即该部分杂蛋白较少,说明采取浓缩后硫酸铵沉淀的方式确实使酶的纯度得到提高。
2.3 菠萝茎蛋白酶的纯化
为研究菠萝茎蛋白酶酶学性质,对其进一级分离纯化,制备纯酶。
2.3.1 Sephadex G-100柱层析纯化菠萝茎蛋白酶Sephadex G-100柱层析纯化结果如图4所示。
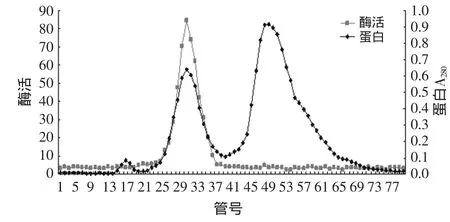
图4 菠萝茎蛋白酶Sephadex G-100柱层析图谱
由图4可知,采用Sepadex G-100柱层析后,得到3个蛋白峰,其中第二个蛋白峰具有酶活,而第一和第三个蛋白峰基本无酶活,说明菠萝茎蛋白酶与其它杂蛋白已基本分开。
2.3.2 DEAE-52离子交换柱层析纯化菠萝茎蛋白酶Sepadex G-100柱层析的酶活管经DEAE-52离子交换柱层析结果如图5所示。

图5 菠萝茎蛋白酶DEAE-52离子交换柱层析图谱
由图5可知,经DEAE-52离子交换柱层析后,菠萝茎蛋白酶只有一个酶活峰和一个蛋白峰,说明已实现了菠萝茎蛋白酶与其它杂蛋白分开。
2.3.3 SDS-PAGE电泳检验 经DEAE-52离子交换柱层析制得菠萝茎蛋白酶纯酶,为进一步考察验证酶分子的纯度,进行了电泳实验,实验结果如图6所示。

图6 菠萝茎蛋白酶纯酶电泳图
由图6可知,经纯化后所得菠萝茎蛋白酶纯度较高,在5%浓缩胶、12%分离胶电泳中表现出一条带,说明所得酶已达到电泳纯。同时,以相对迁移率对log分子量作图,求得菠萝茎蛋白酶分子量为24.5ku。
2.4 菠萝茎蛋白酶纯化表
为比较不同工艺下制得菠萝茎蛋白酶的优劣,绘制了纯化表,结果如表2所示。

表2 菠萝茎蛋白酶纯化表
由表2可知,随纯化倍数的提高,菠萝茎蛋白酶的酶活收率逐步降低。与工厂现有工艺相比,采用超滤浓缩和硫酸铵沉淀相结合的提取方法,酶活收率和纯化倍数均有较大提高,且工艺步骤相对简便,成本较低,符合工业上提取高活力菠萝蛋白酶的需要。而菠萝茎蛋白酶经Sephadex G-100柱层析和DEAE-52柱层析后,纯化倍数大大提高,该酶分子已达到电泳纯,虽经过该处理酶活收率大大降低,最终只有约25%左右,但该生产工艺可满足市场的不同需求,特别是医药用酶,因此若能将酶活收率的降低部分转嫁到产品的成本上,提高产品的附加价值,也存在很好的市场应用价值。
2.5 菠萝茎蛋白酶酶学性质研究
2.5.1 pH对菠萝茎蛋白酶活力的影响 进行了不同pH体系酶活力实验,结果如图7所示。

图7 菠萝茎蛋白酶最适反应pH
由图7可知,菠萝茎蛋白酶的最适反应pH在5~6之间,为弱酸性,这与林文光[13]研究结果一致。当pH小于5,即在较酸性环境下反应速度迅速降低;当pH>6,随着pH的增大,酶比活逐渐降低,相比酸性环境,在碱性环境中有一个较广的适应区间。
2.5.2 温度对菠萝茎蛋白酶活力的影响 进行了不同温度下的酶活力实验,结果如图8所示。

图8 菠萝茎蛋白酶最适反应温度
由图8可知,在一定范围内,随着温度的升高,酶的比活逐渐增大,在60℃时达到最大值,即此温度酶具有最大反应速度,这与赵武玲等[14]和章佩芬[15]报道的菠萝蛋白酶最适温度在55~65℃之间的结果大体一致。随后,当温度继续升高,酶的比活逐渐降低,这主要是因为高温会使酶的蛋白结构受到破坏、变性,以致酶活变小甚至失活。酶在反应中的最适温度实际上是酶反应速度与酶变性速度综合影响的结果[16]。在实际应用中,它与反应时间的长短有关,反应时间越长,测得的最适温度会有所降低。由此可见,菠萝茎蛋白酶的最适反应温度约为60℃。
2.5.3 金属离子对菠萝茎蛋白酶活力的影响 配制不同种类和浓度金属离子进行实验,结果如表3所示。
由表3可知,重金属离子如Cu2+、Fe2+、Pb2+等对菠萝茎蛋白酶活抑制较大,且随着浓度的增大迅速抑制酶活,这与易元龙[17]的研究结果一致;而Na+,K+,Ca2+则表现出不同程度的激活作用,这与P.Kaul,H.A.[18]等研究金属离子对木瓜蛋白酶的影响所得结果相一致。重金属离子对菠萝茎蛋白酶酶活基本表现出一种抑制作用,这主要由于菠萝蛋白酶是一种巯基蛋白酶,极易发生氧化反应,而多数金属离子又是氧化反应的催化剂,或直接与巯基有螯合作用,从而使酶活降低。因此,在生产应用过程中应尽量避免与金属离子接触。

表3 金属离子对菠萝茎蛋白酶酶活的抑制率(%)
3 结论
研究中采用微滤除杂、超滤浓缩和硫酸铵沉淀等方法组合分离纯化菠萝蛋白酶,采用超滤方式进行浓缩,一方面可以减少酶液的体积、硫酸铵的用量,同时降低了其对产品纯度的影响;另一方面,超滤也可达到一定纯化酶的效果,除去原液中一些分子量比目标酶小的分子。超滤浓缩法属物理分离手段,低温无相变,不易对酶活力产生影响。综合考虑产品质量和生产的实际问题,在工厂生产制备精制酶时,推荐采用超滤浓缩结合90%硫酸铵沉淀的方式对菠萝茎蛋白酶进行分离提取。
本实验改良工艺制得的菠萝蛋白酶酶学性质与有关报道的菠萝蛋白酶基本一致,最适反应pH在5~6之间,最适温度60℃,重金属离子如Cu2+、Fe2+、Pb2+等对菠萝茎蛋白酶活抑制较大,而Na+、K+、Ca2+则表现出不同程度的激活作用。
若实际生产过程对酶纯度要求非常高,特别是医药级别所需菠萝茎蛋白酶纯度较高,则需制备纯酶。本实验菠萝茎蛋白酶经Sephadex G-100柱层析和DEAE-52柱层析后,纯化倍数大大提高,分别为原液的1.83倍和1.91倍,电泳实验证实该酶分子达到电泳纯。
[1]舒肇甦,韩广勇,邓光仙.我国菠萝加工与综合利用现状[J].保鲜与加工,2006(3):4-7.
[2]李淑喜,黎新明.菠萝蛋白酶的提取及其在医药中的应用[J].广州化工,2009,37(2):52-53,57.
[3]王平诸,孙君社,李魁.菠萝蛋白酶三种生产工艺的比较[J].河南化工,2002(7):1-3.
[4]王平诸,杨辉,高孔荣,等.超滤浓缩提取菠萝蛋白酶的研究[J].食品与发酵工业,1993(5):33-37.
[5]曲延平.高活性菠萝蛋白酶提取技术取得新突破[J].果蔬加工,2006(4):46.
[6]曹红.大蒜蒜酶中试生产工艺、酶学性质及质量标准研究[D].乌鲁木齐:新疆医科大学,2008.
[7]丁凤平,H Noritomi,K Nagahama.超滤技术在碱性果胶酶浓缩工艺中的应用(英文)[J].膜科学与技术,2001(6):53-58.
[8]裴显庆.用考马斯亮蓝染色方法测定蛋白质含量[J].肉类研究,1990(1):36-37.
[9]施特尔马赫.酶的测定方法[M].钱嘉渊译.北京:中国轻工业出版社,1992:24.
[10]丁宵霖,朱雅东,罗磊.聚丙烯酰胺凝胶电泳研究猪血清蛋白硫酸铵分级盐析[J].食品科学,2006,27(2):218-222.
[11]马超,宋烨,吴茂玉,等.菠萝蛋白酶的研究及应用进展[J].食品科技,2008(8):17-20.
[12]高娃.硫酸铵的盐析作用[J].内蒙古教育学院学报:自然科学版,2000,12(3):45-46.
[13]林文光,邹建云.菠萝果皮蛋白酶的活性研究[J].云南热作科技,1997,20(2):7-11.
[14]赵武玲.果实菠萝蛋白酶的动力学研究[J].中国农业大学学报.1999,4(1):11-13.
[15]章佩芬,陈敏华,郭利平.菠萝蛋白酶应用的性质研究[J].广州食品工业科技,2002,18(2):16-17.
[16]李明春,陈创业,蔡振元.菠萝蛋白酶的基本性质研究[J].华侨大学学报:自然科学版,1999,13(1):75-80.
[17]易元龙,李媚,谢涛,等.菠萝果浸提液中菠萝蛋白酉每的稳定性研究[J].广西民族大学学报:自然科学版,2008,14(4):76-78.
[18]P Kaul,H A Sathish,V Prakash.Effect of metal ions on structure and activity of papain from Carica papaya[J].Nahrung/Food,2002,46(1):2-6.
Study on improvement of industrial extraction of bromelain and its enzymology characterization
WANG Yan,ZHAO Li-chao,CHEN Jie-lan,LIU Xiao-juan,LIU Xin*
(College of Food Science,South China Agricultural University,Guangzhou 510642,China)
A industrial production process for extraction of bromelain was studied.First,the concentrate of bromelain was enriched from the pineapple stalks by the ways of microfiltration and ultrafiltration.And then,the enzyme extracts were precipitated by the ammonium sulfate precipitation.Last,the bromelain was dehydrated by the vacuum freeze drying.On the basis of these,the high purity of bromelain was produced by the Sephadex G-100 and DEAE-52 ion column chromatography and its characterization was studied.The results showed that after the front process,1.44-fold purified bromelain was achieved,which purity than the old process was 1.19 times.The high purity of bromelain that was produced by the Sephadex G-100 and DEAE-52 ion column chromatography could reach the electrophoresis pure.This purified bromelain can satisfy the demand in medical treatment field,so it had higher market value.And the result of the characterization of this bromelain was consistent with earlier reports.The optimum pH and temperature of the purified enzyme were 5~6 and 60℃.The purified enzyme was inhibition by heavy metal ions such as Cu2+,Fe2+,Pb2+,and activation by the Na+,K+,Ca2+.
bromelain;extraction;purification;enzymology characterization
TS255.1
B
1002-0306(2011)10-0353-05
2010-10-08 * 通讯联系人
王燕(1987-),女,硕士研究生,研究方向:食品科学。

