真空浓缩对枸杞营养成分的影响
魏 苑,张盛贵
(甘肃农业大学食品科学与工程学院,甘肃兰州 730070)
真空浓缩对枸杞营养成分的影响
魏 苑,张盛贵*
(甘肃农业大学食品科学与工程学院,甘肃兰州 730070)
对鲜枸杞进行真空浓缩处理,并测定浓缩前后黄酮、枸杞多糖、类胡萝卜素、总酸和总糖的含量,进行分析比较,结果表明:浓缩后黄酮的保存率为107.34%,略有增加;总酸和总糖的保存率分别为82.61%、75.33%,有一定程度的降低;枸杞多糖、类胡萝卜素的保存率分别为25.26%、26.80%,降低较为明显。说明真空浓缩工艺对枸杞中黄酮含量影响不大,对总酸、总糖含量影响较小,而对枸杞中类胡萝卜素及枸杞多糖含量有较大的影响。
枸杞,浓缩,营养成分
枸杞为茄科植物,是落叶的小灌木,含有丰富的营养成分和药理活性成分,素有“红宝”之称,其果、花、叶、皮、根均可入药,是珍贵的中药材和滋补保健食品,具有滋补肝肾、益精明目等功能,用于眩晕耳鸣、腰膝酸痛、内热消渴、目昏不明等[1-3]。枸杞的化学成分主要包括枸杞多糖、甜菜碱、类胡萝卜素及类胡萝卜素酯、维生素C、多种氨基酸及多种微量元素等[4]。研究表明,黄酮类化合物作为一种功效成分,具有生物抗氧化性、抗衰老、抗癌、抗菌、免疫调节、止咳、平喘、祛痰之功效以及降低胆固醇等功效[5-8]。枸杞多糖具有保护肝脏、降血糖、降血脂、抗衰老、抗肿瘤、调节免疫力、抗突变以及抗疲劳等作用[9-12]。枸杞还富含类胡萝卜素,类胡萝卜素可医治维生素缺乏症、皮肤病、抗光敏症、气管炎、慢性咽炎等疾病,同时还具有抗氧化等作用[13-14]。在食品加工中,一些液态原料或半成品,如果蔬汁及牛奶等,一般都含有大量的水分(75%~90%),而有营养价值的物质如果糖、有机酸、维生素、盐类、果胶等只占5%~ 10%,这些物质对热敏感性都很强。在生产中为了便于储藏运输或作为其他工序的预处理,往往要进行浓缩处理,从而达到减少体积、提高产品贮藏性、降低产品的加工热耗等目的[15-16]。真空浓缩的优点是温度低、速度快、生产成本低、效率高,可以防止不耐热的成分被破环[17-18]。同时由于物料温度低,营养成分的损失相对减低,对热敏性食品有利。本实验通过对枸杞真空浓缩后几种营养成分包括枸杞多糖、类胡萝卜素、黄酮、总酸和总糖含量的测定,并对比分析,研究真空浓缩工艺对枸杞中几种营养成分含量的影响,为今后枸杞进一步深加工提供理论依据。
1 材料与方法
1.1 材料与仪器
鲜枸杞 产自甘肃省景泰县;无水乙醇、亚硝酸钠、硝酸铝、氢氧化钠、芦丁标准品、硫酸、蒽酮、葡萄糖、石油醚、丙酮、氢氧化钠、酚酞、硫酸铜、次甲基蓝、酒石酸钾钠、亚铁氰化钾、乙酸锌、冰乙酸、甲基红、葡萄糖 以上均为分析纯。
7202B可见分光光度计 尤尼柯(上海)仪器有限公司;AL104型电子天平 梅特勒-托利多仪器(上海)有限公司;DXNSG型单效真空浓缩锅 新疆疆宁轻工机械工程技术有限公司;HH-S24型数显恒温水浴锅 金坛市大地自动仪器厂;DF-Ⅱ型集热式磁力搅拌器 金坛市顺华仪器有限公司;SHZ-D (Ⅲ)循环水式真空泵 巩义市予华仪器有限责任公司;PAL-α型手持数显糖度计 日本ATAGO。
1.2 实验方法
1.2.1 工艺流程 鲜枸杞→预处理→打浆、护色→真空浓缩→包装→密封→杀菌→冷却→成品
1.2.1.1 打浆、护色 将原料打浆榨汁后,加入0.4%异抗坏血酸钠进行护色。
1.2.1.2 浓缩前样品处理 打浆、护色后,取一部分浓缩前样品于0~4℃条件下密封保存,待测。
1.2.1.3 真空浓缩条件 真空度为65~75kPa、浓缩温度55~60℃、浓缩时间3~5h。
1.2.2 可溶性固形物的测定 采用PAL-α型手持数显糖度计测定,测定不同浓缩处理前后样品中可溶性固形物含量。
1.2.3 黄酮的测定 参考孔令明等[19]方法并改进。准确称取一定量的样品,置于三角瓶中,加入75%乙醇溶液35mL,于70℃水浴中回流提取2.5h。取出冷却后过滤,滤液置于50mL容量瓶中,并用少量75%乙醇溶液洗涤滤渣,合并滤液,用75%乙醇溶液定容至刻度,待测。吸取上述待测液10mL置于25mL容量瓶中,加入75%乙醇溶液至12.5mL,分别加入5%亚硝酸钠溶液0.7mL,摇匀后放置5min,加入10%硝酸铝溶液0.7mL,摇匀后放置6min,加入1.0mol/L氢氧化钠溶液5mL,用75%乙醇溶液定容至刻度,以蒸馏水代替样液作空白,放置15min后,于510nm处测定吸光度。
标准曲线绘制∶准确吸取0.2g/L芦丁标准溶液0、1.00、3.00、5.00、6.00、8.00mL,相当于芦丁0、200、600、1000、1200、1600μg,转入25mL容量瓶中,加入75%乙醇溶液至12.5mL,分别加入5%亚硝酸钠溶液0.7mL,摇匀后放置 5min,加入 10%硝酸铝溶液0.7mL,摇匀后放置6min,加入1.0mol/L氢氧化钠溶液5mL,用75%乙醇溶液定容至刻度,以零管作空白,放置15min后,于510nm处测定吸光度,绘制标准曲线。
1.2.4 枸杞多糖的测定 准确称取一定量的样品,置于圆底烧瓶中,加入80%乙醇溶液200mL,于80℃水浴中回流提取1h。趁热过滤,残渣用80%热乙醇溶液洗涤数次,残渣连同滤纸置于烧瓶中,加蒸馏水100mL,于80℃水浴中回流提取1h,趁热过滤,残渣用热蒸馏水洗涤数次,洗液并入滤液,冷却后移入250mL容量瓶中,用水定容,待测[20]。
吸取上述待测液2.0mL置于25mL具塞试管中,在冰水浴中加入2g/L蒽酮-硫酸溶液4mL,摇匀,置于沸水中加热煮沸5min,取出后用流动水冷却,室温放置8min,以蒸馏水代替样液作空白,于625nm处测定吸光度。
标准曲线绘制∶精密称取经105℃干燥恒重的标准葡萄糖0.1g(精确到0.0001g),加水溶解并定容至1000mL,即得100μg/mL葡萄糖标准溶液。精密吸取此标准溶液0、0.1、0.3、0.5、0.7、0.9mL分别置于25mL具塞试管中,各加蒸馏水使体积为2.0mL,在冰水浴中加入一定量的2g/L蒽酮-硫酸溶液,摇匀,置于沸水中加热煮沸5min,取出后用流动水冷却,室温放置8min,以蒸馏水代替样液作空白,于625nm处测定吸光度,绘制标准曲线。
1.2.5 类胡萝卜素的测定 参考李赫等[21]方法并改进。准确称取一定量的样品,置于棕色瓶中,加入提取剂(石油醚∶丙酮=2∶1)15mL,同时加入0.1%BHT,加塞放置35℃磁力搅拌器中暗处提取1h,取出用无水硫酸钠过滤,按上述步骤重复提取2次,过滤,用提取剂定容至50mL,待测。上述待测液于451nm[22]处测定吸光度,以提取溶剂作空白对照。
1.2.6 总酸的测定[23]按GB/T 12456-2008中的方法测定。
1.2.7 总糖的测定[20]按GB/T 18672-2002中的方法测定。
2 结果与分析
测定浓缩前后总可溶性固形物含量,结果见表1。由表 1可知,浓缩前可溶性固形物含量为16.35%,浓缩后可溶性固形物含量为64.70%,果酱浓缩倍数为3.96,本实验以可溶性固形物为参照,分析真空浓缩对枸杞中黄酮、枸杞多糖、类胡萝卜素、总酸、总糖的影响。

表1 浓缩前后可溶性固形物的测定结果
2.1 浓缩对枸杞中黄酮的影响
以芦丁为标样,测定枸杞中黄酮的含量。芦丁标准曲线见图1,得回归方程∶y=0.0004x+0.0073,R2=0.9989。

图1 芦丁标准曲线
测定浓缩前后黄酮含量(结果见表2)表明,浓缩前和浓缩后枸杞中黄酮含量分别为50.45mg/100g和214.45mg/100g,浓缩后黄酮含量为浓缩前的 4.25倍;以可溶性固形物含量16.35%计,浓缩后黄酮含量为54.15mg/100g,保存率为107.34%,说明真空浓缩对枸杞中黄酮含量影响不大。这可能是真空浓缩工艺温度不高,且浓缩后枸杞酱中含糖量高,降低了制品中氧气含量,从而降低了黄酮被氧化的程度,同时黄酮与其他活性成分相比有较好的稳定性,因此真空浓缩对黄酮没有造成很大的影响。
2.2 浓缩对枸杞中枸杞多糖的影响
以葡萄糖为标样,测定枸杞多糖含量,葡萄糖标准曲线如图2,得回归方程∶y=0.0081x+0.0043,R2=0.9985。
浓缩前后枸杞多糖含量(见表3)分别为0.95g/100g和0.97g/100g,浓缩后枸杞多糖含量为浓缩前的1.02倍;以可溶性固形物含量16.35%计,浓缩后多糖含量为0.24g/100g,保存率为25.26%,表明真空浓缩会造成枸杞中多糖含量明显降低。这可能是枸杞多糖不耐热和酸,在一定温度下长时间加热,使多糖分解,同时浓缩使水分大量蒸发,造成果酱中酸含量升高,多糖在酸的作用下水解,导致其含量下降;并且枸杞多糖在加工过程中易发生变性,形成大量絮状物和沉淀物,造成有效成分的大量损失[24]。

表2 浓缩前后黄酮的测定结果

表3 浓缩前后枸杞多糖的测定结果

表4 浓缩前后类胡萝卜素的测定结果

表5 浓缩前后总酸的测定结果

表6 浓缩前后总糖的测定结果
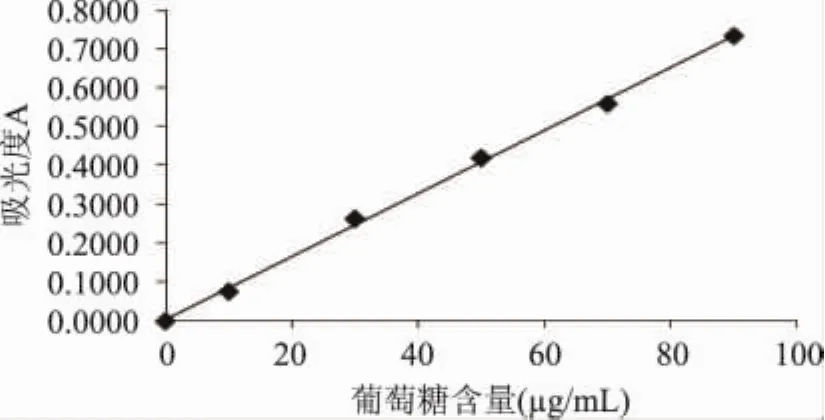
图2 葡萄糖标准曲线
2.3 浓缩对枸杞中类胡萝卜素含量的影响
浓缩前和浓缩后枸杞中类胡萝卜素含量分别为54.56mg/100g和57.91mg/100g,浓缩后类胡萝卜素的含量为浓缩前的1.06倍(见表4),以可溶性固形物含量 16.35%计,浓缩后类胡萝卜素含量为14.62mg/100g,保存率为26.80%,说明真空浓缩工艺使枸杞中类胡萝卜素的含量有较大程度的下降。这是由于枸杞在打浆的过程中组织破碎,使细胞中所含的胡萝卜素暴露在空气中。由于胡萝卜素分子结构中,含有许多不饱和双键,在有氧状态下,易发生自动氧化反应,是导致类胡萝卜素降解的主要原因。其次,枸杞在组织破碎时,各种氧化酶,尤其是脂肪氧化酶加速了类胡萝卜素的氧化降解。再者,在浓缩的过程中,在一定温度下长时间处理,使类胡萝卜素发生氧化而损失[25]。
2.4 浓缩对枸杞中总酸含量的影响
浓缩前和浓缩后枸杞中总酸含量分别为0.69g/ 100g和2.26g/100g,浓缩后总酸含量为浓缩前的3.28倍(见表5),以可溶性固形物含量16.35%计,浓缩后总酸含量为0.57g/100g,保存率为82.61%,结果表明真空浓缩使枸杞中的总酸含量略有下降。原因可能是浓缩过程中部分挥发性酸挥发,造成其含量下降。
2.5 浓缩对枸杞中总糖含量的影响
浓缩前和浓缩后枸杞中总糖含量分别为13.01g/ 100g和38.81g/100g,浓缩后总糖的含量约为浓缩前的2.98倍(见表6),以可溶性固形物含量16.35%计,浓缩后总糖含量为 9.80g/100g,保存率为75.33%,说明真空浓缩工艺对枸杞中总糖的含量有一定程度的影响。这可能是因为浓缩后制品中还原糖或羰基化合物及蛋白质的含量增高,这些官能团之间发生了美拉德反应,导致糖的损失及色泽的变化,降低了食品的营养价值。
3 结论
本文通过对浓缩前后枸杞中黄酮、枸杞多糖、类胡萝卜素、总酸、总糖含量的测定,研究了真空浓缩工艺对枸杞中几种营养成分的影响。实验结果表明,浓缩后黄酮的保存率为107.34%,真空浓缩后枸杞中黄酮略有增加;浓缩后枸杞多糖、类胡萝卜素保存率分别为25.26%、26.80%,说明真空浓缩对枸杞多糖、类胡萝卜素有较大的影响;而浓缩后总酸、总糖保存率为82.61%、75.33%,说明真空浓缩工艺对枸杞中总酸和总糖有一定程度的影响。
[1]张云霞,王萍,刘敦华.枸杞活性成分的研究进展[J].农业科学研究,2008,29(2):79-83.
[2]薛立文,李以暖.枸杞子的营养和保健功能[J].广东微量元素科学,2000:7(6):1-4.
[3]沈学英,蒋亚生.枸杞子药理研究进展[J].时珍国医国药,1999,10(10):798-799.
[4]张连福,吉宏武,任顺成.药食兼用资源与生物活性成分[M].北京:化学工业出版社,2005:171.
[5]郑国琦,胡正海.宁夏枸杞的生物学和化学成分的研究进展[J].中草药,2008,39(5):796.
[6]于晶,郝再彬,苍晶,等.黄酮类化合物的活性研究进展[J].东北农业大学学报,2008,39(12):125-130.
[7]肖坤福,廖晓峰.黄酮类化合物研究进展及应用[J].食品研究与开发,2003,24(4):13-17.
[8]FEDERICO DAJAS,FELICIARIVERA,FERNANDABLASINA,et al.Cell Culture Protection and in vivo Neuroprotective Capacity of Flavonoids[J]Neurotoxicity Research,2003,5(6):425-432.
[9]周晶,李光华.枸杞的化学成分与药理作用研究综述[J].辽宁中医药大学学报,2009,11(6):93-95.
[10]LONG-GUO YUAN,HONG-BIN DENG,LI-HUI CHEN,et al.ReversalofApoptotic Resistance by Lycium barbarum Glycopeptide 3 in Aged T Cells[J].BiomedicalAnd Environmental Sciences,2008,21:212-217.
[11]霍超,徐桂花.枸杞生理功效和活性成分的研究进展[J].中国食品与营养,2007(11):50-53.
[12]毛根年,许牡丹.功能食品生理特性与检测技术[M].北京:化学工业出版社,2005:56-58.
[13]李洋,徐雅琴.超声波法提取沙棘中类胡萝卜素条件的优化[J].食品科技,2008(1):137-139.
[14]李福枝,刘飞,曾晓希,等.天然类胡萝卜素的研究进展[J].食品工业科技,2007,28(9):227-232.
[15]卢蓉蓉,张文斌,夏书芹.食品科学导论[M].北京:化学工业出版社,2008:76-78.
[16]刘学文.食品科学与工程导论[M].北京:化学工业出版社,2007:64.
[17]刘静波,林松毅,夏文水.功能食品学[M].北京:化学工业出版社,2008:82.
[18]李影,袁身淑.乌龙茶汁的浓缩工艺对其香气成分的影响[J].食品与发酵工业,2002(9):10.
[19]孔令明,李芳,苏兴成.枸杞中黄酮类化合物的提取研究[J].食品研究与开发,2008,29(8):45-48.
[20]宁夏农林科学院农副产品贮藏加工研究所,等.GB/T 18672-2002枸杞(枸杞子)[S].北京:中国标准出版社,2002.
[21]李赫,陈敏,马文平.不同成熟期枸杞中类胡萝卜素含量的变化规律[J].中国农业科学,2006,39(3):599-605.
[22]何照范,张迪清.保健食品化学及其检测技术[M].北京:中国轻工业出版社,1998:91.
[23]中国食品发酵工业研究院.GB/T 12456-2008食品中总酸的测定[S].北京:中国标准出版社,2008.
[24]吴素萍,徐建宁.酶法提取枸杞多糖的研究[J].食品科技,2007(8):115.
[25]黄梅丽,王俊卿.食品色香味化学[J].中国轻工业出版社,2008(3):32-34.
Effects of the nutritional components of Lycium barbarum by vacuum concentration
WEI Yuan,ZHANG Sheng-gui*
(College of Food Science and Engineering,Gansu Agricultural University,Lanzhou 730070,China)
The effect of vacuum concentration on fresh Lycium barbarum,and determination of content of the flavonoids,LBP,carotenoids,total acid and total sugar before and afere concentration were analyzed and compared.The results showed that:the preservation of concentrated flavonoids was 107.34%,with a slight increase,while the total acid and total sugar were slightly decreased,they were 82.61%and 75.33%,but the preservation rates of LBP and carotenoids were 25.26%and 26.80%,decreased obviously.This showed the vacuum concentration process had little effect both on the flavonoid content of Lycium barbarum and on the total acid and total sugar content,but had much impact on the carrot and LBP in Lycium barbarum.
Lycium barbarum;concentration;nutritional components
TS201.4
A
1002-0306(2011)11-0394-04
2010-09-15 *通讯联系人
魏苑(1983-),女,硕士研究生,主要从事农产品加工与贮藏研究。
国家科技部支撑计划项目(2007BAD52B07)。

