超声提取西洋参叶多糖工艺及稳定性研究
黄伟敏,南 江,王 星,穆小燕,季晓晖
(陕西理工学院化学与环境科学学院,陕西汉中 723000)
超声提取西洋参叶多糖工艺及稳定性研究
黄伟敏,南 江,王 星,穆小燕,季晓晖*
(陕西理工学院化学与环境科学学院,陕西汉中 723000)
以不同的超声波功率、超声波频率、提取温度以及提取时间等为条件对西洋参叶多糖的提取工艺进行研究,并对多糖在不同温度、pH、氧化还原剂、食品添加剂和金属离子等条件下的稳定性进行研究。实验结果表明,西洋参叶多糖的最佳提取条件为:功率700W,频率100kHz,温度70℃,超声时间60min;西洋参叶多糖对温度的稳定性较差,在碱性、氧化还原剂、VC、柠檬酸、Na+、Fe3+、Al3+等溶液中的稳定性较差,在酸性、苯甲酸钠溶液中的稳定性较好。
西洋参叶,多糖,超声波,提取,稳定性
西洋参(Panax quinquefolius),又名西洋人参、洋参、花旗参、广东人参,为五加科植物。西洋参原产于美国、加拿大及法国,我国亦有栽培。西洋参味苦,性凉,入心、肺、肾经,功能以补益为主,可滋阴降火、益气生津,临床常用于肺虚久咳、咳喘、咯血、热病伤阴、口渴咽干、少津、虚火烦倦、胃火牙痛等多种病症,西洋参叶中富含抗癌物质,营养物质以及多糖类。多糖是由多个单糖分子缩合失水而成,是一类分子结构复杂且庞大的糖类物质[1]。大量研究表明∶多糖除具有免疫调节,抗肿瘤生物学效应外,还有抗衰老、降血糖、抗凝血等作用,且对机体副作用小[2]。目前,多糖已经是功能性食品研究的热点之一。有文献[3]报道西洋参叶多糖具有抗疲劳,防辐射,降血糖,降血脂等功效。本文对西洋参叶多糖的超声波[4]提取及多糖稳定性进行探究。
1 材料与方法
1.1 材料与仪器
西洋参叶 采自于陕西汉中留坝县,阴干粉碎,过40目筛,经石油醚和乙醇回流脱脂脱色后干燥备用;蒽酮、浓硫酸、石油醚、无水乙醇、氯仿、正丁醇、葡萄糖、双氧水、无水亚硫酸钠、盐酸、氢氧化钠、抗坏血酸、苯甲酸钠、柠檬酸、氯化铜、氯化钴、氯化镍、氯化钾、氯化钠、氯化铝、氯化铁 均为分析纯;自制蒸馏水、超纯水。
电热恒温鼓风干燥箱 上海森信实验仪器有限公司;粉碎机 天津市泰斯特仪器有限公司;电热恒温水浴锅 北京科伟永兴仪器有限公司;SHZ-D循环水式真空泵 巩义市英峪予华仪器厂;AL204-IC型电子分析天平 梅特勒-托利多仪器上海有限公司;pHS-3S型pH酸度计 亿通电子有限公司;T6新世纪紫外分光光度计 北京普析通用仪器有限责任公司;KQ-700VDE型三频数控超声波清洗器 昆山市超声仪器有限公司;旋转蒸发器 上海亚荣生化仪器厂。
1.2 实验方法
1.2.1 提取方法 提取的工艺流程为∶西洋参叶→阴干→粉碎→石油醚、乙醇热回流脱脂脱色→超声波提取→蒸发浓缩→乙醇沉淀过夜→Savage法除去游离蛋白→乙醇沉淀低温干燥→多糖
1.2.2 标准曲线的绘制 分别取1mg/mL的标准葡萄糖溶液0、2.0、4.0、6.0、8.0、10.0mL于50mL容量瓶用水定容,各取2mL于具塞试管中,再分别加入8mL蒽酮-硫酸溶液,然后浸入沸水浴中15min,取出冷却,在620nm处测量吸光度,以吸光度(A)为纵坐标,葡萄糖的质量浓度C(μg/mL)为横坐标,绘制标准曲线(图1),得到回归方程∶
A=0.0342C-0.004,r=0.9992
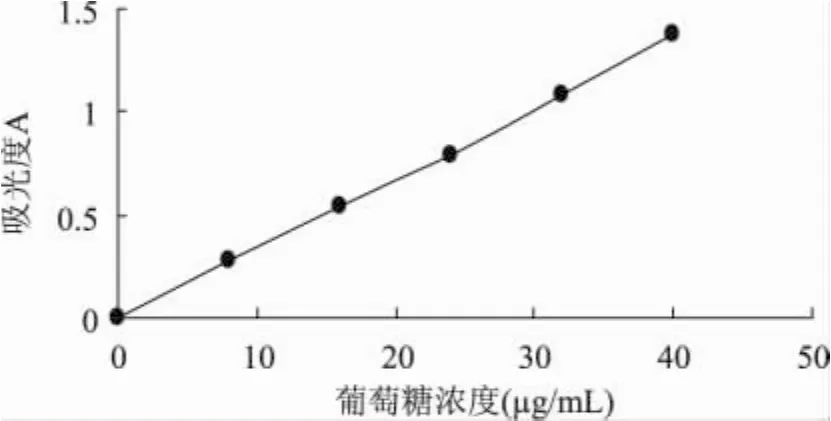
图1 葡萄糖质量浓度测定标准曲线
1.2.3 西洋参叶多糖含量的测定 取2mL西洋参叶的多糖提取稀释液,加入8mL蒽酮硫酸溶液,其他操作同1.2.2,在620nm处测其吸光度,平行三次。
1.2.4 西洋参叶多糖的测定方法及转化因子的计算
采用蒽酮硫酸法[5]。由公式C2/C1=K(A2/A1)可以得出∶K=3.087(C1为葡萄糖浓度;C2为多糖浓度;A1,A2分别对应为葡萄糖和多糖溶液的吸光度; K为葡萄糖和多糖之间的转化因子)。
西洋参叶多糖的提取率(%)=(多糖的浓度×稀释倍数×10-6)/样品干重×100%。
1.2.5 西洋参叶多糖提取的单因素实验
1.2.5.1 不同超声功率对多糖提取的影响 取1.0g西洋参叶粉末样品加30mL蒸馏水,利用超声波在超声频率100kHz、提取温度60℃、提取时间40min的条件下,分别研究不同的超声功率(280、420、560、700W)对西洋参叶多糖提取效果的影响,重复三次,计算提取率。
1.2.5.2 不同超声频率对多糖提取的影响 取1.0g西洋参叶粉末样品加30mL蒸馏水,利用超声波在超声功率700W、提取温度60℃、提取时间40min的条件下,分别研究不同的超声频率(45、80、100kHz)对西洋参叶多糖提取效果的影响,重复三次,计算提取率。
1.2.5.3 不同温度对多糖提取的影响 取1.0g西洋参叶粉末样品加30mL蒸馏水,利用超声波在超声功率700W、超声频率100kHz、提取时间40min的条件下,分别研究不同的提取温度(40、50、60、70、80℃)对西洋参叶多糖提取效果的影响,重复三次,计算提取率。
1.2.5.4 不同提取时间对多糖提取的影响 取1.0g西洋参叶粉末样品加30mL蒸馏水,利用超声波在超声功率700W、超声频率100kHz、提取温度60℃的条件下,分别研究不同的提取时间(20、40、60、80、100min)对西洋参叶多糖提取效果的影响,重复三次,计算提取率。
1.2.6 正交实验 在单因素实验基础上,以超声频率、输出功率、提取温度和时间为因素,设计L9(34)实验来确定西洋参叶多糖的最佳提取工艺。
1.2.7 西洋参叶多糖的稳定性实验
1.2.7.1 温度对西洋参叶多糖的影响 取4mL的多糖溶液6份,分别在30、40、50、60、70、80℃下保温1h,保温时应采用避光处理,加16mL的蒽酮-硫酸溶液,待冷却后,测量多糖在620nm处的吸光度。
1.2.7.2 pH对西洋参叶多糖的影响 取8mL的西洋参叶多糖6份,于室温下用0.1mol/L HCl和0.1mol/L NaOH调pH为2.0、4.0、6.0、8.0、10.0、12.0,摇荡,避光处理2h,每份取出4mL,各加入16mL的蒽酮-硫酸溶液,待冷却后,测量多糖在620nm处的吸光度。
1.2.7.3 常见食品添加剂对西洋参叶多糖的影响
取8mL的西洋参叶多糖3份,分别加入2.0mL食品添加剂(VC、柠檬酸、苯甲酸钠等物质的溶液,浓度均为0.05mol/L),混匀后避光放置5h,每份取出4mL,各加入16mL的蒽酮-硫酸溶液,冷却后,测量多糖在620nm处的吸光度。
1.2.7.4 氧化还原剂对西洋参叶多糖的影响 取8.0mL的西洋参叶多糖溶液6份,分别依次加入浓度为0.03、0.04、0.05mol/L的H2O2和浓度依次为0.03、0.04、0.05mol/L的Na2SO3溶液各2.0mL,摇荡避光静置2h,每份取出4mL各加入16mL的蒽酮-硫酸溶液,待冷却后,测量多糖在620nm处的吸光度。
1.2.7.5 金属离子对西洋参叶多糖的影响 取8mL的西洋参叶多糖3份,依次分别加入0.05mol/L的NaCl、KCl、AlCl3、FeCl3、CuCl2、CoCl2、NiCl2等溶液2mL,摇匀避光静置3h,每份取出4mL,各加入16mL的蒽酮-硫酸溶液,冷却后,测量多糖在620nm处的吸光度。
2 结果与分析
2.1 单因素实验结果
2.1.1 超声功率对西洋参叶多糖的影响 从图2可看出,在功率280~700W之间,多糖提取率是随功率的变大而略显增加的趋势,开始时增加的速度比较快,420W到560W之间出现了一平台,之后提取率又逐渐升高,增加速度略有降低。700W时的提取率明显较高,所以选用功率700W为最佳。
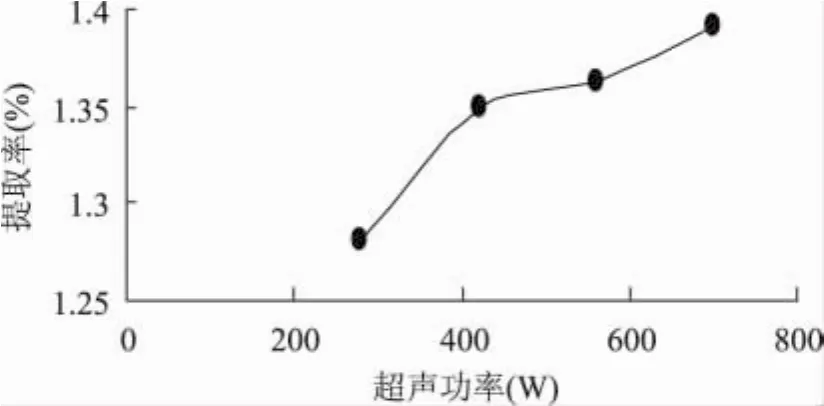
图2 超声波功率对多糖提取率的影响
2.1.2 超声频率对西洋参叶多糖的影响 由图3可知,多糖提取率随着超声波频率的增大而显著变大,100kHz时的多糖提取率远远高于45kHz和80kHz的。因此,在本实验的条件下(最大频率为100kHz)超声的最佳频率选取100kHz为宜。
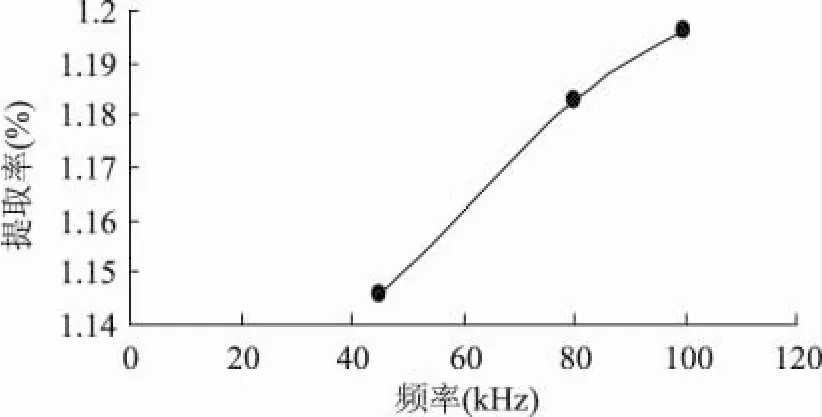
图3 超声波频率对多糖提取率的影响
2.1.3 温度对西洋参叶多糖的影响 由图4可知,温度较低时多糖的提取率较小,开始阶段随着温度的升高,多糖的提取率增大,当温度为60~70℃时,提取率的值出现平缓的趋势,而过后随着温度的升高,多糖的提取率开始减小,说明温度越高对细胞的破坏作用越大,有利于多糖的浸出,但温度过高可能会导致多糖的转化,反而不利于提取。因此,超声的最佳温度选取60℃左右。
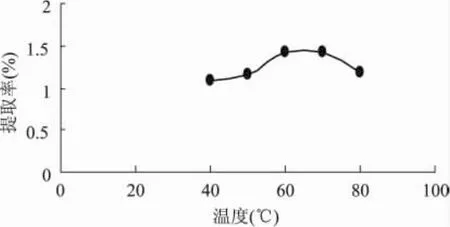
图4 提取温度对多糖提取率的影响

图5 时间对多糖提取率的影响
2.1.4 超声时间对西洋参叶多糖的影响 由图5可见,开始阶段多糖吸光度随时间的延长而增大,直到时间为60min时西洋参叶多糖的提取率最大,再延长超声提取时间,吸光度反而会出现下降的趋势,以致最后曲线趋于平稳,说明提取时间过长,多糖可能发生转化。因此,西洋参叶多糖的超声提取时间选择60min左右时效果较好。
2.2 正交结果与分析
由表1、表2可见,影响西洋参叶多糖提取的因素∶频率>温度>提取时间>超声波功率,其中频率达到显著水平,是在该实验设计条件下影响多糖提取的主要因素。适宜的提取条件是A3B3C2D2,即超声波功率700W、频率100kHz、温度70℃和提取时间60min。
2.3 多糖的稳定性
2.3.1 温度对西洋参叶多糖的影响 表3表明,在50℃以下,热处理对多糖的吸光度影响不大。但在60℃以上,温度对多糖的吸光度影响较大。由此看出,西洋参叶多糖在低温条件下比较稳定,在较高温度可能有一部分分解或转化,不太稳定。
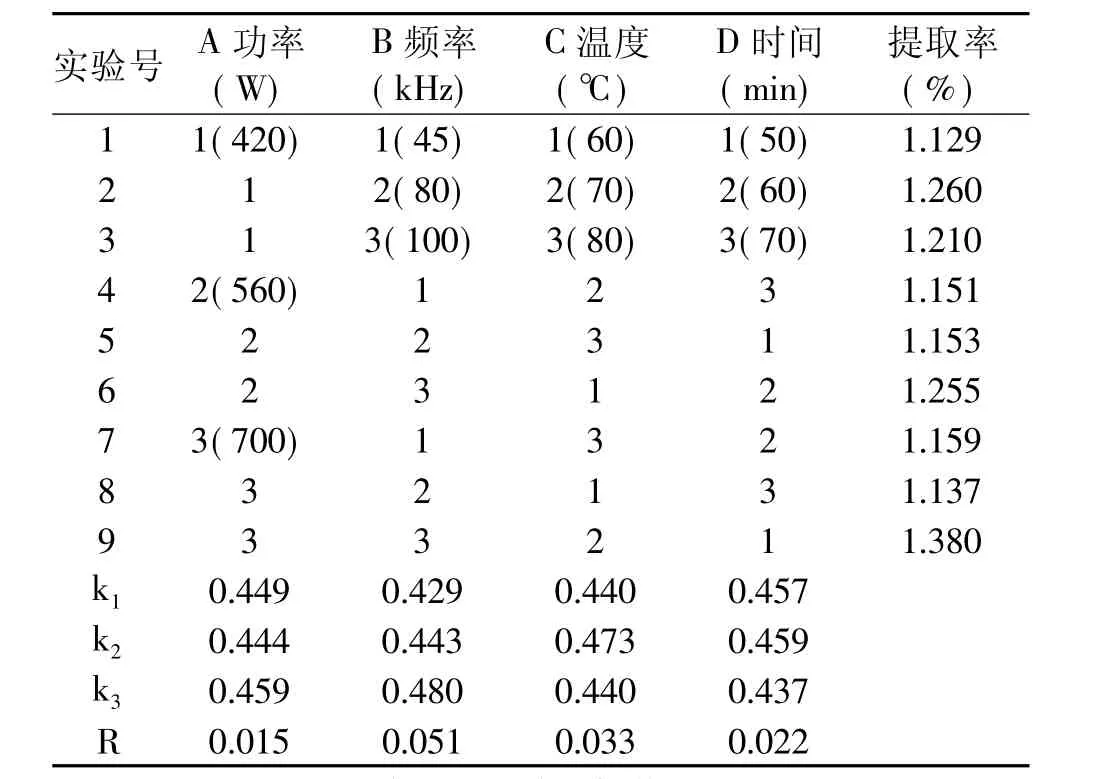
表1 西洋参叶多糖提取条件的正交实验结果
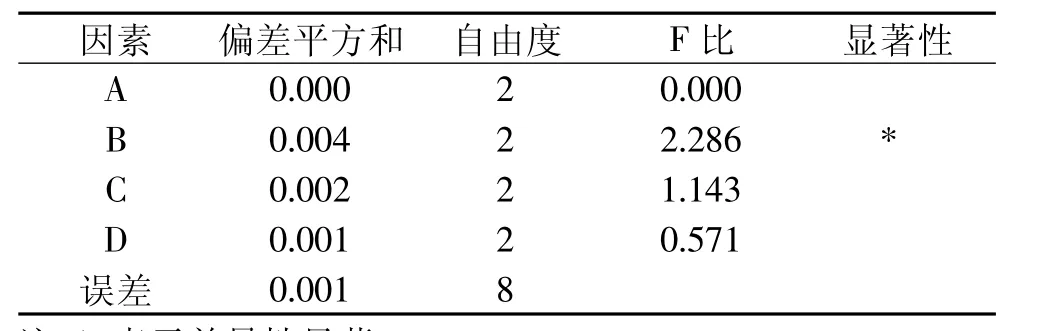
表2 方差分析统计

表3 温度对多糖稳定性的影响
2.3.2 pH对西洋参叶多糖的影响 从图6可以看出,在酸性条件下,多糖的吸光度基本保持不变,趋于平稳,而碱性条件下,受的影响较大,随着碱性的增强,多糖的吸光度随之增大。由此表明,西洋参叶多糖在酸性介质中比较稳定,在碱性介质中受的影响较大。

图6 pH对多糖稳定性的影响
2.3.3 食品添加剂对西洋参叶多糖的影响 由表4可以看出苯甲酸钠的加入对多糖的影响不大,VC的加入导致吸光度明显增大,说明其对西洋参叶多糖的影响很大,柠檬酸对多糖的影响也较为严重。

表4 常见食品添加剂对色素的影响效果
2.3.4 氧化还原剂对西洋参叶多糖的影响 从表5可知,随着氧化还原剂加入浓度的变大,多糖吸光度也随着变大,说明西洋参叶多糖的抗氧化性和抗还原性都比较弱,其对西洋参叶多糖的稳定性有一定的影响。
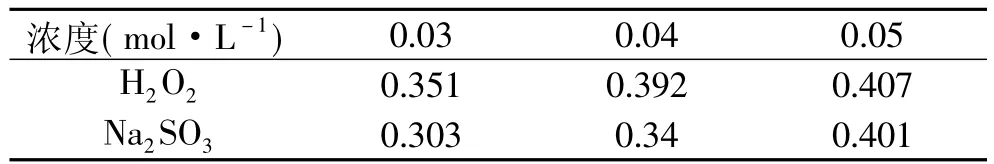
表5 氧化还原剂对色素稳定性的影响
2.3.5 金属离子对西洋参叶多糖的影响 由图7可以看出,除了Fe3+、Al3+离子使色素吸光度有一定程度的上升,Na+离子对色素吸光度有降低作用,其余离子对多糖的稳定性影响不大,说明色素在此条件下可能与Na+、Fe3+、Al3+离子发生了化学反应,其对色素的稳定性有一定的影响。
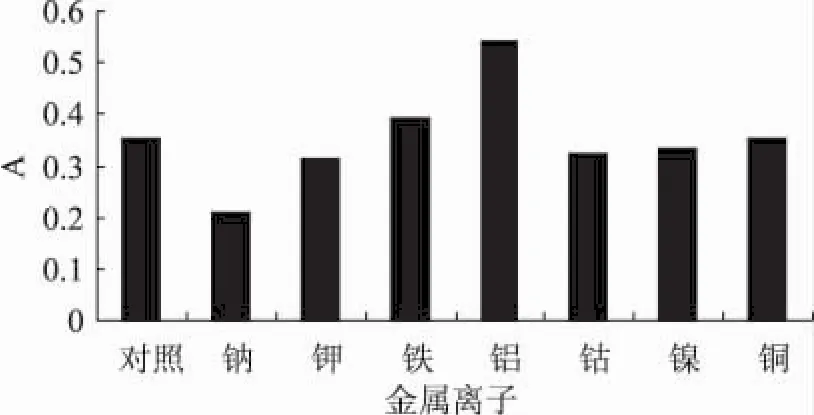
图7 金属离子对多糖稳定性的影响
3 结论
3.1 西洋参叶多糖的超声波提取工艺∶本实验采用超声波法对西洋参叶多糖进行提取,实验结果表明,较佳的工艺条件为∶超声功率700W、频率100kHz、温度70℃、超声时间为60min。
3.2 多糖的稳定性∶西洋参叶多糖的耐热性较差,在碱性、氧化还原剂、VC、柠檬酸、Na+、Fe3+、Al3+等中的稳定性较差,在酸性、苯甲酸钠中的稳定性较好。因此在综合开发利用西洋参叶多糖产品时应注意避免与影响其稳定性的物质直接接触。
[1]刘志城,于守洋.营养与食品卫生学[M].北京:人民卫生出版社,1993.
[2]汪志好.植物多糖的研究进展[J].医学基础与医药研究,2007:86-88.
[3]李宗林.西洋参茎叶水溶性多糖结构分析及其生理活性的研究[J].食品工业科技,2001,22(2):20-21.
[4]Z Hromadkova,A Ebringerova,P Valachovic.Ultrasonics Sonochemistry[J].2002(9):37244.
[5]傅博强,谢明勇,聂少平,等.茶叶中多糖含量的测定[J].食品科学,2001,22(11):69-73.
Panax quinquefolius leaf polysaccharide extraction and stability studies
HUANG Wei-min,NAN Jiang,WANG Xing,MU Xiao-yan,JI Xiao-hui*
(School of Chemistry and Environmental Sciences,Shaanxi University of Technology,Hanzhong 723000,China)
Panax quinquefolius leaf polysaccharide extraction from the different ultrasonic power,frequency,temperature,and time of ultrasonic conditions,and the stability of Panax quinquefolius leaf in different temperature,pH,oxidant,reductant,food additives and some metal ion of conditions were studied.The results showed that the best extraction process conditions was:power 700W,frequency 100kHz,temperature 70℃,ultrasonic time 60min. The Panax quinquefolius leaf polysaccharide stability was poor in temperature,alkaline,oxidizer reducer,VC,citric acid,Na+,Fe3+,Al3+,et al.In acid,sodium benzoate,the stability was good.
Panax quinquefolius leaf;polysaccharide;ultrasonic;extraction;stability
TS201.1
B
1002-0306(2011)11-0339-04
2010-12-15 *通讯联系人
黄伟敏(1989-),男,本科,研究方向:天然产物化学。

