氧气对干酪乳杆菌生长和活力的影响
周元良,柳国霞,刘 飞,霍贵成
(乳品科学教育部重点实验室,东北农业大学,黑龙江哈尔滨 150030)
氧气对干酪乳杆菌生长和活力的影响
周元良,柳国霞,刘 飞,霍贵成*
(乳品科学教育部重点实验室,东北农业大学,黑龙江哈尔滨 150030)
以静置培养为对照,通过振荡培养制造有氧环境,对干酪乳杆菌的生长曲线、菌体活力进行分析。研究发现在有氧条件下菌体生长受到抑制,菌体密度小于静置发酵,在4℃保存时的活力迅速下降,另外,有氧生长菌体对热、胆汁等条件的耐受性较差,在50℃处理4h导致菌体迅速死亡,在含有胆汁的培养基中,菌体生长几乎停滞。通过透射电镜观察发现有氧条件下菌体细胞壁发生破裂,菌体细胞质成分溶出,导致菌体死亡。因此,氧气对干酪乳杆菌的生长具有抑制作用,造成细胞损伤,导致菌体活力降低。
干酪乳杆菌,氧气,菌体活力
干酪乳杆菌(Lactobacillus casei)属于兼性厌氧乳酸菌,通常情况下进行无氧发酵,可作为乳制品发酵剂将乳糖等碳源代谢成乳酸[1]。在人体肠道微生态系统中,L.casei具有抗诱变、降低血清胆固醇等功能[2],是一种重要的益生菌[3]。然而,在L.casei发酵过程中及含有L.casei的食品货架期内都会使菌体接触一定的氧气,这是造成菌体活力下降的因素之一[4-5]。对乳球菌的研究表明,延长乳球菌与空气接触的时间会导致细胞死亡和DNA降解[7];含有其他益生菌的食品在货架期内菌体也会由于包装内含有氧气导致菌体活力迅速下降[8]。氧气对乳酸菌的致死作用主要是由于分子氧形成的活性氧物质,如过氧化氢、羟自由基等,造成细胞蛋白质、类脂、核酸的损伤,从而使菌体死亡并导致下降[6]。在有氧条件下,NADH氧化酶和NADH过氧化物酶对L.casei的生长起关键作用。L.casei细胞内已发现这类酶及其辅酶FAD的存在[9]。由此可见,L.casei可以耐受一定量的氧气,但是这种耐受限度较低,过量的氧气接触会造成菌体不可恢复的损伤[7]。有关L.casei与氧气的相关研究鲜有报道。因此,本研究针对L.casei在有氧条件下的生长情况进行研究,探讨氧气对L.casei生长的影响,为其在工业中的应用提供有价值的参考信息。
1 材料与方法
1.1 材料与设备
干酪乳杆菌L.caseiATCC393,培养条件∶50mL液体培养基分装于500mL三角瓶中,接种过夜培养的新鲜菌液,接种量1%,培养温度37℃,其中有氧培养为在摇床中震荡培养,转速200r/min[1],厌氧培养为培养箱中静置培养;MRS培养基(1L) 蛋白胨5g,牛肉膏5g,酵母粉5g,胰蛋白胨10g,葡萄糖20g,吐温80 1.1g,磷酸氢二钾2g,柠檬酸氢二氨2g,乙酸钠5g,硫酸镁0.58g,硫酸锰0.25g,蒸馏水950mL,固体培养基加1.7%琼脂粉,121℃灭菌15min;胰蛋白胨、酵母粉 OXOID公司;蛋白胨、牛肉膏、牛胆汁
北京奥博星公司;硫酸镁、硫酸锌、葡萄糖 天津市天力化学试剂有限公司;乙酸钠 天津市博迪化工有限公司;柠檬酸氢二氨、磷酸氢二钾 天津市科密欧试剂公司;琼脂粉 Solarbio公司;NADH、FAD美国Sigma公司;以上试剂均为分析纯级。
生化培养箱SPX-150B 上海佳胜实验设备有限公司;超净工作台CJ-2D 天津泰斯特;分析天平PL2002 瑞士METTLER TOLEDO;恒温摇床HWY-100B 上海智诚;紫外-可见分光光度计DU-800美国BECKMAN;压力蒸汽灭菌器HVE-50 日本HIRAYAMA;透射电镜H-7650 日本HITACHI;离心机GL-20G-Ⅱ。
1.2 实验方法
1.2.1 生长曲线测定 两种培养条件下的菌液自4h开始至24h,每隔2h取样测定菌体OD600和pH。10h以后菌体需经适当稀释后进行OD600测定。
1.2.2 活菌计数 两种培养条件下的菌液采用平板菌落计数法测定活菌数[10]。每个稀释度做三个平行,于37℃培养48h后取出,静置于4℃冰箱中。取样时间分别为12h,24h,5d,10d和15d。
1.2.3 菌体耐热性测定 将两种培养条件下的48h培养物置于50℃水浴中放置4h,用1.2.2中的平板菌落计数法计活菌数。
1.2.4 菌体耐胆汁活力 将两种培养条件下的48h培养物接种1%于含有0.3%牛胆汁的灭菌MRS培养基中并按1.2.2方法进行活菌计数,于37℃培养3h后再计数,比较二者菌体生长受抑制程度[11]。
1.2.5 菌体NADH氧化酶系活力测定 将10mL的24h培养物,10000×g,4℃离心10min,收集的菌体用PBS缓冲液(pH6.0)洗三次,并重悬于PBS缓冲液中并超声破碎(功率150W,工作时间3s,间隔时间5s,总时间30min),1000×g,4℃离心10min,收集上清液。反应体系含有 100μmol/L NADH,20μmol/L FAD,50mmol/L PBS缓冲液(pH6.0),10μL酶提取液,25℃保温,每3min测定A340,做出曲线并计算斜率,根据斜率大小比较NADH氧化酶系活力[12]。
1.2.6 透射电镜观察 样品制备∶48h菌体培养液置于1.5mL EP管中,4℃,5000×g离心10min,弃上清液,菌体用 2.5%戊二醛固定,于 4℃放置过夜。0.1mol/L PBS缓冲液洗涤三次后用四氧化锇固定2.5h。再用0.1mol/L PBS清洗三次后依次用50%、70%、80%、90%、100%乙醇、1∶1的乙醇-丙酮和100%丙酮脱水。脱水后用梯度浓度的丙酮与包埋剂浸透过夜,次日包埋,聚合3d,再经修块、切片和染色后进行电镜观察[13]。电镜条件∶100kV,放大倍数∶6×104倍。
1.2.7 统计分析 采用SPSS13.0和EXCEL对数据进行统计分析。
2 结果与讨论
2.1 不同培养方式下L.casei的生长曲线
分别测定了静置培养(NO)和摇床培养(O)两种条件下L.casei的生长曲线,见图1。
由图1所示,在两种条件下菌体产酸量和变化趋势均一致,表明氧气对L.casei的发酵产酸影响较小。但是从菌体密度来看,10h前二者变化相近,12h开始后摇床培养条件下菌体生长明显受到抑制(P<0.05),菌体密度增长变慢,最终菌体密度也低于静置培养条件下的菌体。可以看出氧气对菌体的抑制主要作用在对数生长期。这是由于处在对数生长期的菌体代谢旺盛,对外界环境因素如酸、热、氧化等抵抗力较差[14],而氧气的存在以及超氧化物的生成使菌体受到胁迫,生长被抑制[6],使菌体生长的对数期减短,菌体较早进入稳定期,从而导致最终菌体密度较低。
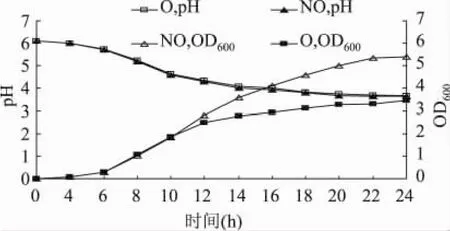
图1 两种培养条件下L.casei生长曲线
2.2 活菌计数
两种条件下培养物中活菌数变化情况如图2所示。两种条件下24h前活菌数相当,且在4℃条件下放置后,二者菌体活力均迅速下降,摇床培养的活菌数对数值在10d即下降到0,而同一时期静置培养的菌体活力还保持在104以上。这表明在培养过程中其菌体细胞可能受到损伤,从而导致在冷藏条件下菌体无法适应外界条件而大量死亡。而且在这一过程中可能生成的活性氧物质也会造成菌体死亡。这说明有氧条件下培养物中生成的超氧化物在菌体保存过程中对菌体进一步刺激,导致菌体大量死亡[7]。
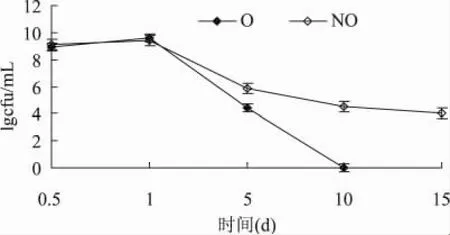
图2 两种培养条件下L.casei活力变化情况
2.3 菌体耐热性
由图3可以看出,摇床培养条件下热处理后的菌体活力下降明显(P<0.05),其活菌数对数值下降7.1,表明其培养物中活细胞对外界热处理条件敏感,菌体死亡率增加。而静置条件下热处理后菌体活力下降幅度不明显(P>0.05),仅为1.77,表明该菌体对外界热处理具有一定的抵抗力。摇床培养条件下菌体热抵抗力差与其菌体活力差有关。乳酸菌最高耐受生长温度是53℃[15],摇床培养条件下菌体活力在50℃迅速下降表明菌体发生了不利于耐受高温的变化。这一变化主要是由于菌体活力降低以及菌体细胞的氧化损伤。
2.4 菌体耐胆汁活力
两种培养条件下菌体对胆汁的耐受性有明显差异(P<0.05),如图4所示。静置培养条件下菌体在生长3h后活菌数对数值增加0.6,而同期摇床培养的菌体活力只上升0.1个对数值。这表明在含有0.3%胆汁的培养基中,摇床培养的菌体生长受到明显抑制(P<0.05),生长几乎停滞。菌体对胆汁的耐受性程度也与其菌体活力有关,正是由于在有氧条件下其菌体活力下降,所以导致L.casei在胆汁培养基中生长受抑制。
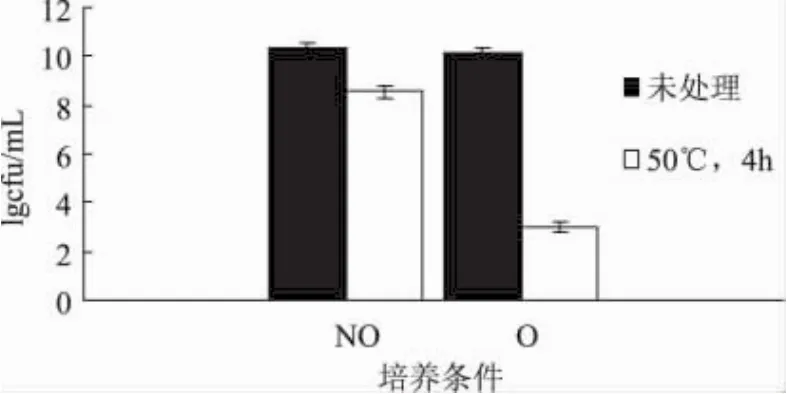
图3 两种培养条件下L.casei菌体的耐热性
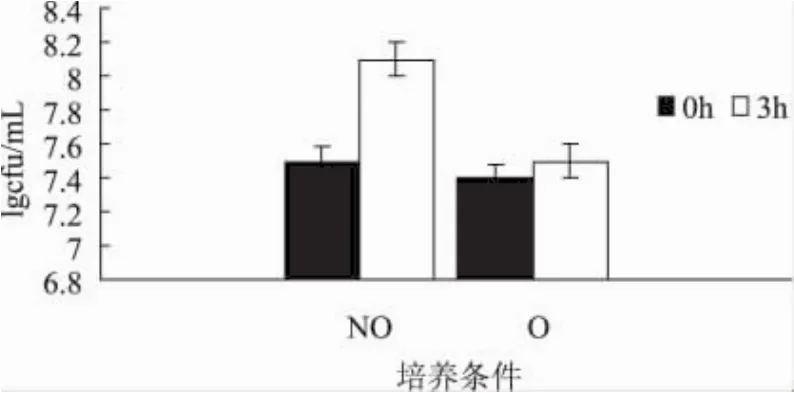
图4 两种培养条件下L.casei菌体的耐胆汁活性
2.5 NADH氧化酶系活力
由两种条件下细胞NADH氧化酶系活力可看出,L.casei菌体细胞NADH氧化酶系活力很低,同时,摇床培养菌体的酶活力是静置培养条件下酶活力的2.8倍。这表明过多的氧气会刺激菌体通过自身代谢途径的改变来降低氧气对细胞的毒性作用。因此,通常情况下,在接触少量的氧气时,L.casei生长不会受到抑制。但是当大量的氧气在其整个生长过程中出现时,其NADH氧化酶系不足以消除氧气带来的氧化损伤,菌体生长及活力均出现下降趋势[9]。
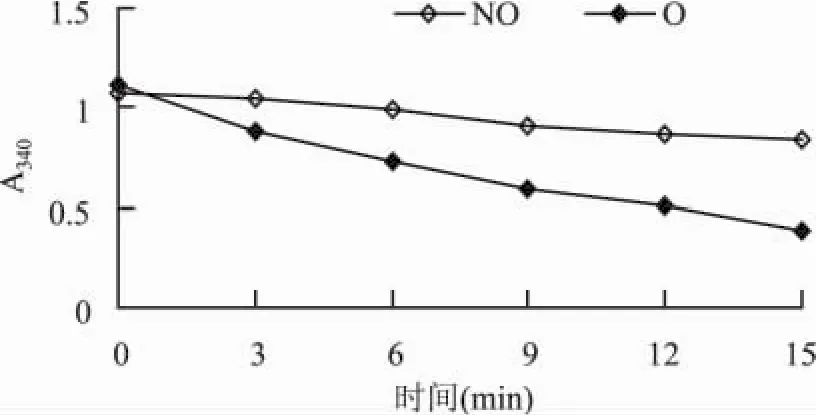
图5 两种培养条件下L.casei NADH氧化酶系活力
2.6 细胞电镜观察
两种条件下细胞的电镜观察结果如图6所示。由图6可以看出,在静置培养条件下,L.casei具有完整的细胞壁,而在摇床培养条件下部分菌体细胞壁发生破裂,导致胞内物质溶出。这种变化会直接造成菌体死亡和菌体活力下降。另外,静置培养菌体细胞壁较厚,表面粗糙,摇床培养得到的菌体细胞壁较薄,且表面光滑。这些变化都是在其生长过程中与氧气接触造成。一方面,菌体接触的氧气或者生成的超氧化物对细胞壁产生了刺激作用,导致其变薄和光滑,部分细胞由于所受刺激超过细胞壁承受限度,使细胞壁发生破裂,导致菌体自溶。这些因素都会导致菌体活力迅速下降,不利于菌体的保存。
3 结论
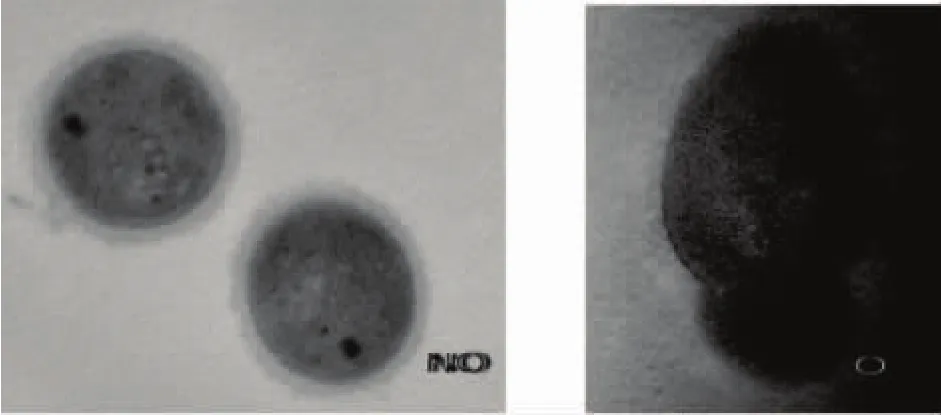
图6 两种培养条件下L.casei细胞的透射电镜照片
在有氧条件下,兼性厌氧菌L.casei的生长会由于氧气的存在而受到抑制,这种抑制表现在菌体生长减慢和菌体活力下降,包括菌体的耐热、耐冷藏、耐胆汁活力的下降。造成这种抑制作用的主要原因是菌体在有氧生长过程中培养物中产生的超氧化物对菌体造成的破坏作用[6-7]。因此,氧气在L.casei生长过程中出现是不利的。虽然少量的氧气可以通过NADH氧化酶/过氧化酶体系代谢[9],但这类酶在L.casei细胞内活性较低,当过量的氧气接触菌体依然会对菌体造成损害。大多数应用L.casei的发酵剂、益生菌食品等在生产加工以及产品储存过程中都会不可避免接触一些氧气[4],进而使发酵剂或产品中菌体活力下降,导致发酵性能下降和食品使用价值降低。
[1]Pappy J R,Kesavan M N,Athira S N,et al.L(+)-Lactic acid production using Lactobacillus Caseiin solid-state fermentation[J].Biotechnology Letters,2005,27:1685-1688.
[2]Nagendra P S.Functional cultures and health benefits[J]. International Dairy Journal,2007,17(11):1262-1277.
[3]Inmaculada N,Juan R,Gaspar P,et al.Diacetyl and acetoin production from whey permeate using engineered Lactobacillus casei[J].Journal of Industrial Microbiology and Biotechnology,2009,36:1233-1237.
[4]Akshat T,Kaila K.The Role of Oxygen in the viability of probiotic bacteria with reference to L.acidophilus and Bifidobacterium spp [J] .Current Issues in Intestinal Microbiology,2004(5):1-8.
[5]Donkor,Nilmini,Stolic,et al.Survival and activity of selected probiotic organisms in set-type yoghurt during cold storage[J]. International Dairy Journal,2007,7(6):657-665.
[6]付良,刘飞,霍贵成.一株能够利用血红素进行有氧呼吸的乳酸乳球菌[J].微生物学报,2008,48(9):1256-1259.
[7]Maarten G,Pascale S,Christian C,et al.Stress responses in lactic acid bacteria[J].Antonie van Leeuwenhoek,2002,82: 187-216.
[8]Craig M,Minh N,Michael R,et al.The influence of packaging materials on the dissolved oxygen content of probiotic yoghurt[J].Packaging Technology and Science,2008,15(3):133-138.
[9]Mitsuo S,Kazuo K.Aerobic growth of and activities of NADH oxidase and NADH peroxidase in Lactic Acid Bacteria[J]. Journal of Fermentation and Bioenoineer,1996,82(3):210-216.
[10]Liong,Shah.Acid and bile tolerance and cholesterol removal ability of Lactobacilli Strains[J].Journal of Dairy Science,2005,88:55-66.
[11]Fellix L D F,Michile K,Willem,et al.Cofactor engineering:a novel approach to metabolic engineering in Lactococcus lactis by controlled expression ofNADH oxidase[J].Journalof Bacteriology,1998,180(15):3804-3808.
[12]Carmen K,Jorg O T,Sybille H,et al.Multi-step assembly pathway of the cbb3-type cytochrome c oxidase complex[J]. Journal of Molecular Biology,2006,355:989-1004.
[13]Michelle C,Lynn M,Trevor B.Electron microscopic analysis of dairy microbes inactivated by ultrasound[J].Ultrasonics Sonochemistry,2010,15:960-964.
[14]刘怀龙,孟祥晨.酸适应乳酸菌的筛选及其酸适应条件的研究[J].山东大学学报,2008,43(7):51-55.
[15]张刚.乳酸细菌-基础、技术和应用[M].北京:化学工业出版社,2007:99.
Influence of oxygen to the growth and survival of Lactobacillus casei
ZHOU Yuan-liang,LIU Guo-xia,LIU Fei,HUO Gui-cheng*
(Key laboratory of Dairy Science,Ministry of Education,Northeast Agricultural University,Harbin 150030,China)
The growth curve and survival of L.casei under aerobic and anaerobic conditions were obtained by culturing with and without shaking respectively.The growing of L.casei inhibited by oxygen,which had a decreased growth yield compared with standing fermentation and a survival of reduced rapidly when stored at 4℃.Aerobic cultured L.casei had a bad tolerance in MRS media contain 0.3%bile,which also made a dominant cells death by treating with 50℃ for 4 hours.The cell walls rupturing and cytoplasm of aerobic cells dissolution were observed by transmission electron microscope,which induced the death of cells.Accordingly,influence of oxygen to L.casei was inhibiting growth,breaking cell walls and leading to poor survival.
Lactobacillus casei;oxygen;survival of cells
TS201.3
A
1002-0306(2011)11-0209-04
2010-11-26 *通讯联系人
周元良(1986-),男,硕士研究生,研究方向:食品科学。
教育部长江学者和创新团队发展计划(IRTO959)。

