不同基因型甘薯直链淀粉含量差异研究
唐忠厚,朱晓倩,李 强,李洪民,徐 飞
(中国农业科学院甘薯研究所,江苏徐州 221121)
不同基因型甘薯直链淀粉含量差异研究
唐忠厚,朱晓倩,李 强,李洪民,徐 飞
(中国农业科学院甘薯研究所,江苏徐州 221121)
研究快速测定甘薯淀粉中直链淀粉含量的方法,分析不同基因型甘薯直链淀粉含量差异。结果显示,该法测定直链淀粉与表观直链淀粉呈高度相关性(r=0.9992),在取样0.50g、不脱脂的情况下,5份甘薯样品的直链淀粉含量与脱脂后的测定结果相比,误差小于或接近2%,接近国标允许的误差范围(GB8648-87),表明该法适合于甘薯直链淀粉含量测定。不同品种甘薯直链淀粉含量存在一定差异,变幅为14.22%~35.12%,其中以黄心型变异系数最大,最有可能筛选到高直链淀粉品种或低直链淀粉品种。
甘薯,直链淀粉含量,测定方法,基因型差异
甘薯是世界上最重要的粮食、饲料和工业原料作物之一,也是我国最大的地下根茎淀粉作物,我国每年种植面积约600万hm2,约占世界甘薯种植面积的66%,年产量约1.002亿t,占世界甘薯总产量的85%[1]。目前甘薯作为新能源作物倍受世人关注,其淀粉特性研究日益受到重视,而直链淀粉含量是决定甘薯淀粉品质优劣的重要因素,是淀粉最重要的品质性状之一[2]。近年,甘薯直链淀粉含量的重要性已被人们所认识,国内外学者进行诸多研究[3-14],但其测定存在前预处理复杂、污染重、误差大、测定成本高以及应用性差等问题。本文针对甘薯淀粉特性,在实践中综合考虑复杂性、准确性、实用性等多种因素,以国标GB8648-87为基础[15],从取样量、样品预处理过程及测定条件等方面探索适合甘薯直链淀粉含量测定的方法,研究不同基因型甘薯直链淀粉的含量差异,以期提供快速、简便、微量的甘薯直链淀粉测定方法,为甘薯品质育种提供实验方法和理论依据。
1 材料与方法
1.1 材料与仪器
50份甘薯样品 材料根据不同肉色、生物特性等,选择来自甘薯鉴定圃、国家区试、北方区试、省区试及国家甘薯资源库,由中国农业科学院甘薯研究所提供;直链淀粉,支链淀粉标样 购自SIGMA公司;2%碘试剂 称取碘化钾1.0g,溶于少量蒸馏水,再加碘0.1g,待溶解后用蒸馏水稀释定容至50mL,现配现用,避光保存;其它试剂均为分析纯。
UV-2450型分光光度计 日本岛津公司; AB204-E型电子分析天平 瑞士 METTLER TOLEDO;SHZ-82型恒温振荡器 国华企业。
1.2 实验方法
1.2.1 标准曲线绘制 直链淀粉标准溶液∶称取(100±0.5)mg直链淀粉于100mL容量瓶中,加入1.0mL无水乙醇湿润样品,再加入9.0mL1mol/L氢氧化钠溶液,于60℃,振幅150r/min气浴恒温振荡器中摇匀30min,取出迅速冷却至室温,定容。
支链淀粉标准溶液∶称取(100±0.5)mg支链淀粉于100mL容量瓶中,加入1.0mL无水乙醇湿润样品,再加入9.0mL1mol/L氢氧化钠溶液,于60℃,振幅150r/min恒温振荡器中摇匀30min,取出迅速冷却至室温,定容。
吸取直链淀粉标准溶液0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8mL分别放入10只100mL容量瓶,再依次加入支链淀粉标准溶液5.0、4.8、4.6、4.4、4.2、4.0、3.8、3.6、3.4、3.2mL,加蒸馏水60mL,1mol/L乙酸溶液1.0mL,碘试剂1.0mL,定容(pH3.5左右)。用5.0mL0.09mol/L氢氧化钠代替淀粉标准溶液为空白。静置20min后,用分光光度计将试样空白溶液调零,在620nm处测吸光度,以620nm处的OD值为纵坐标,直链淀粉的质量百分数为横坐标,绘制标准曲线,见图1。
1.2.2 直链淀粉与表观直链淀粉相关性 鉴于支链淀粉对试样中碘-直链淀粉复合物的影响,在淀粉总量不变的条件下将支链淀粉和直链淀粉标准溶液按不同百分比配成一系列混合溶液,3个重复,测定同标准曲线方法,计算表观直链淀粉含量(测定值),与真实直链淀粉含量(观察值)计算相关性,评价该方法测定结果的准确度与精密度。
1.2.3 样品中直链淀粉的测定 甘薯淀粉制备∶准确称取洗净甘薯0.5kg,切成细块状,放入打浆机,加适量水,粉碎30s,倒入100目纱袋,加0.5L水洗提,另0.5L水再洗提一次。将洗提夜合并,过100目筛,静置12h(去糖,沉淀)。淀粉置50℃烘箱24h,干燥淀粉研磨,过100目筛,入密封袋保存。
称取(100±0.5)mg甘薯淀粉于20mL容量瓶中,加入 1.0mL无水乙醇湿润样品,再加入9.0mL1mol/L氢氧化钠溶液,于60℃,振幅150r/min气浴恒温振荡器中摇匀30min,取出迅速冷却至室温,定容(调节pH=3.5左右)。取5mL样品溶液于盛有50mL蒸馏水的100mL容量瓶中,先后加入lmL 1mol/L乙酸溶液和1mL碘试剂,用蒸馏水定容至100mL,摇匀,静置20min。测定时同时做一实验空白,相同的操作步骤及测定所用同量试剂,但用2.5mL 0.09mol/L氢氧化钠溶液代替试样溶液,在620nm处测吸光度。每样品3次重复。
1.2.4 样品脱脂与否条件的探讨 淀粉颗粒中直链淀粉含有α-1,4糖苷链的多聚葡萄糖化合物,以螺旋状态存在,脂肪以棒状贯穿于螺旋管中,不饱和脂肪酸碳链上含有不饱和键,碘分子极易进入螺旋内部。由于测定方法中用到碘试剂作为比色指示剂,脂肪的存在势必会影响直链淀粉含量的测定,使结果偏小,而脱脂步骤繁琐,脱脂所用试剂乙醚对人体有危害,故探讨样品脱脂与否对直链淀粉测定结果的影响。
选5个不同类型甘薯淀粉样品分两组按上面的方法测定直链淀粉含量,一组不脱脂直接进行测定,另一组无水乙醚浸泡8h,多次洗脱,除脂肪,并50℃烘干后测定。
1.2.5 品种分组及其统计分析 依据甘薯特点,并结合统计方法进行了分组,根据肉色的不同,将甘薯分成不含色素的白心型,含胡萝卜素的黄心型和含花青素的紫心型等类型。数据采用DPS9.5版统计分析软件分析。
2 结果与分析
2.1 直链淀粉与表观直链淀粉相关性
从图1可以看出,直链淀粉测定含量在5%~37%的范围内与直链淀粉标准含量高度相关,其相关系数为0.9992,达到了极显著的水平。说明一定范围内支链淀粉对直链淀粉含量测定影响极小,通过测定样品溶液OD值得到的样品表观直链淀粉含量相当于样品直链淀粉含量真实值。
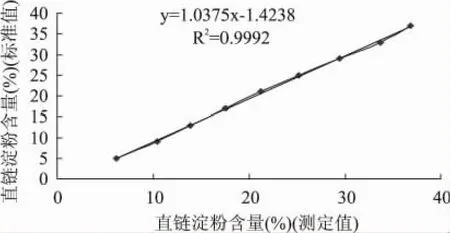
图1 直链淀粉含量标准值与测定值相关性
本方法的准确度和精密度是通过对一系列标准样品进行多次测定来分析,直链淀粉浓度测定范围设定参照甘薯直链淀粉含量可限范围;从表1可知,本方法对各标准样品的测定偏差小于1.42,其中超过13mg/100mL,测定偏差小于1%,相对偏差小于4%,准确度和精密度都较好,但小于13mg/100mL,测定偏差大于1%,相对偏差大于15.78%以上,其准确度和精密度则相对较差,可能因直链淀粉含量太低导致吸光度太小,系统误差相对较大的缘故。目前,国内外文献报道不同基因型甘薯直链淀粉含量多处于10%~40%间[2,7-9],故该方法适合于甘薯直链淀粉含量测定。
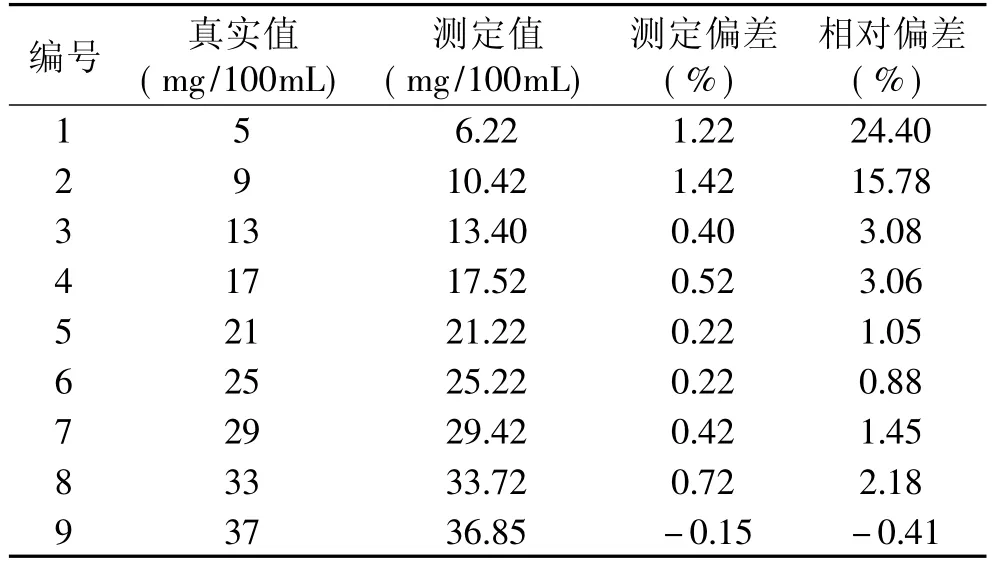
表1 直链淀粉含量标准值与测定值比较
2.2 脱脂与否对结果的影响
脱脂与否的结果比较见表2。从表2可以看出,脱脂前后直链淀粉含量的组内误差和组间误差(除徐034215)均<2%,接近国标允许的正常误差范围,相对偏差徐034215(北方区试)、徐薯22(国鉴品种)达5%,其它都未超2%,因此可知,甘薯经水提处理后,淀粉粒中脂肪含量极少,或者脂肪与碘的加成反应率低,对两种方法进行t检验(t=2.5586,P=0.0627),表明少量脂肪的存在对于直链淀粉含量的测定没有显著影响,故甘薯直链淀粉含量测定过程中可省脱脂这一步骤。
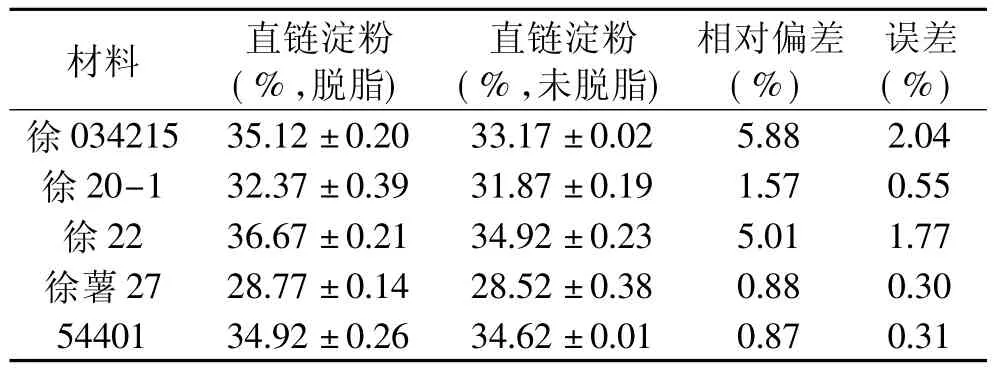
表2 脱脂与未脱脂甘薯淀粉中直链淀粉含量测定结果比较
2.3 甘薯直链淀粉含量测定结果
2.3.1 直链淀粉含量的基因型差异 甘薯淀粉中直链淀粉含量的平均值为28.32%,变幅为14.22%~35.12%,变异系数为17.50%,显示不同基因型甘薯直链淀粉含量差异显著。其中,50203(35.12%,繁殖圃),徐26(34.42%,国鉴品种),徐22(34.07%,国鉴品种)直链淀粉含量高,均在34%以上;而67306 (14.22%,鉴定圃),67115(16.77%,鉴定圃),67610 (16.82%,鉴定圃),67211(18.97%,鉴定圃)直链淀粉含量低,均在19%以下。
2.3.2 不同肉色间甘薯直链淀粉的基因型差异 表3表明不同肉色类型的甘薯品种间存在差异,达显著或极显著差异水平。从各自的变异系数看,无论是白心型还是黄心型均有可能筛选到高直链淀粉品种或低直链淀粉品种。黄心型变异系数最大,最有可能筛选到高直链淀粉品种或低直链淀粉品种。这与陆国权等人的研究结果大致相同[14]。但白心型与黄心型变异系数数值接近,并且50203(35.12%,繁殖圃),徐26(34.42%,国鉴品种),徐22(34.07%,国鉴品种)等直链淀粉含量高的品种皆属于白心型,表明白心型中更易得到高直链淀粉品种。而鉴定圃中67306(14.22%),67115(16.77%),67610(16.82%),67211(18.97%)等四个直链淀粉含量在19%以下的低直链淀粉品种中,除67610(16.82%)品种外,皆属于黄心型,表明黄心型中更易得到低直链淀粉品种。
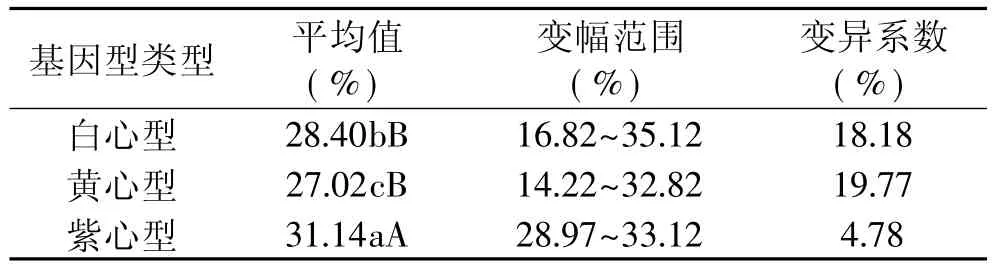
表3 甘薯不同肉色类型间直链淀粉含量的基因型差异
3 结论与讨论
目前,国标法尚未有专门的甘薯淀粉测定方法,参照GB8648-87所确定的样品脱脂步骤费时费事,且乙醚污染环境,对人体有害,本研究通过实验证明可以省去这一步骤,不仅缩短了实验流程而且减少了环境污染。实验表明,甘薯淀粉经水提处理后,甘薯淀粉粒中脂肪含量极少,或者脂肪与碘的加成反应率低,不脱脂对甘薯直链淀粉含量的测定无显著影响。
直链淀粉与表观直链淀粉相关性的测定结果其相关性系数为0.9992,达到了极显著的水平,说明经该预处理过程,淀粉颗粒中支链淀粉对直链淀粉含量测定影响极小,通过测定样品溶液OD值得到的样品表观直链淀粉含量相当于样品直链淀粉含量真实值。实验表明,本方法快速、简便、微量、重复性好,用于甘薯直链淀粉测定是可行的。
直链淀粉含量高低影响甘薯淀粉理化特性,具有重要的加工学意义。研究表明,不同肉色类型甘薯间直链淀粉含量差异达显著或极显著水平,可以从干率的不同进行分类,结合甘薯不同肉色类型,进一步研究直链淀粉含量与不同基因型甘薯的关系,来选育优质甘薯淀粉品种,因此,选育低直链淀粉的糯性甘薯和高直链淀粉的非糯性甘薯可能是今后甘薯育种新方向。
[1]马代夫.世界甘薯生产现状和发展预测[J].世界农业,2001(1):17-19.
[2]陆国权.甘薯品质性状的基因型与环境效应研究[M].北京:气象出版社,2003.
[3]唐忠厚,陆国权.甘薯抗性淀粉理化特性研究[J].中国粮油学报,2010,25(1):37-42.
[4]黄华宏,陆国权,舒庆荛.高色素甘薯淀粉糊化特性的基因型差异[J].作物学报,2005,31(1):92-96.
[5]谭洪卓,谭斌,高虹,等.甘薯淀粉动力学特性及其回生机理探讨[J].食品与生物技术学报,2008,27(6):34-38.
[6]谭洪卓,谷文英,刘敦华,等.甘薯淀粉糊的流变特性[J].食品科学,2007,28(1):58-63.
[7]Tian S T,Rickard J E,Blanshard J M V.Physicochemical properties of sweetpotato starch[J].Sci Food Agric,1991,57:459-491.
[8]Katayama Kenji,SeijiTamiya,Komaki K.Varietal and annual variation in pasting properties of sweetpotato starch[J]. Sweetpotato Research Front,2000(10):4-5.
[9]Collado L S,Corke H.Properties of starch noodles as affected by sweetpotato genotype[J].Cereal Chem,1997,74(2): 182-187.
[10]Yamakawa O.Development of sweetpotato cultivars for new processing use in Japan[J].Trop Agric,1998,75(12): 284-287.
[11]Mestres C,Matencio F,Pons B,et al.A rapid method for the determination of amylase by using differential scanning calorimetry[J].Starch,1996,48(1):2-6.
[12]Kitahara K.A new line of sweetpotato with a low amylose content[J].Journal of Applied Glycoscience,1996,43(4): 551-554.
[13]顾振宇,樊镇棣,黄赣辉,等.直链淀粉含量及检测方法与抗性淀粉增抗效应研究[J].食品科学,2008,29(1):74-77.
[14]陆国权,唐忠厚,黄华宏.不同施钾水平甘薯直链淀粉含量和糊化特性的基因型差异[J].浙江农业学报,2005,17(5): 280-283.
[15]王肇慈.粮油食品品质分析[M].北京:中国轻工业出版社,2000.
Genotype variation in amylose content of sweetpotato
TANG Zhong-hou,ZHU Xiao-qian,LI Qiang,LI Hong-min,XU Fei
(Sweetpotato Research Institute,Chinese Academy of Agricultural Sciences,Xuzhou 221121,China)
To study on rapid determination of amylose content in sweetpotato starch,the difference were assayed for genotypes variation in amylose content of sweetpotato.The results showed that it was highly correlated between true amylose and apparent amylose using the method(r=0.9992),the error of five various samples of sweetpotato amylose content using degreasing were less than or near 2%of samples by using 0.50g,non-degreasing,which was accepted according to GB8648-87,indicated it was fit to the determination of amylose content in sweetpotato starch.There were some differences of amylose content among 50 sweetpotato varieties,which ranged from 14.22%~35.12%,the largest coefficient of variation from yellow-flesh varieties,which was the most likely to be screened with high or low amylose varieties.
sweetpotato;amylose content;determination;genotype variation
TS235.2
A
1002-0306(2011)11-0108-03
2010-07-12 *通讯联系人
唐忠厚(1976-),男,助研,主要从事甘薯功能物质提取及品质分析。
农业部行业计划项目(NYHYZX07-012-01C)。

