可再生使用的磁性纳米修饰C反应蛋白电流型免疫传感器*
侯建国,曹玉廷,周汉坤,孟令花,胡富陶,干 宁
(宁波大学材料科学与化学工程学院,浙江宁波 315211)
临床上C反应蛋白(CRP)检测对冠心病的早期诊断有较高价值[1-2]。目前检测血清中CRP主要基于免疫学原理,分析方法主要有:荧光、放射、化学发光、酶联等免疫分析法[3]等。由于上述方法普遍操作繁琐、仪器庞大、需专业人员操作[4],不适合于冠心病潜在人群的现场筛查。而开发一些简便、价廉、精确且易于推广的CRP现场快速检测方法是解决大规模样品筛查,并实现冠心病早期诊断的关键之一,意义重大。电化学免疫传感器具有快速、高灵敏、便携等优点,在临床类样品检测中应用越来越广泛[5],尤其是安培型酶联免疫传感器,可通过酶催化放大免疫反应产生的电流信号,进一步提高传感器灵敏度[6]。目前报道的安培型酶联免疫传感器缺乏简易、高效、稳定的抗体和酶固定方法,导致其易失活;而电极无法更新,修饰麻烦,无法满足现场快速检测需要[7-8]。解决上述问题关键在于寻求新型的抗体标记材料,以提高抗体标记率;同时简化探针在电极表面修饰过程[9-10];选择可批量生产,低成本的免疫电极制备方法。
近年来,在纳米Fe3O4表面包裹上胶体Au构建的Fe3O4(核)/Au(壳)(GMPs)金磁微粒,由于具有良好的生物相容性,超顺磁性和导电性[11],受到越来越多的关注,被应用于生物分子标记及免疫磁珠构建[12]。崔亚丽等用种子聚合法合成了粒径约为50 nm的GMPs并用其标记抗体[13],由于 GMPs表面大量存在的Au-NPs,可以显著提高抗体标记密度、稳定性和生物活性。在外磁场作用下,该类探针即易于实现对待测物的分离富集,又可方便吸附固定在电极表面,由此可构建电极表面更新的安培免疫传感器。CNTs由于其良好的导电性,强大的吸附性能和优良的生物相容性[14],已经被广泛用于电极表面修饰材料。含有两个氨基的硫堇(Thi)染料分子是一种良好的电子媒介体,由于HRP可以催化Thi和 H2O2之间的氧化还原反应[15]。因此,将HRP标记抗体和Thi共同修饰到电极上,Thi可作为电极与抗体标记HRP酶间的电子传递媒介体,可发展基于Thi-H2O2-HRP的无媒介体安培免疫传感器[16]。但是Thi等电子媒介体由于分子量小,水溶性好,将其固定到电极表面时很容易扩散到溶液中,导致传感器稳定性差[17]。CNTs可以与Thi通过π-π堆积作用[18]结合形成稳定的CNTs-Thi复合物,当其固定到电极后,可有效防止Thi在电极表面泄露。此外,CNTs还可以提高Thi的电子传输效率。SPCE是采用丝网印刷工艺,在绝缘基片(如PVC塑料,耐火陶瓷)上沉积一层或数层印刷油墨制备而成,具有制作简便、成本低、样品消耗量小、可批量化生产等诸多优点[19-20]。
综上所述,我们基于Thi-H2O2-HRP体系,采用GMPs标记辣根过氧化物酶标的抗体(HRP-anti-CRP)制备磁性探针,进而组装在MCNTs-Thi-Nafion修饰的SPCE作为基底电极上,制备了一个无媒介、磁性可控、可再生的安培免疫传感器。Nafion用作膜材料将MCNTs-Thi固定在电极表面,不仅可以阻止MCNTs-Thi在电极表面的流失[21],而且与传统的安培型酶联免疫传感器相比,其SPCE基底电极可以重复利用,抗体探针可控固定,修饰过程简单,保证了检测稳定性与重现性。而由于该类探针具有高的抗体和酶标记密度,对抗原捕获能力强,将其用于血清中痕量CRP检测,获得了良好的结果。
1 实验部分
1.1 化学试剂
硫堇、牛血清白蛋白(美国Sigma有限公司),Nafion(分子量:2000,wt%=5.0%,中国河森有限公司),2-氨基乙硫醇(日本TCI有限公司),甲苯,戊二醛溶液(25%)和H2O2(30%)(上海国药集团化学试剂有限公司),多壁碳纳米管(MCNTs,直径小于5 nm,深圳纳米技术港有限公司),0.1 mol/L磷酸缓冲溶液为支持电解质(PBS,用 KH2PO4、Na2HPO4和NaCl配制,pH 6.5),C反应蛋白定量检测试剂盒(酶联免疫法),包含一系列不同浓度的CRP标准溶液及辣根过氧化物酶标记的CRP抗体(北京科跃中楷生物技术有限公司),实验所用试剂均为分析纯,实验用水均为二次去离子水(Millipore公司,美国)。
1.2 仪器和测量
循环伏安法(CV),示差脉冲伏安法(DPV)和电化学阻抗谱(EIS)均在CHI-660B(中国上海辰华公司)上进行。丝网印刷碳电极(SPCE)(西班牙eDAQ技术公司),其中:工作电极与对电极均为印刷碳电极,参比电极为印刷Ag/AgCl电极,S-3400N型扫描电子显微镜(日本日立公司),H-7650透射电子显微镜(日本日立公司),S2 RANGER X射线荧光光谱仪(德国Bruker公司)。
1.3 MCNTs-Thi和MCNTs-Thi-Nafion复合物的制备
MCNTs按照文献报道[22]直接在 0.5 mol/L 盐酸中超声4 h,然后用蒸馏水洗涤直到洗液呈中性,离心,50℃真空干燥24 h。MCNTs(1 mg)和 Thi(2 mg)溶解在1 mL pH 6.5的 PBS中超声12 h,以形成MCNTs-Thi复合物,未和MCNTs结合的Thi可离心去除,获得纯净的MCNTs-Thi复合物。最后,取1 mg MCNTs-Thi溶解在含有100 μL 5%Nafion和900 μL 0.1 mol/L pH 6.5 的 PBS 溶液中,在室温下超声30 min制备MCNTs-Thi-Nafion溶液。
1.4 HRP-anti-CRP和BSA在GMPs表面的组装过程
参照文献[23]的制备方法,将1.5 mL GMPs(0.5 mg/mL)与0.5 mL 5 mmol/L 2-氨基乙硫醇混合、机械搅拌24 h,沉淀物用磁铁转移分离并用二次蒸馏水洗涤,弃上清液,再向上述黑色沉淀中加入2 mL戊二醛的甲苯溶液在室温下轻轻搅拌反应6 h,磁铁分离,冲洗,并将上述沉淀物与浓度为1.0 mg/mL的HRP-anti-CRP溶液混合,在4℃恒温摇床反应12 h,得到 HRP-anti-CRP/GMPs生物纳米粒子。接着,HRP-anti-CRP/GMPs在浓度为 3%的BSA中37℃温育反应1 h,以封闭GMPs剩余的活性位点,防止其对CRP抗原产生非特异性吸附。将制备的HRP-anti-CRP/GMPs纳米探针分散在20 mL pH 6.5 PBS 中,4 ℃储存,备用。
1.5 免疫传感器的制备
将SPCE表面依次用无水乙醇和蒸馏水冲洗几次,晾干备用,取 5 μL上述制备的 MCNTs-Thi-Nafion溶液滴在SPCE工作电极表面,红外灯下晾干,作为基底电极。再取5 μL浓度为0.83 mg/mL的磁性纳米探针悬浮液滴在电极表面,在SPCE工作电极平面背部加一块磁场强度为0.3T的圆柱形磁铁(其圆面和SPCE背面紧贴,如图1(b))借助磁力将HRP-anti-CRP/GMPs吸附于电极表面,室温下自然晾干即通过简单的两步法制得了免疫传感器(图1)。每次使用后,移去磁铁,用蒸馏水冲洗,洗去HRP-anti-CRP/GMPs纳米材料以更新电极。此传感器在4℃下储存备用。
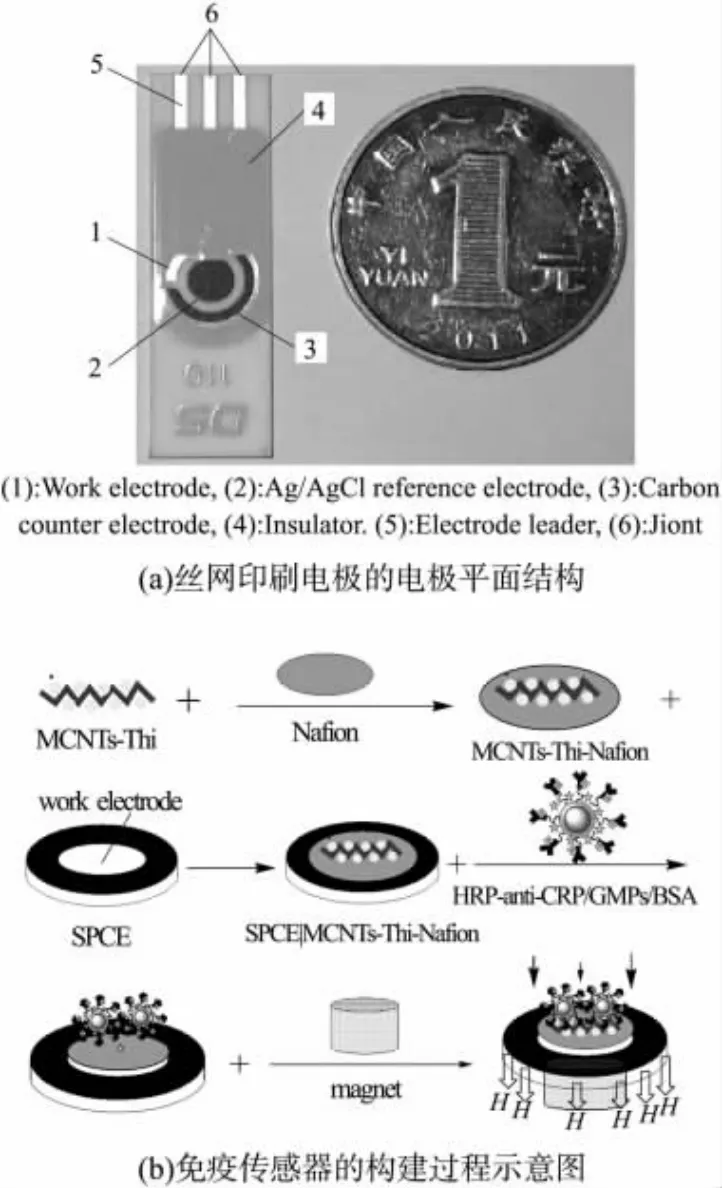
图1 方案1图示
1.6 电化学测量
该免疫分析是基于免疫结合物的生成阻碍标记酶HRP与Thi之间的电子传递而进行测定。首先,测定SPCE/MCNTs-Thi-Nafion/HRP-anti-CRP/GMPs免疫电极在含4 mmol/L H2O2的pH 6.5的PBS中的峰电流(I0);然后,依次取15 μL不同浓度的CRP标准溶液滴在上述免疫电极表面于30℃温育15 min。再测定该免疫传感器在含有相同浓度H2O2的上述PBS溶液中的峰电流(I)。CRP含量的检测是由检测传感器表面免疫反应发生后其对过氧化氢的电流响应下降值来进行的。该免疫电极在温育CRP前后的电流响应下降值ΔI=I0-I。采用免疫传感器温育后电流下降百分率CR%=100×(I0-I)/I0,对溶液中的CRP进行定量,可消除不同电极之间由于表面积不同造成的电流强度差异影响。
2 结果与讨论
2.1 不同纳米粒子复合物和免疫传感器的表征

图2 电子显微镜表征图
2.1.1 透射电子显微镜(TEM)和扫描电子显微镜(SEM)分析。图2(a)~图2(c)分别为 MCNTs,MCNTs-Thi和MCNTs-Thi-Nafion/GMPs的TEM表征图。与单纯的 MCNTs(图2(a))相比,形成的MCNTs-Thi结合物(图2(b))明显直径变宽,这表明MCNTs的表面已成功结合了 Thi[24]。图 2(c)为MCNTs-Thi膜上吸附GMPs后的TEM图,可清楚地观察到均匀分散的GMPs颗粒。MCNTs-Thi-Nafion/GMPs的SEM图(图2(d))出现了明显的MCNTs管网状结构,且出现了大量分散性良好的GMPs,这表明借助于外磁铁的作用,GMPs已成功固定于MCNTs-Thi-Nafion复合物膜上。
2.1.2 X射线荧光光谱分析。采用X射线荧光光谱表征HRP-anti-CRP/GMPs复合物。在HRP-anti-CRP/GMPs纳米探针的谱图上出现了Fe(kα-6.45 keV),Au(LA-9.7 keV)和 S(kα-2.32 keV)的特征峰。
2.1.3 不同修饰层电极的电化学交流阻抗。电化学交流阻抗是研究电极表面修饰状况的一种有效方法。图3分别为不同阶段的修饰电极在5 mmol/L Fe(CN)64-/3-(简称 FeCN,内含 0.5 mol/L KCl)溶液中的交流阻抗图谱,高频区的半圆直径表示电子传递阻抗(Ret),低频区的线性部分表示扩散过程。图2现实了该免疫电极在制备不同阶段的阻抗谱,可以很明显看出,裸SPCE电极的阻抗谱几乎是一条直线(图3曲线a),这是典型的扩散控制过程。当电极表面修饰MCNTs-Thi-Nafion以后,通过阻抗谱看出其具有400 Ω的较小电阻(图3曲线b)。通过静电吸附将GMPs组装到SPCE/MCNTs-Thi-Nafion电极表面,结果显示电阻减少至100 Ω(图3曲线c),这是因为:GMPs具有良好的导电性,可有效提高FeCN电子传递速率。随着该电极进一步固定抗体HRP-anti-CRP,进而温育溶液中CRP抗原,结果显示阻抗不断增加(图3曲线d和曲线e),这表明:在电极表面的抗体和免疫复合物大大增加了对FeCN 电子传递的阻抗[27]。

图3 免疫电极制备过程中,在0.1 M PBS(pH 6.5)+0.1 M KCl+5.0 mM Fe(CN)64-/3-的交流阻抗图
2.2 不同修饰电极的电化学行为
图4显示了免疫传感器制备过程中不同电极在0.1 mol/L pH 6.5的PBS溶液中的循环伏安图。由图4曲线a可以看出在0~-0.8 V的扫描范围内,裸电极没有出现氧化还原峰,而在电极表面修饰一层MCNTs(图4曲线b)后残留电流变大,这是因为MCNTs增大了电极比表面积,是电极导电性增强。与SPCE/MCNTs修饰电极相比,SPCE/MCNTs-Thi-Nafion修饰电极在-0.3 V左右有一对稳定的准可逆氧化还原峰曲线(图4曲线c),该氧化还原峰为Thi的特征峰[26],这表示 MCNTs-Thi牢固结合并固定在电极上。在 SPCE/MCNTs-Thi-Nafion上吸附GMPs后(图4曲线d),峰电流明显增加,这是因为GMPs外围包裹的纳米金有促使电子传输的作用。GMPs结合HRP-anti-CRP与BSA之后峰电流下降,是因为电极之间的内阻加大,该结果和交流阻抗结论一致(图4曲线e)。

图4 不同修饰电极在pH 6.5 PBS缓冲溶液中的循环伏安响应图
2.3 免疫传感器对H2O2的响应

图5 免疫传感器加入H2O2前后的循环伏安图
图5的曲线a与 b分别为免疫传感器加入H2O2前后的循环伏安图。从图5的曲线a可见,在无H2O2时,电极表面有一对准可逆的Thi氧化还原峰。当加入4 mmol/L H2O2后,修饰电极的氧化峰电流降低而还原峰电流明显增加,还原峰电位同时向负方向微小移动(图5的曲线b),表现出明显的酶催化反应过程。该还原电流的增加是由于HRP催化H2O2氧化Thi的反应而使电极表面Thi的氧化态增加所造成的。传感器在20 ng/mL CRP溶液中温育后,还原催化电流下降(图5的曲线c),这是由于电极表面形成的免疫复合物掩蔽了HRP的活性中心,导致HRP催化氧化Thi的能力下降,峰电流减小。
2.4 实验条件的优化
2.4.1 MCNTs-Thi复合物和 GMPs在电极表面固定量 滴加 15 μL 含 0.25 ~2.0 mg/mL MCNTs-Thi的Nafion于SCPE表面,探索其在电极表面的最佳浓度。电流响应随着MCNTs-Thi浓度从0.25 mg/mL增加到1.0 mg/mL而逐渐增加,当浓度高于1.0 mg/mL时,峰电流又逐渐减小,这可能是因为随着MCNTs-Thi浓度超过了Nafion饱和吸附量后,会在电极表面产生流失,所以选择最终浓度为1.0 mg/mL的MCNTs-Thi滴加在电极表面。考察了电极表面GMPs的浓度从0.5 mg/mL~1 mg/mL范围内对电流的影响,结果发现,峰电流先随GMPs浓度的增加而增加,在0.83 mg/mL时达到最高点,由于GMPs高于此浓度后会有团聚现象,由此导致电流下降。因此,选择0.8 mg/mL GMPs作为修饰最佳浓度。
2.4.2 不同pH、温育温度、温育时间对免疫反应的影响 免疫反应受pH、温育温度、温育时间等影响,强酸或强碱性环境会破坏蛋白质微观结构,降低蛋白质的活性。此外,Thi的氧化还原过程需要一个质子。因此,pH值会影响Thi的电化学性能。考察免疫电极在pH 5.0~pH 8.0的磷酸盐缓冲液中对4 mmol/L H2O2的响应(图6(a))。实验发现,免疫电极在pH 6.5时响应电流最大,故本实验选择pH 6.5的PBS。图6(b)显示了免疫传感器在0.5 mmol/L ~5.0 mmol/L H2O2浓度范围内催化电流大小,由图可知,催化电流随H2O2浓度的增加而增大,当达到4 mmol/L时,电流响应趋于不变,此时可能溶液中的H2O2达到了饱和,因此实验中选择加入4 mmol/L H2O2。图6(c)显示了温育温度对免疫传感器安培响应的影响。当温育温度从10℃到40℃升高时,免疫传感器的电流响应下降值ΔI也随之增加,并在35℃达到最大值。而当温育温度高于40℃时,可导致抗体蛋白变性,因此选择35℃作为实验中温育温度。图6(d)显示了温育时间与免疫传感器的电流响应下降值ΔI的关系。由图可示,随着温育时间的增加,免疫传感器的电流响应下降值ΔI随之增加并趋于一稳定值,说明此时抗原-抗体反应已达平衡,在不影响实验结果的情况下,选择15 min为优化的温育时间。

图6 (a)缓冲液pH值;(b)底液中H2O2浓度;(c)传感器在10 ng/mL CRP中温育后温育温度;(d)传感器在20 ng/mL CRP中温育后温育时间对免疫传感器的影响
2.5 免疫传感器对CRP的DPV响应
在优化的测定条件下,利用SPCE/MCNTs-Thi-Nafion/HRP-anti-CRP/GMPs免疫电极在不同浓度的CRP样品中温育,用DPV方法测定,并获得了CRP测定校正曲线。图7(a)所示,随着温育液中CRP含量的增加,免疫传感器的安培响应降低。在高浓度的CRP范围内,电流下降百分比(CR%)无明显改变,这可能是电极表面CRP的浓度已接近饱和。图7(b)为CR%与CRP的标准曲线,在0.1 ng/mL~80 ng/mL两段浓度范围内成线性关系。回归方程分别为CR%=6.34C(CRP)+1.02和CR%=0.833C(CRP)+4.27线性相关系数分别为0.9983和0.9925。该方法获得的检测下限为0.04 ng/mL(3σ)。

图7 (a)SPCE/MCNTs-Thi-Nafion/HRP-anti-CRP/GMPs免疫电极对不同浓度CRP的DPV电流响应图(从 a 到 i的[CRP]=0,0.1,0.5,3.5,5.0,10,50,80,110 ng/mL);(b)CRP 浓度与信号变化值(CR%)之间的标准曲线
2.6 免疫传感器的重现性和稳定性
采用4个同一批次制备的CRP传感器,对10 ng/mL的CRP标准溶液进行测定,获得组间相对标准偏差 RSD为3.3%(n=4)。同一批次印制的SPCEs结构稳定(包括电极材料、面积和碳层厚度等相同),而固定的磁性探针量和分布均一,使得该免疫传感器具有较好的制备重复性。免疫电极在4℃冰箱中存放30 d,传感器在含1 mmol/L H2O2的pH 6.5 PBS溶液中测定其安培响应仅下降为原来的94%。这表明该传感器具有较好的储存稳定性,同时也表明修饰电极可以有效地阻止电子媒介体Thi的流失,且电极表面GMPs/HRP-anti-CRP的生物活性保持良好。
2.7 样品及干扰测定
研究了血清中主要可能干扰物对免疫电极检测CRP的影响。结果表明:当传感器在浓度为20 ZG CRP及分别含有AFP(400 ng/mL)、人免疫球蛋白(HIgG,1μg/mL)、CA19-9(20 ng/mL)、人绒毛膜促性腺激素(HCG,20 ng/mL),以及 2 μg/mL 的 BSA、尿酸、抗坏血酸、多巴胺、L-半胱氨酸等的溶液中温育,传感器对H2O2的电催化信号在有与没有干扰物的溶液中仅有4.8%的差别,表明该传感器选择性良好。
2.8 免疫传感器的再生
在本工作中,磁性纳米探针可通过外部磁铁固定并在测定后从SPCE上洗脱,从而使SPCE/MCNTs-Thi-Nafion基底电极可更新使用。本文采用同一根Nafion膜修饰电极作为基底电极,在外磁场作用下,重复固定磁性探针五次,并对浓度为10 ng/mL的CRP样品进行平行测定,测量的相对标准偏差为2.0%。表明该电极具有良好的再生性,Nafion膜基底电极可反复使用,由此可大大减少电极的使用成本,并简化了传感器的制备过程。
2.9 实际血清样品测定
为了验证此方法应用到临床医学的可能性,对实际血清样品进行了检测。选取含有3 ng/mL~35 ng/mL CRP的若干血清样品,取1 mL溶解在5 mL PBS中,采用本法进行了测定并和标准的化学发光免疫分析方法(CLA)进行了对照,结果见表1。
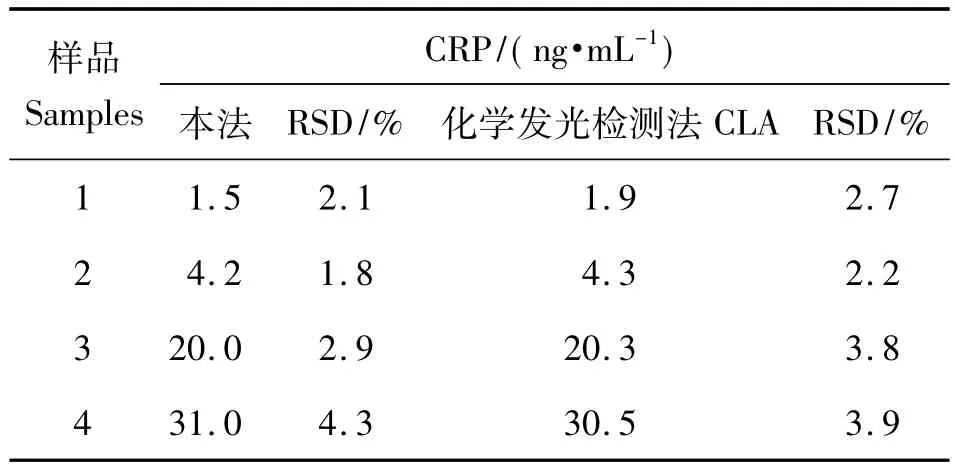
表1 本方法和ELISA方法测定实际血清样品中CRP的结果比较(n=3)
该法的相对偏差在1.8%到4.3%之间,表明该传感器适合用于血清CRP含量的测定。
3 结论
本文基于GMPs标记酶联抗体制备了磁性纳米探针,进而将其磁性吸附固定在碳纳米管修饰丝网印刷电极表面,构建了电极表面可更新,可再生使用的安培免疫传感器,并成功地用于血液中CRP的检测。该传感器具有以下优点:(1)避免了电解质溶液中电子媒介体的加入,减少了背景干扰。(2)合成的磁性纳米探针,具有较高的酶标抗体标记密度,使得其对CRP抗原捕获能力大大提高;而富集的HRP酶进一步催化放大免疫反应产生的电流信号,使得检测灵敏度大大增强。(3)磁性探针易于通过外磁场控制固定和移除电极表面,由此获得的免疫电极表面可更新使用。(4)每次测定后只需更换探针即可进行下一次检测,节约了电极使用成本,缩短了分析时间。本传感器具有制作简便,磁性可控、稳定性和重现性好等优点。因此,非常适合于对人血清中低含量 CRP的检测,具有潜在的临床应用价值。
[1]Yan S K.Application of Ultra-Sensitive C-Reactive Protein Determination in Diagnosis and Treatment of Atherosclerotic Diseases[J].Journal of Diagnostics Concepst& Practicep,2002,1(4):267-268.
[2]Zwaka T P,Hombach V,Torzewski J.Creactive Proteinmediated Low Density Lipoprotein Uptake by Macrophages:Implicatiens for Atherosclerosis[J].Circulation,2001,103(9):1194-1197.
[3]Rothkrantz-Kos S,Schmitz M P,Bekers O,et al.High-Sensitivity Creactive Protein Methods Examined[J].Clin Chem,2002,48(2):359-362.
[4]Liu K P,Zhang J J,Wang C M,et al.Graphene-Assisted Dual Amplification Strategy for the Fabrication of Sensitive Amperometric Immunosensor[J].Biosensors and Bioelectronics,2011,26(8):3627-3632.
[5]He X L,Yuan R,Chai Y Q,et al.A Sensitive Amperometric Immunosensor for Carcinoembryonic Antigen Detection with Porous Nanogold Film and Nano-Au/chitosan Composite as Immobilization Matrix[J].J.Biochem.Biophys.Methods,2008,70:823.
[6]赵广英,吴淑春.基于四通道丝网印刷碳电极的禽流感(H5N1)抗体电化学免疫传感器的研制[J].传感技术学报,2008,21(8):1295-1300.
[7]Wu Y F,Chen Ch L,Liu S Q.Enzyme-Functionalized Silica Nanoparticles as Sensitive Labels in Biosensing[J].Anal.Chem,2009,81:1600-1607.
[8]Ou Ch F,Yuan R,Chai Y Q,et al.A Novel Amperometric Immunosensor Based on Layer-by-Layer Assembly of Gold Nanoparticles-Multi-Walled Carbon Nanotubes-Thionine Multilayer Films on Polyelectrolyte Surface[J].Anal.Chim.Acta,2007,603:205-213.
[9]Aguilar Z P,Vandaveer W R,Fritsch I.Self-Contained Microelectrochemical Immunoassay for Small Volumes Using Mouse IgG as a Model System[J].Anal.Chem,2002,74:3321-3329.
[10]Yuan Y R,Yuan R,Chai Y Q,et al.Electrochemical Amperometric Immunoassay for Carcinoembryonic Antigen Based on Bi-Layer Nano-Au and Nickel Hexacyanoferrates Nanoparticles Modified Glassy Carbon Electrode[J].J.Electroanal.Chem,2009,626:6-13.
[11]Yu H,Chen M,Rice P M,et al.Dumbbell-Like Bifunctional Au-Fe3O4Nanoparticles[J].Nano Lett,2005,5:379-382.
[12]Yang K,Peng H B,Wen Y H,et al.Re-Examination of Characteristic FTIR Spectrum of Secondary Layer in Bilayer Oleic Acid-Coated Fe3O4Nanoparticles[J].Appl.Surf.Sci.,2010,256:3093-3097.
[13]崔亚丽,惠文丽,汪慧蓉,等.Fe3O4/Au复合微粒制备条件及性质研究[J].中国科学(B 辑),2003,33(6):482-488.
[14]Lu G H,Zhu L Y,Wang P X,et al.Electrostatic Force Directed Assembly of Ag Nanocrystals onto Vertically Aligned Carbon Nanotubes[J].J.Phys.Chem.C,2007,111:17919-17922.
[15]刘科,刘慧宏,王启会.固定化辣根过氧化物酶和硫堇的过氧化物传感器[J].应用化学,2008,25:409-413.
[16]Dai Z,Yan F,Yu H,et al.Novel Amperometric Immunosensor for Rapid Separation-Free Immunoassay of Carcinoembryonic Antigen[J].J.Immunol.Methods,2004,287:13-20.
[17]Kandimalla V B,Tripathi V S,Ju H X,et al.A Conductive Ormosil Encapsulated with Ferrocene Conjugate and Multiwalled Carbon Nanotubes for Biosensing Application[J].Biomaterials,2006,27:1167-1174.
[18]Li Q W,Zhang J,Yan H,et al.Thionine-Mediated Chemistry of Carbon Nanotubes[J].Carbon,2004.42:287-291.
[19]Nunes G S,Jeanty G,Marty J.Enzyme Immobilization Procedures on Screen-Printed Electrodes Used for the Detection of Anticholinesterase Pesticides:Comparative Study[J].Anal.Chim.Acta,2004,523:107-115.
[20]Xue Q N,Bian C,Ren Z X,et,al.Screen Printing Bio-Chip Sensor for Cholesterol Detection Based on Molecular Imprinting Self-Assembled Film[J].JournalofElectronics & Information Technology,2010,32:2735-2739.
[21]Su H L,Yuan R,Chai Y Q,et al.Multilayer Structured Amperometric Immunosensor Built by Self-Assembly of a Redox Multi-Wall Carbon Nanotube Composite.Electrochim[J].Acta,2009,54:4149-4154.
[22]Qiu D J,Deng M Q,Liang R P,et al.Ferrocene-Modified Multiwalled Carbon Nanotubes as Building Block for Construction of Reagentless Enzyme-Based Biosensors[J].Sens.Actuators,B,2008,135:181-187.
[23]Fu X H.Magnetic-Controlled Non-Competitiveenzyme-Linked Voltammetric Immunoassay for Carcinoembryonic Antigen[J].J.Biochem.Eng,2008,39:267-275.
[24]Yuan Y R,Yuan R,Chai Y Q,et al.Electrochemical Amperometric Immunoassay for Carcinoembryonic Antigen Based on Bi-Layer Nano-Au and Nickel Hexacyanoferrates Nanoparticles Modified Glassy Carbon Electrode[J].J.Electroanal.Chem,2009,626:6-13.
[25]Liu C H,Liao K T,Huang H J.Amperometric Immunosensors Based on Protein A Coupled Polyaniline-Perfluorosulfonated Lonomer Composite Electrodes[J].Anal.Chem.,2000,72:2925-2929.
[26]Jia J B,Wang B Q,Wu A G,et al.A Method to Construct a Third-Generation Horseradish Peroxidase Biosensor:Self-Assembling Gold Nanoparticles to Three-Dimensional Sol-Gel Network[J].A-nal.Chem,2002,74:2217-2223.
[27]张东东,漆红兰,李小蓉.碳纳米管组装电化学免疫传感器测定 IgG 抗体的研究[J].传感技术学报,2008,21(5):719-723.

