气体分离循环对高温厌氧消化过程的影响
何品晶,李 磊,郝丽萍,吕 凡,邵立明 (同济大学环境科学与工程学院,固体废物处理与资源化研究所,上海200092)
气体分离循环对高温厌氧消化过程的影响
何品晶*,李 磊,郝丽萍,吕 凡,邵立明 (同济大学环境科学与工程学院,固体废物处理与资源化研究所,上海200092)
采用厌氧序批式反应器,研究了气体循环(包括气体直接循环和脱除气体中的氢气后循环)对以葡萄糖和乙酸钠配制的模拟废水在高温厌氧消化过程中乙酸代谢速率、出水性质及微生物相的影响,并采用尺寸排除色谱和三维荧光光谱技术,对溶解性微生物产物(SMP)的分子量分布和荧光物质组成进行了分析.结果显示,气体循环使得出水中残余挥发性脂肪酸的浓度由 238.2mg/L(未脱氢)和 129.6mg/L(脱氢)分别减少至8.5mg/L和8.2mg/L,并最终降低了SMP产量,45d时分别降至气体循环前的36.8%和59.2%.脱氢气体循环促进了乙酸化和乙酸氧化,导致了微生态环境和甲烷化基质浓度的差异,促进了高分子量SMP向低分子量SMP的转化,污泥中的微生物形态亦发生了较大变化.可见气体循环改善了基质与微生物的混合状况,改善了出水水质,而脱氢气体循环加速了乙酸的代谢,有望更快速地解除易降解有机物高温厌氧消化过程中的酸抑制,提高厌氧消化效率.
气体循环;氢分压;高温厌氧消化;溶解性微生物产物
厌氧消化是一种重要的生物质能转化技术[1].物料与微生物群的混合是厌氧消化过程重要的工艺操作措施,混合程度能够极大地影响工艺的稳定性和有机物的甲烷化速率[2].常用的混合方式包括机械搅拌、消化液循环和气体循环[3-5].厌氧消化气体循环可避免机电设备设置在反应器内部,且更加易于操作[4],在实际工程已有较多应用.厌氧消化气体的主要成分包括CH4、CO2和H2等,氢分压(pH2)对于调节有机物的厌氧代谢产物分布起着关键作用[6].易降解有机物的快速发酵与慢速甲烷化常常伴随着挥发性脂肪酸(VFAs)和H2的积累,而高pH2又进一步阻碍了丙酸、丁酸等的氧化,可加剧甲烷化的酸抑制;低的pH2则从热力学上可促进VFAs向甲烷化前体物的转化,加速甲烷的产生[6].厌氧产气循环,并同时脱除循环气体中的H2,对于改善酸化状况、促进工艺的高效稳定运行具有较大潜力.
溶解性微生物产物(SMP)是厌氧消化工艺出水中溶解性有机物(DOM)的主要成分[7-8],其产量和性质受到操作工况的影响,亦能反映工艺的运行状态[9],表征微生态的稳定程度.当微生态系统受到外界的干扰或抑制时,微生物会应激产生更多的SMP或改变其种类,如SMP的净累积量正比于环境中毒性物质浓度(如 CHCl3和Cr6+)[8];泥龄过长或盐度过高,均会引起 SMP中高分子量(MW)物质的显著增加[9-10],进而降低出水水质.
本实验采用厌氧序批式反应器(ASBR),研究了直接气体循环和脱除气体中的氢气后循环对以葡萄糖与乙酸钠为碳源的模拟废水进行高温厌氧消化过程中代谢速率、出水性质及微生物相的影响,以期为高温厌氧工艺调控条件的选择和优化提供依据.
1 材料与方法
1.1 实验材料与装置
采用2个有效容积为3.5L的高温ASBR(R0和 R1,见图 1),处理以葡萄糖和乙酸钠(4:1,以COD计)为碳源配制的模拟废水,其中COD:N:P=200:5:1,并添加1mL/L微量元素[11],pH值为 7.50.接种污泥取自上海市某工业废水处理厂,实验前已于55℃下以葡萄糖和乙酸钠为碳源培养驯化 100d.2个反应器均设置了配有蠕动泵的液体循环和气体循环管路,R1则在气体循环泵后增加了催化脱氢管(HOG-1,大连科联新技术发展公司),以脱除循环气体中的H2.
1.2 实验方法
R0和 R1均于 55℃下运行,有机负荷为2000mg/(L•d) (以COD计),水力停留时间为10d;以24h为1个循环周期,其中0.5h进水,22.5h反应,0.5h沉降,0.5h排水.反应器运行的前 20d内,仅通过消化液循环进行混合.20d后,以气体循环代替消化液循环,通过气体循环泵将反应器液上空间的厌氧产气以 100mL/min的流速通入反应器底部的曝气盘管.R1内的循环气体则通过催化脱氢管脱除其中约 99%的氢气,使得液上空间的pH2由几百Pa降至几十Pa(图2b).每天排水前采集气体样品,排水阶段采集水样.40d时,R0和R1内的pH值分别为7.35±0.10和7.44±0.12,根据各项测试指标判断,2个工况均已实现稳定运行,于此时测试1个循环中由进水后(0h)到乙酸浓度降至检测限以下(9h)过程中的乙酸、无机碳(TIC)、pH2和 CH4含量变化.45d时,采集污泥样品并用电镜扫描观测其微观形貌.
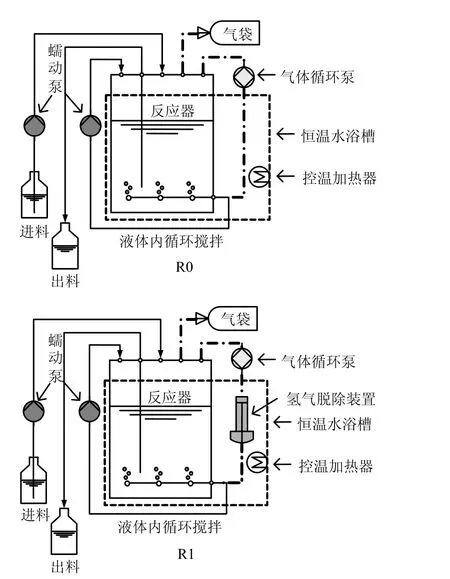
图1 实验反应装置示意Fig.1 Schematic of anaerobic sequenced batch reactors(ASBR) with biogas recirculation and H2removal
1.3 分析测试方法
SMP的 MW 分布由尺寸排除色谱法测得,测试系统配有HW-50S凝胶柱(TOSOH公司,日本);三维荧光光谱(EEM)采用美国Varian公司的Cary Eclipse分子荧光光度计测试,方法参考文献[12];VFAs采用液相色谱仪(LC-20AD,Shimadzu公司,日本)测定,样品分析前用0.22µm的滤膜过滤;pH值采用数字pH计(pHS-22F,上海精密科学仪器有限公司)测定;溶解性有机碳(DOC)和 TIC采用总有机碳测定仪(multi N/C 3000,Analytikjena公司,德国)测定,样品分析前用0.45µm 的滤膜过滤;葡萄糖采用蒽酮比色法[13]测定;污泥颗粒采集后,经过脱水、临界点干燥等预处理,表面镀金,采用 HITACHI-S2360N 扫描电镜(SEM)进行观测.
1.4 EEM图谱的定量化分析
将EEM图谱定义为5个有机物类别区域[14]:区域 I,酪氨酸类蛋白质区(λex/λem=200~250nm/280~330nm);区 域 II,色 氨 酸 类 蛋 白 质 区(λex/λem=200~250nm/330~380nm);区域 III,富里酸类物质区(λex/λem=200~250nm/380~550nm);区域IV,溶解性微生物副产物类蛋白质区(λex/λem=250~400nm/280~380nm);区域 V,腐殖酸类物质区(λex/λem=250~400nm/380~550nm).采用荧光区域综合指数法(FRI)对上述 EEM 区域进行定量化分析,该方法通过计算特定区域标准体积(Φi,n)及各区域标准体积百分比(Pi,n),以反映对应区域具有特定结构的荧光物质的含量和相对比例.
2 结果与讨论
气体循环前,R0和 R1的出水 DOC为(520±40.0)mg/L,厌氧气体产量为(0.48±0.02)L/g(以反应器的COD计).尽管在气体循环初期,出水的 DOC在短期内增加(分别增至 655mg/L和776mg/L,最高值),但当反应器运行至第45d,即增加气体循环后的25d时,R0和R1出水的DOC已降低至153.7mg/L和176.7mg/L.与消化液循环相比,气体循环后R0和R1稳定阶段的产气量也略有 提 升 ,分 别 为 (0.57±0.02)L/g (COD)和(0.58±0.03)L/g (COD).由此可见,气体循环提高了有机物的高温厌氧转化率,改善了ASBR的出水水质.
2.1 乙酸代谢速率和热力学分析

图2 稳定阶段R0和R1中单次进料后乙酸浓度、H2/TIC/CH4的变化与吉布斯自由能变(ΔG)的变化Fig.2 Evaluation of acetate, H2/TIC/CH4and Gibbs Free Energy (ΔG) in the stable stage of R0and R1
如图2a所示,稳定阶段(40d)R0和R1中累积的乙酸分别于进水后10h和6h消耗完.R1中的乙酸在2h后达到最大值9.1mmol/L,但随后其降解速率明显快于R0,其中R0和R1的最大降解速率分别达到 1.4,4.0mmol/h.由此可见,H2脱除显著增加了乙酸的代谢过程.厌氧消化中,乙酸产生于丙酸、丁酸的氧化过程(表1),而R1中低的pH2促进了 VFAs向乙酸的转化[15-16],表现为反应阶段初期乙酸的快速累积.
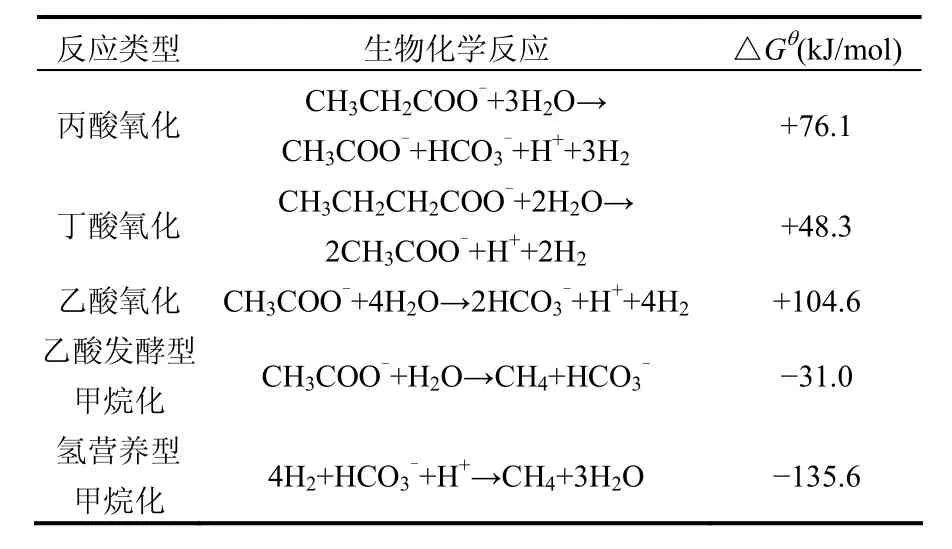
表1 厌氧产甲烷过程的生物化学反应[20]Table 1 Biochemical reactions involved in anaerobic methanization
高温下,乙酸主要通过乙酸氧化与氢营养型甲烷化联合途径(SAO-HM)和乙酸发酵型甲烷化途径(AM)降解[17-18],前者包括两个连续步骤:(1)乙酸氧化为 H2和 CO2(AO);(2) H2和 CO2通过CO2还原型甲烷化途径(又称氢营养型,HM)转化为甲烷.各个反应的吉布斯自由能变分别记作ΔGAM、ΔGAO和ΔGHM.由图2c中的热力学分析结果可知,虽然 R1中的 ΔGHM(-28.9~-17.5kJ/mol)高于 R0(-60.6~-34.1kJ/mol),ΔGAM(-33.2~-22.2kJ/mol)略高于 R0 (-32.3~-24.9kJ/mol),但 R0 中的 ΔGAO(2.8~29.2kJ/mol)始终为正值.从热力学角度分析,SAO-HM仅存在于R1中,而在R0中却受到高pH2的抑制难以进行.H2的脱除加快了SAO-HM速率,进而促进了R1中乙酸的快速降解[19].废水厌氧消化工艺的稳定运行,主要取决于消耗H2和乙酸的末端反应的快速进行[6].脱氢气体循环显著加速了R1中有机物甲烷转化体系内的物质流通.通过分析甲烷产生途径(即AM 和HM)可以发现,R0中的 ΔGAM略低于R1,而ΔGHM则显著低于R1.R0内较高的累积乙酸浓度和pH2在热力学上有利于AM和HM的进行,因而其产生的 CH4浓度高于 R1,但 HM 途径对CO2的消耗则使其液相TIC低于R1(图2a).低pH2下较高的TIC浓度和较低的CH4含量表明,H2脱除改变了产物的最终分布[20],而这主要源于低pH2下SAO-HM途径对有机物甲烷化代谢的贡献[21].
2.2 厌氧消化出水性质分析
根据文献[8-9],采用以下方法计算 SMP的含量:SMP(以DOC计)=出水DOC-(残余葡萄糖+VFAs),并将SMP按照分子量水平分成3部分:高 MW(10~100k Da)、中等 MW(1~10k Da)和低MW(<1k Da).
2.2.1 VFAs的变化 气体循环前,R0和R1出水中残存VFAs的浓度分别为238.2~280.4mg/L和 129.6~296.7mg/L(图 3a).增加气体循环操作后,R0出水中的VFAs相对缓慢地降低,于38d后达到17.9mg/L并维持稳定;而R1出水中的VFAs于25d时(即气体循环操作开始运行后5d)即迅速降低至 41.2mg/L,之后波动于(14.9±6.7)mg/L.与液体循环相比,气体循环改善了厌氧环境中基质与微生物的混合状况,加快了物质的传递速率,增加了微生物与基质的接触机会[22],提高了甲烷化等反应的速率,从而缓解了VFAs的积累状况.H2的脱除强化了乙酸代谢,加速了有机物的厌氧甲烷转化,表现出残存VFAs的迅速降低.Voolapalli等采用膜脱除中温厌氧消化CSTR中的部分H2,也使得出水中的VFAs由3400mg/L下降至低于2000mg/L,H2的脱除加快了VFAs的降解并提高了工艺的稳定性[23].
2.2.2 SMP的变化 已有对高温ASBR出水中DOM的研究发现,不同MW水平SMP的芳构化程度和荧光物质组成具有较大差异,因而具有不同的性质和来源.鉴于SMP的产生量和特性对于了解系统运行状况的重要作用,对气体循环前后SMP的产量、分子量分布和荧光物质组成进行了分析.
SMP产量的变化:气体循环初期,R0和R1内的 SMP产生量急剧增加,分别由 310.0mg/L和287.3mg/L增加至451.2mg/L和735.4mg/L(最大值),之后又逐渐降低,38d后分别降至 151.2mg/L和 158.8mg/L,低于气体循环前的水平(图 3b).R1内SMP的变化比R0内更为剧烈.气体循环在改善液相环境混合状况的同时,也对微生态环境产生了极大的扰动.气液相传质的加速,使得液相TIC浓度增加,pH值略有升高(R0和R1均增加0.1左右,数据未显示).而H2的脱除,则降低了pH2和溶解氢浓度,减少了 HM 途径对 CO2的消耗,使其TIC高于R0(图2a).气体循环初期,微生物未能适应突然改变的环境,因而释放出更多的SMP以抵抗环境压力[10].另外,一些厌氧微生物,如联合乙酸氧化菌株[17]和乙酸发酵型甲烷八叠球菌[24]更喜好稳定的环境.气体循环产生涡流,直接对污泥颗粒产生剪切力[24],气体循环造成的巨大扰动亦可能是初期SMP大量产生的原因.随着培养时间的增加,微生态环境趋于稳定,微生物逐渐适应新的环境(或者产生了新的功能微生物),SMP的产生量也随之降低,达到稳定期时已低于气体循环前的水平,分别降至气体循环操作前的 36.8%和 59.2%.气体循环对混合状况的改善,加快了厌氧生化反应的速率,提高了微生物对包括残余 SMP在内的有机物的异化代谢活力,这亦可能是SMP浓度显著低于气体循环操作前的原因.
SMP的分子量分布:气体循环初期,R0和R1内的高 MW 部分分别由 27.2%和 22.2%增加到45.1%和43.7%,而后又逐渐降低,45d时分别降低至34.1%和24.8%,而此时的低MW部分则相应升高至20.2%和32.4%(图4).在反应器运行状况逐渐稳定的过程中,R1内的低 MW 部分始终高于R0,高MW部分则低于R0.
SMP分为低MW的基质利用型微生物产物(UAP)和含有大量高 MW 的生物衰减型微生物产物(BAP)[9].气体循环初期,SMP产生量的增加主要表现为高 MW-SMP含量的升高,这可能是微生物为了抵抗环境压力而大量释放高MW-SMP,以保持颗粒污泥的形态[10].另一种可能,则是环境的突然改变导致了优势微生物种群的演替,不能适应环境变化的劣势种群的消亡亦会增加高MW的BAP的产生.另外,Xu等[25]发现,在渗滤液厌氧消化处理过程中,可降解的大分子量有机物逐渐被降解为小分子量有机物,导致了厌氧消化出水中高 MW-SMP的减少和低MW-SMP的增加.低 MW-SMP的进一步降解,则使得出水中的 SMP逐渐减少.与此相似,本文中SMP的厌氧降解可能导致了SMP的逐渐减少,而R1中高MW-SMP向低MW-SMP的转化则可能是其MW分布变化的原因,H2的脱除显然加速了高MW-SMP的分解过程.
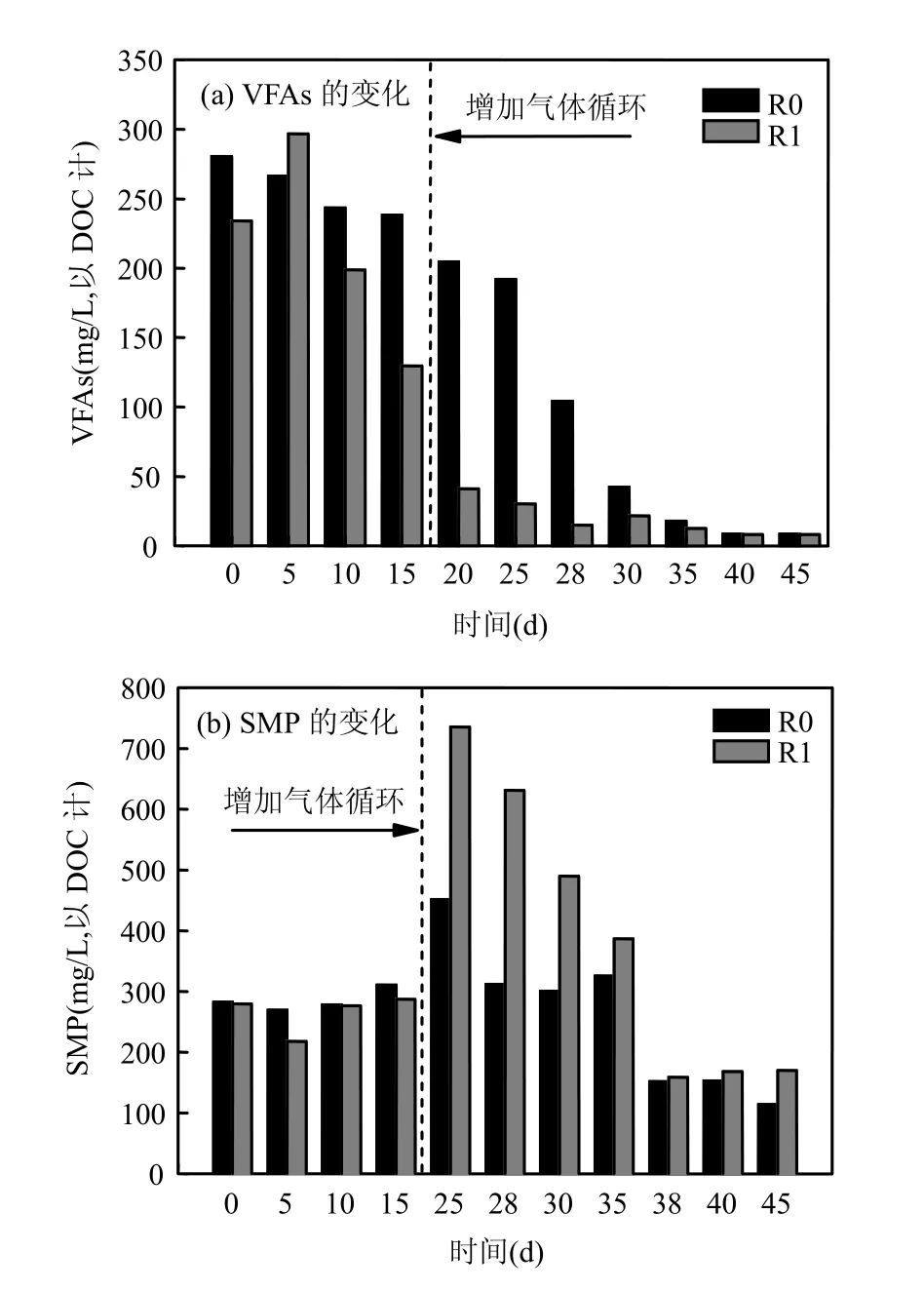
图3 R0和R1出水中残余VFAs与SMP的变化Fig.3 Evolution of the residual VFAs and SMP in the effluents from R0and R1
SMP的荧光物质产生量和组成变化:图5显示了不同阶段R0和R1出水SMP中不同种类荧光物质浓度和相对含量的变化.本试验中,SMP的主要成分为酪氨酸类和色氨酸类芳香族蛋白,以及溶解性微生物副产物类蛋白,其约占总含量的 95%.从图 5a中可以看到,在气体循环初期各类蛋白质均呈现增加趋势,而后又逐渐减少,含量较少的腐殖酸和富里酸类物质则变化较小.与气体循环前相比,R0和R1中SMP的芳香蛋白组成发生了变化(图 5b).R0中酪氨酸类物质先增加,从 40.2%增至 50.4%,然后逐渐降低;色氨酸类物质则先减少,从 43.8%降至 36.3%,而后再逐渐增加.R1中酪氨酸类物质含量缓慢降低,从42.2%降至 37.3%,色氨酸类物质则缓慢增加,从 42.6%增至47.0%.开始气体循环操作后,R1中酪氨酸类蛋白含量低于 R0,色氨酸类蛋白则高于R1.蛋白质(包括结构蛋白和酶类)在微生物的结构和功能中起着重要作用[26].蛋白质组成的变化表明,微生物种群结构或功能发生了改变[27].H2脱除导致的R0和R1内微生态环境的差异,可能引发了优势微生物种群的演替.
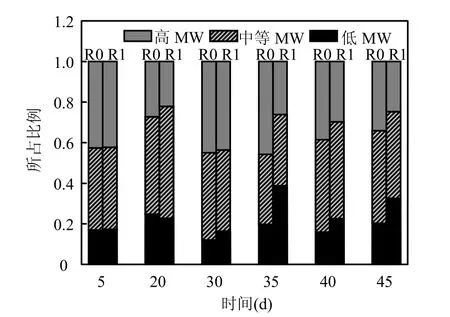
图4 R0和R1中SMP的MW分布变化Fig.4 MW Distribution of SMP in R0and R1
由此可见,气体循环显著降低了出水中DOM 的浓度,改善了高温厌氧消化出水的水质.虽然在初期SMP的产生量增加,但随着微生物对新环境的逐渐适应和混合状况改善对SMP厌氧降解的促进作用,SMP浓度逐渐降低,稳定期甚至低于气体循环前的水平,其MW分布亦呈现出高MW部分减少,低 MW部分增加的趋势.保留与脱除循环气体中的H2不仅导致了SMP的MW分布的细微差异,还使其蛋白质类物质的组成结构产生变化,指示了其微生物功能或微生态稳定状态的改变.
Barker等[28]发现,高MW有机物比低MW有机物更容易通过活性炭吸附(GAC)得以去除.何品晶等[11]认为,高 MW 区域和中等 MW 区域的BAP、富里酸与腐殖酸类物质可以通过超滤、反渗透等技术得以去除.Langenhoff等[29]研究表明,SMP浓度随着水力停留时间(HRT)的减少而增加.本研究中,高温厌氧消化 SMP主要分布在高MW和中等MW区域(61%~88%),为了进一步提高出水水质,中等MW-SMP和低MW-SMP可以通过适当延长 HRT得到进一步降解,高MW-SMP则可以通过GAC、超滤、反渗透等技术去除.
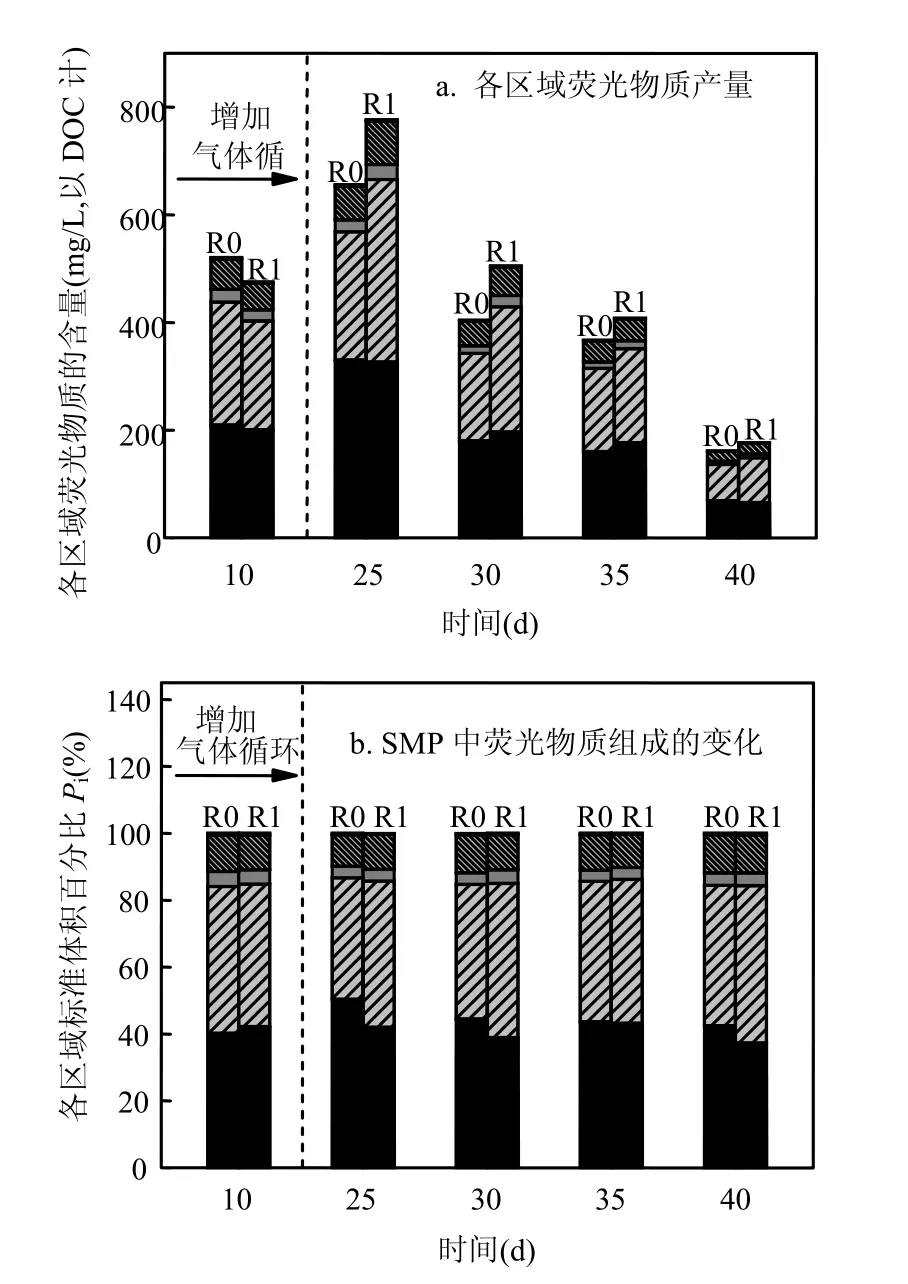
图5 各区域荧光物质产量与SMP中荧光物质组成的变化Fig.5 Changes in the production of fluorescence matters in different regions and percentage of the fluorescence response (Pi,n)
2.3 微生物形态分析
由图6可以发现,在第45d的稳定状态下,R0和 R1内颗粒污泥的微生物形态存在极大差异.与R1相比,R0显示了较高的微生物多样性,其颗粒污泥内部存在杆菌、球菌和丝状菌;而在 R1中仅存在着聚集型球菌.由此可见,H2脱除导致了各环境因子和甲烷化基质(H2、CO2、乙酸)浓度的改变,而微生态环境的差异又引发了微生物种群结构的演变[30-31],这也是导致反应速率、出水水质以及SMP特性改变的原因.

图6 颗粒污泥内部的微生物微观形态Fig.6 Scanning electron micrographs of microbes in the granules from R0 and R1
3 结论
3.1 气体循环改善了基质与微生物的混合状况,降低了高温厌氧消化出水中残余 VFAs的浓度,提高了ASBR的运行性能.虽然SMP在气体循环初期产生量显著增加,但之后逐渐减少,稳定阶段则低于气体循环前的水平.
3.2 保留和脱除循环气体中的 H2,导致了微生态环境和甲烷化基质浓度的差异,由此引起了颗粒污泥中微生物微观形态的变化.
3.3 低pH2进一步促进了乙酸化和乙酸氧化,加速了乙酸的代谢,使得出水中残余 VFAs的浓度快速降低;脱氢气体循环还促使高分子量SMP向低分子量SMP发生转化,使其荧光物质中酪氨酸类蛋白和色氨酸类蛋白的比例发生改变.
[1] Myint M, Nirmalakhandan N, Speece R E. Anaerobic fermentation of cattle manure: Modeling of hydrolysis and acidogenesis [J]. Water Research, 2007,41(2):323-332.
[2] Karim K, Hoffmann R, Klasson T, et al. Anaerobic digestion of animal waste: Waste strength versus impact of mixing [J].Bioresource Technology, 2005,96(16):1771-1781.
[3] Lee S R, Cho N K, Maeng W J. Using the pressure of biogas created during anaerobic-digestion as the source of mixing power[J]. Journal of Fermentation and Bioengineering, 1995,80(4):415-417.
[4] Karim K, Klasson K T, Hoffmann R, et al. Anaerobic digestion of animal waste: effect of mixing [J]. Bioresource Technology,2005,96(16):1607-1612.
[5] Karim K, Thoma G J, Al-Dahhan M H. Gas-lift digester configuration effects on mixing effectiveness [J]. Water Research,2007,41(14):3051-3060.
[6] CordRuwisch R, Mercz T I, Hoh C Y, et al. Dissolved hydrogen concentration as an on-line control parameter for the automated operation and optimization of anaerobic digesters [J].Biotechnology and Bioengineering, 1997,56(6):626-634.
[7] Laspidou C S, Rittmann B. A unified theory for extracellular polymeric substances, soluble microbial products, and active and inert biomass [J]. Water Research, 2002,36(11):2711-2720.
[8] Aquino S F, Stuckey D C. Soluble microbial products formation in anaerobic chemostats in the presense of toxic compounds [J].Water Research, 2004,38(2):255-266.
[9] Barker D J, Stuckey D C. A review of soluble microbial products(SMP) in wastewater treatment systems [J]. Water Research,1999,33(14):3063-3082.
[10] Vyrides I, Stuckey D C. Effect of fluctuations in salinity on anaerobic biomass and production of soluble microbial products(SMPs) [J]. Biodegradation, 2009,20(2):165-175.
[11] 何品晶,赵有亮,郝丽萍,等.葡萄糖模拟废水高温厌氧消化中SMP的特性研究 [J]. 中国环境科学, 2010,30(3):315-321.
[12] Lu F, Chang C H, Lee D J, et al. Dissolved organic matter with multi-peak fluorophores in landfill leachate [J]. Chemosphere,2009,74(4):575-582.
[13] Gaudy A F. Colorimetric determination of protein and carbohydrate [J]. Industrial Water Wastes, 1962,7:17-22.
[14] Chen W, Westerhoff P, Leenheer J A, et al. Fluorescenceexcitation-Emission matrix regional integration to quantify spectra for dissolved organic matter [J]. Environmental Science and Technology, 2003,37(24):5701-5710.
[15] Fukuzaki S, Nishio N, Shobayashi M, et al. Inhibition of the fermentation of propionate to methane by hydrogen, acetate and propionate [J]. Applied and Environmental Microbiology, 1990,56:719-723.
[16] Ahring B K, Westermann P. Product inhibition of butyrate metabolism by acetate and hydrogen in a thermophilic coculture[J]. Applied and Environmental Microbiology, 1988,54(10):2393-2397.
[17] Hattori S. Syntrophic acetate-oxidizing microbes in methanogenic environments [J]. Microbes and Environments, 2008,23(2):118-127.
[18] Qu X, Vavilin V A, Mazéas L, et al. Anaerobic biodegradation of cellulosic material: Batch experiments and modelling based on isotopic data and focusing on aceticlastic and non-aceticlastic methanogenesis [J]. Waste Management, 2009,29:1828-1837.
[19] Lee M J, Zinder S H. Hydrogen Partial Pressures in a Thermophilic Acetate-Oxidizing Methanogenic Coculture [J].Applied and Environmental Microbiology, 1988,54(6):3367-3373.
[20] Conrad R. Contribution of hydrogen to methane production and control of hydrogen concentrations in methanogenic soils and sediments [J]. FEMS Microbiology Ecology, 1999,28(3):193-202.
[21] Qu X, Mazéas L, Vavilin V A, et al. Combined monitoring of changes in δ13CH4and archaeal community structure during mesophilic methanization of municipal solidwaste [J]. FEMS Microbiol, Ecology, 2009,68:236-245.
[22] Kraemer J T, Bagley D M. Supersaturation of dissolved H2and CO2during fermentative hydrogen production with N2sparging [J].Biotechnology Letters, 2006,28(18):1485-1491.
[23] Fynn G, Syafila M. Hydrogen regluation of acetogensis from glucose by freely suspended and immobilised acidogenic cells in continuous culture [J]. Biotechnology Letters, 1990,12(8):621-626.
[24] Kobayshi H A, de Macario E C, Williams R S, et al. Direct Characterization of Methanogens in Two High-Rate Anaerobic Biological Reactors [J]. Applied and Environmental Microbiology,1988,54(3):693-698.
[25] Xu S Y, He P J, Lu F, et al. Transformation of organic matters in fresh leachate during anaerobic degradation under long hydraulic retention time [J]. Journal of Environmental Sciences-China,2009,21(9):1302-1308.
[26] Zubay G L. Biochemistry [M]. MA, USA: Addison-Wesley Publishing Co., Reading, 1983.
[27] Wang Z W, Wu Z C, Tang S J. Characterization of dissolved organic matter in a submerged membrane bioreactor by using three-dimensional excitation and emission matrix fluorescence spectroscopy [J]. Water Research, 2009,43(6):1533-1540.
[28] Barker D J, Mannucchi G A, Salvi S M L, et al. Characterisation of soluble residual chemical oxygen demand (COD) in anaerobic wastewater treatment effluents [J]. Water Research, 1999,33(11):2499-2510.
[29] Langenhoff A A M, Intrachandra N, Stuckey D C. Treatment of dilute soluble and colloidal wastewater using an anaerobic baffled reactor: Influence of hydraulic retention time [J]. Water Research,2000,34(4):1307-1317.
[30] Vavilin V A, Qu X, Mazéas L, et al. Methanosarcina as the dominant aceticlastic methanogens during mesophilic anaerobic digestion of putrescible waste [J]. Antonie van Leeuwenhoek,2008,94:593-605.
[31] Niclas K, Westphal A, Schmidt S, et al. Anaerobic Digestion of Renewable Biomass: Thermophilic Temperature Governs Methanogen Population Dynamics [J]. Applied and Environmental Microbiology, 2010,76(6):1842-1850.
Effect of biogas recirculation and hydrogen removal on the process of thermophilic anaerobic digestion.
Pin-jing*, LI Lei, HAO Li-ping, LU Fan, SHAO Li-ming (Institute of Waste Treatment and Reclamation, College of Environmental Science and Engineering, Tongji University, Shanghai 200092, China). China Environmental Science,2011,31(2):245~252
Two anaerobic sequenced batch reactors (ASBR) fed with glucose and sodium acetate were applied to investigate the effect of biogas recirculation, i.e. recycling the biogas with and without hydrogen removal, on their performance. Acetate metabolic rate, effluent properties and microbial morphologies were studied. Meanwhile, molecular weight (MW) distribution and fluorescence feature of soluble microbial products (SMP) were analyzed by size exclusion chromatography and fluorescence excitation-emission matrix spectroscopy. Gas regulation improved the mixing condition,which accelerated the anaerobic reaction rates such as methanogenesis. The residual volatile fatty acids (VFAs) declined from 238.2mg/L (without hydrogen removal) and 129.6mg/L (with hydrogen removal) to 8.5mg/L and 8.2mg/L,respectively. Biogas recirculation eventually decreased the SMP content, which fell to 36.8% and 59.2% of the initial values respectively after 45days. Hydrogen removal promoted acetogenesis and acetate oxidation, and obviously changed the concentrations of methanogenic precursors and the microbial morphologies. It also promoted the conversion of high MW-SMP to low MW-SMP. Gas recirculation improved the quality of the effluent, while hydrogen removal accelerated the metabolism of acetate, thus is expected to facilitate the release of methanogensis from acidification and enhance the anaerobic conversion of organics.
biogas recirculation;hydrogen partial pressure;thermophilic anaerobic digestion;soluble microbial products
X705
A
1000-6923(2011)02-0245-08
2010-06-22
国家自然科学基金资助项目(50708069;50878166);国家“863”项目(2008AA062401);教育部高等学校博士点基金课题(20070247009)
* 责任作者, 教授, solidwaste@tongji.edu.cn
何品晶(1962-),男,浙江诸暨人,教授,博士,研究方向为固体废物处理与资源化技术.发表论文280篇.

