高效液相色谱-串联质谱法测定水果、蔬菜中赤霉素残留
赵瑛博,周艳明,*,忻 雪,2,王岩松
(1.沈阳农业大学分析测试中心,辽宁 沈阳 110866;2.沈阳市粮油检测计量所,辽宁 沈阳 110021;3.沈阳产品质量监督检验院,辽宁 沈阳 110022)
高效液相色谱-串联质谱法测定水果、蔬菜中赤霉素残留
赵瑛博1,周艳明1,*,忻 雪1,2,王岩松3
(1.沈阳农业大学分析测试中心,辽宁 沈阳 110866;2.沈阳市粮油检测计量所,辽宁 沈阳 110021;3.沈阳产品质量监督检验院,辽宁 沈阳 110022)
建立一种快速、灵敏的检测蔬菜水果中赤霉素残留量的高效液相色谱-串联质谱(HPLC-MS/MS)方法。采用甲醇溶液作为提取剂,调节pH值后用乙酸乙酯萃取,有机相浓缩后用C18固相萃取柱净化,净化后的溶液用液相色谱-串联质谱仪检测,外标法定量。结果表明:该方法线性范围为0.01~10.0μg/mL,检测限为0.01μg/mL;在添加浓度0.02~1.0mg/kg范围内,赤霉素的平均回收率在77.0%~100.0%之间,变异系数在3.39%~10.05%之间(n=5)。该方法具有灵敏、准确度高的特点,能够满足限量检测的要求。
赤霉素;残留;高效液相色谱-串联质谱(HPLC-MS/MS)
赤霉素是一种广谱性植物生长调节剂,在植物生长、发育的各个阶段都有重要的调节作用,广泛应用于水果、蔬菜的增产、增效方面[1],正因为赤霉素的广泛使用,其在水果、蔬菜的生产中有被滥用的情况,而赤霉素的残留对人类存在潜在危险。目前我国对赤霉素的最高残留限量未做出规定,美国、日本等国家规定其在水果、蔬菜中的最高残留限量为0.2mg/kg[2]。为了对生产中赤霉素的使用情况进行监测,保证食品安全,有必要对赤霉素残留量的检测方法进行研究。目前赤霉素的检测方法主要有荧光光谱法[3]、酶联免疫法[4-5]、气相色谱法[6-7]、毛细管电泳-质谱[8]和液相色谱法[9-19]等。这些方法中有些前处理方法太过繁琐,有些方法灵敏度较低,本实验拟采用高效液相色谱-串联质谱法建立一种前处理较为简便、灵敏度较高的测定赤霉素残留的方法,以期为标准的建立提供一定的参考依据。
1 材料与方法
1.1 材料与试剂
蔬菜、水果 市售。
甲醇(色谱纯) 美国Fisher公司;乙酸乙酯(分析纯)、无水甲酸(分析纯)、盐酸(分析纯) 沈阳化学试剂厂;赤霉素(GA3)标准品(纯度≥99%) 美国Sigma公司。
1.2 仪器与设备
1100 液相色谱仪 美国Agilent公司;API-4000串联质谱仪(配有电喷雾离子源) 美国ABI公司;SPE-Pak C18固相萃取小柱 美国Waters公司;KQ-500DV数控超声波清洗器 昆山市超声仪器有限公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器设备厂;T25匀浆机 德国IKA公司。
1.3 样品的前处理
1.3.1 提取
称取10g(精确至0.01g)样品于100mL烧杯中,加入20mL甲醇-水(80:20,V/V)溶液,在10000r/min条件下均质1min,布氏漏斗抽滤,滤液收集于鸡心瓶中。在旋转蒸发仪上(水浴温度45℃)浓缩至约5mL。
1.3.2 净化
分析泄水闸闸室段基础锚筋桩施工以及质量控制措施……………………………………………………… 胡志坚(4-45)
浓缩液用0.1mol/L盐酸调pH3.0~4.0后,加入5mL乙酸乙酯振荡1min,静置分层。取上层有机相4mL,旋转蒸发至近干,残渣用1mL甲醇-水(5:95,V/V)溶液定容后,过SPE-Pak C18固相萃取小柱(使用前分别用1mL甲醇和1mL水活化),用3mL甲醇-水(40:60,V/V)溶液洗脱,收集洗脱液。将洗脱液蒸至近干后用甲醇定容至1mL,过0.22μm的滤膜,待测。
1.4 色谱条件

表1 流动相梯度组成和流速Table 1 Compositions and flow rate of mobile phase
色谱柱:Agilent Zorbax SB-C18(2.1mm×100mm,3.5μm);流动相:A为甲醇;B为甲酸-水溶液(0.2:99.8,V/V),流动相梯度组成和流速如表1所示;柱温35℃;进样量:2 0μL。
1.5 质谱条件
离子源为电喷雾电离源(ESI);扫描方式为负离子扫描模式;检测方式为多反应监测(MRM);雾化气流速70L/min;干燥气流速60L/min;干燥气温度600℃;喷雾电压为-4500V。母离子、子离子、定量离子对及对应的锥孔电压和碰撞电压见表2。

表2 赤霉素的串联质谱参数Table 2 MS/MS parameters of gibberellin
2 结果与分析
2.1 提取剂的选择
对于蔬菜水果等含水量多的样品,应选用与水互溶的溶剂作为提取剂。实验中分别使用甲醇-水(60:40,V/V)溶液1、甲醇-水(80:20,V/V)溶液2以及纯甲醇作提取溶剂,比较其对回收率的影响。结果表明,甲醇-水溶液1提取效果较差(回收率56.73%),不宜采用;甲醇-水溶液2和纯甲醇提取植物组织中的赤霉素,回收率(分别为86.4%和89.5%)均能达到要求,但使用纯甲醇提取时,在接下来的液液萃取时容易发生乳化现象,所以采用甲醇-水溶液2作为提取剂。
2.2 pH值的选择
赤霉素为一种弱酸,其pKa=3.8,在酸性溶液中赤霉素处于分子状态,用乙酸乙酯萃取时,分子状态的赤霉素易于分配在有机相中。研究提取液pH值和赤霉素回收率的关系,结果表明,当pH3.0~4.0时,赤霉素的回收率最高(92%)。
2.3 旋转蒸发温度的选择
赤霉素在高温条件下容易分解,所以在旋转蒸发时不能采用太高的温度,但是温度也不能太低,否则乙酸乙酯蒸发的速度慢,赤霉素长时间受热也会造成一定的损失。分别考察蒸发温度在40、45、50、60℃条件下的赤霉素回收率,发现蒸发温度大于50℃后,回收率有明显损失,所以选择的旋转蒸发温度为45℃。
2.4 净化条件的选择
2.4.1 净化方式的确定
使用C18固相萃取柱和石油醚液液萃取两种方式对样品进行净化。比较之后发现,石油醚虽然可以去除一部分杂质和色素,但在实验过程中,石油醚处理后的提取液仍显黄褐色,净化效果不佳。C18柱处理过的提取液不仅色素残留量少,而且回收率较高,所以采用C18固相萃取方法。
2.4.2 洗脱液的确定
本实验对洗脱液甲醇体积分数和用量进行考察,在固相萃取柱上加赤霉素标准溶液,分别选取甲醇体积分数为10%、20%、30%、40%、50%、60%、80%和100%的洗脱液进行洗脱,每1mL收集一次过柱后的样液,分别检测其回收率,结果见表3。
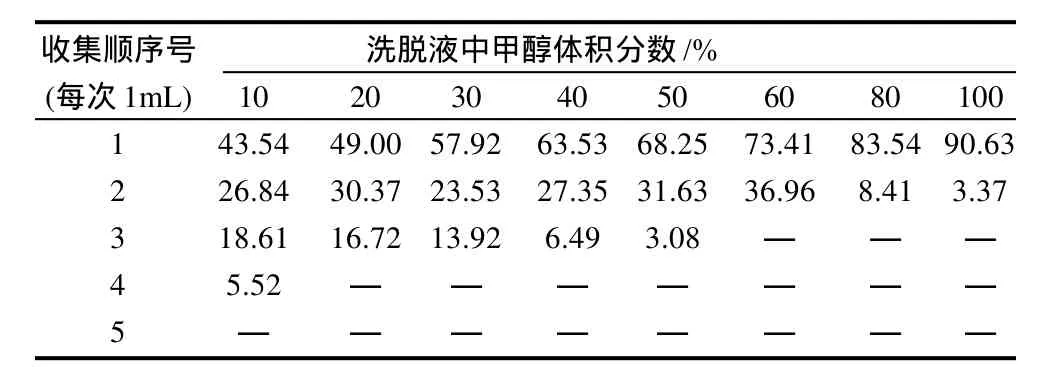
表3 不同洗脱方式条件下的赤霉素回收率Table 3 Recovery rates of gibberellin at the conditions of different elution methods
由表3可见,当洗脱液中甲醇体积分数偏低时,需要大量的洗脱液以获得较高的回收率,但此时洗脱液中赤霉素的浓度较低;当甲醇体积分数大于50%时,虽然洗脱液用量减小,但同时将杂质洗脱,净化效果差;当甲醇体积分数为40%时,3mL的洗脱液即可将赤霉素洗脱,并且所含杂质较少,所以确定洗脱液中甲醇体积分数为40%,洗脱体积为3mL。
2.5 色谱条件的确立
根据参考文献,在赤霉素色谱分离过程中,多采用甲醇-甲酸水体系作为流动相。为了得到较好的分离效果和较短的分析时间采用了梯度洗脱的方式,结果见图1。
液-质联用方法中,常在流动相中加入甲酸,可以提高组分的电离效率;同时赤霉素分子中含有羧基,在流动相中加入甲酸能够抑制其电离,改善其峰形。本实验考察甲酸在水相中的体积分数分别为0.5%和0.2%时赤霉素的峰形,发现甲酸的量对赤霉素的峰形影响不大,考虑到固定相对pH值的耐受,选择0.2%的甲酸溶液作为流动相。
2.6 质谱条件的确立
在电喷雾电离源(ESI)负离子模式下,采用直接进样方式对赤霉素进行分析,获得其一级质谱图(图2)。

图2 赤霉素的一级质谱图Fig.2 MS spectrum of gibberellin
确定其一级质谱的分子离子峰为m/z345,再以m/z345为母离子,得到其相应的二级质谱图(图4)。

图3 赤霉素的二级质谱图Fig.3 MS/MS spectrum of gibberellin
从图3可以确定,赤霉素的子离子主要是m/z239和m/z143,子离子m/z239的丰度最大。因此,可以确定在用质谱分析赤霉素时,定量离子对为m/z345>m/z239,定性离子对为m/z345>m/z239,m/z345>m/z143。然后再对锥孔电压和毛细管电压等参数进行优化,使分子离子和特征碎片离子强度达到最大,确定最佳质谱参数。
按实验确定的条件对各基质样品进行处理,得到其相应的空白图谱和定量限添加图谱,图4、5是代表样品萝卜的相关谱图,可以看出,样品基质对实验结果影响很小,该方法适于蔬菜水果中赤霉素残留的检测。

图4 萝卜样品空白图Fig.4 Ion current chromatogram of radish blank sample
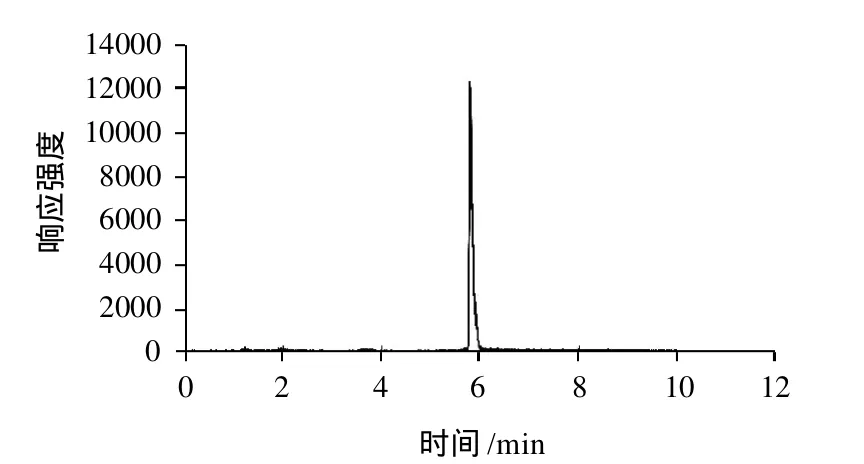
图5 萝卜样品中添加赤霉素(0.02mg/kg)标准品图Fig.5 Ion current chromatogram of radish samples spiked with gibberellin at the level of 0.02 mg/kg
2.7 方法的线性范围和最小检出限
分别配制0.01、0.02、0.1、0.5、1.0、10.0μg/mL的赤霉素标准溶液,其线性方程为Y=1807872.7X-3269.5,相关系数r=0.996,线性范围为0.01~10.0μg/mL。方法的最小检出限为0.01μg/mL(RSN=3)。
2.8 方法的准确度和精密度
准确度是衡量可靠性的指标,色谱法的准确度用添加回收率表示。对10种样品在3个水平(0.02、0.2、1.0mg/kg)上的添加回收率和精密度结果。

表4 10种蔬菜水果中赤霉素回收率及精密度(n=5)Table 4 Recovery rate and precision of gibberellin in 10 kinds of vegetables and fruits (n=5)
由表6可知,10种样品3种不同添加水平的平均回收率在77.0%~100.0%之间,变异系数(VC)在3.39%~10.05%之间,方法回收率和变异系数满足农残分析实验方法验证标准(定量检出限在0.01~0.1mg/kg时回收率在70%~120%,变异系数小于22%;定量检出限在0.1~1.0mg/kg时回收率在70%~110%,变异系数小于18%)要求。
3 结 论
本实验建立了一种简便、灵敏、准确的针对蔬菜、水果中赤霉素残留的检测方法。采用甲醇-水溶液对样品中赤霉素进行提取,调节pH值后用SPE-PAK C18固相萃取小柱净化,液相色谱-串联质谱仪检测。结果表明,该方法能满足日本及欧美发达国家的限量检测要求。
[1] 丁静, 沈镇德, 方亦雄, 等. 植物内源激素的提取分离和生物鉴定[J].植物生理学通讯, 1979(2): 27-29.
[2] 吕保英. 食品分析大全[M]. 北京: 高等教育出版社, 1997: 723.
[3] 中华人民共和国浙江进出口商品检验局. SN 0350—1995 出口水果中赤霉素残留量的检测方法[S]. 北京: 中国进出口商品检验局,1998.
[4] 袁琳. 外源赤霉素GA3对大豆光合作用的促进和叶片内源赤霉素GA1+3水平[J]. 植物生理与分子生物学学报, 2008, 28(4): 317-320.
[5] 黄少白, 周燮. GA1,3,4,7酶联免疫检测法(ELISA)的建立[J]. 华北农学报, 1993(4): 46-51.
[6] 付磊, 陶燕飞. 气相色谱法测定草莓中的赤霉素[J]. 武汉科技大学学报, 2002(4): 359-360.
[7] 许庆琴, 范哲峰. 大口径毛细管气象色谱法快速测定植物组织中的赤霉素[J]. 分析科学学报, 2000(6): 524-525.
[8] GE Liya, PEH C Y C, YONG J W H, et al. Analyses of gibberellins by capillary electrophoresis-mass spectrometry combined with solid-phase extraction[J]. Journal of Chromatography A, 2007, 1159(1/2): 242-249.
[9] 张政, 张强, 王转花, 等. 荞麦幼苗内源激素的高效液相色谱测定法[J]. 色谱, 1994, 12(2): 140-141.
[10] 葛亚琨, 张元新, 胡睿, 等. 蔬菜中赤霉素残留量的高效液相色谱检测方法研究[J]. 吉林化工学院学报, 2005, 22(2): 13-15.
[11] 李金昶, 石晶, 赵晓亮, 等. 高效液相色谱法分离和测定3种植物内源激素[J]. 分析化学, 1994, 22(8): 801-804.
[12] 杨彤, 丁兴萃. 植物组织中赤霉素高效液相色谱测定法的可靠性探讨[J]. 竹子研究汇刊, 1999, 18(4): 49-53.
[13] 彭运生, 凌祖铭. 高效液相色谱测定水稻幼苗中内源激素的方法研究[J]. 分析测试学报, 1992, 11(2): 52-55.
[14] IIEDDEN P. Modern methods for the quantitative analysis of plant hormones[J]. Annu Rev Plant Physiol & Plant Mol Biol, 1993, 44(1):107-111.
[16] 方能虎, 邵学广. 萌发水稻中生长激素的反向高效液相色谱法分离测定[J]. 分析化学, 1999, 27(1): 120.
[17] 周艳明, 汤媛, 牛森. 高效液相色谱法检测草莓中赤霉素残留量的研究[J]. 食品工业科技, 2009(1): 311-312; 321.
[18] 刘艳琴, 王浩, 杨红梅, 等. 高效液相色谱-串联四级杆质谱联用测定水果和蔬菜中赤霉素残留量[J]. 现代农业科技, 2009(16): 330-331.
[19] 湛社霞, 孙世宏, 臧李纳, 等. SPE-HPLC法测定水果中的赤霉素、苯甲酸、糖精钠和胭脂红[J]. 中国卫生检验杂志, 2009, 17(3): 1330-1332.
Determination of Gibberellin Residue in Vegetables and Fruits by HPLC-MS/MS
ZHAO Ying-bo1,ZHOU Yan-ming1,*,XIN Xue1,2,WANG Yan-song3
(1. Analysis Test Center, Shenyang Agricultural University, Shenyang 110866, China;2. Institute of Shenyang Grain and Oil Metering, Shenyang 110021, China;3. Shenyang Product Quanlity Supervision and Inspection Institute, Shenyang 110022, China)
A rapid and sensitive high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS) method for the determination of gibberellin residue in vegetables and fruits was developed. The gibberellin in samples was primarily extracted by methanol solution and further extracted by ethyl acetate after pH adjustment from 3 to 4. The extract was purified by C18 column and detected by HPLC-MS/MS with quantification through an external standard method. Linear range of gibberellin in this determination method was between 0.01μg/mL and 10.0μg/mL, and the detection limit was 0.01 μg/mL. The recovery rates of gibberellin in all samples at a spiked level ranging from 0.02 to 1.0 mg/kg were in the range of 77.0% to 100.0% with a CV of 3.39%-10.05%. The results indicated that this developed method was characteristics of high sensitivity and accuracy as wall as low detection limit, which could meet the requirement of MRL determination.
gibberellin;residue;high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS)
TS207.3
A
1002-6630(2011)06-0209-04
2010-06-02
国家标准化管理委员会标准制定项目(2006-1018)
赵瑛博(1979—),女,讲师,硕士,研究方向为食品安全与检测。E-mail:yb_zhao1979@163.com
*通信作者:周艳明(1955—),女,教授,硕士,研究方向为食品安全与检测。E-mail:syauzym@163.com

