超声波辅助酶解法提取五味子乙素
阴冠秀,杜 冰,*,华洋林,赵小艳,杨公明
(1.华南农业大学食品学院,广东 广州 510642;2.无限极(中国)有限公司,广东 广州 510665)
超声波辅助酶解法提取五味子乙素
阴冠秀1,杜 冰1,*,华洋林2,赵小艳2,杨公明1
(1.华南农业大学食品学院,广东 广州 510642;2.无限极(中国)有限公司,广东 广州 510665)
以五味子干果为原料,采用酶解法辅助超声波技术提取其中的五味子乙素。单因素试验结果表明,酶解温度、酶解时间以及酶用量对乙素得率的影响较大。通过响应面回归分析,得到酶解辅助超声波提取乙素的优化工艺条件为酶解温度52.89℃、提取时间4.04h、酶用量0.96%。在此最优条件下,五味子乙素的得率为0.262%。
五味子乙素;酶解提取;超声波;响应面试验;高效液相色谱法
五味子为木兰科植物五味子[Schisandra chinesnsis(Turcz) Baill]的干燥成熟果实,因其产地的不同,又有南北五味子之分,都具有收敛固涩、益气生津、补肾宁心的功效[1-2]。五味子对神经系统、心血管系统、消化系统等具有多种药理作用[3]。现代研究证明,五味子生物活性成分主要是木脂素类的物质,其对中枢神经系统有抑制作用,还具有抗艾滋病毒、抗癌和PAF拮抗等多种活性,并且其对清除自由基也有一定的效果等[4]。五味子木脂素又包括五味子醇甲、五味子醇乙、五味子甲素、五味子乙素等[5]。而五味子乙素在木脂素中的含量较高,其具有抗氧化、清除自由基、降低谷丙转氨酶、抗癌、抑菌等作用[6-10]。
五味子乙素的提取研究主要是采用溶剂提取、超声波、微波提取和超临界CO2提取等[11-15]。利用有机溶剂提取乙素存在能耗高、溶剂消耗大、周期长、工序多、提取率不高等问题。采用微波机超声波提取乙素,具有时间短、能耗少、得率较高的优点,但难以实现规模化生产。超临界CO2萃取,设备较复杂、投资成本高,操作较复杂,且仪器运行成本较高。因此,开发高效率、无污染的提取五味子乙素的方法已成为研究的重点。有研究成果表明,将酶法与超声、微波等现代提取技术结合用于中药提取,可以达到节能、高效的目的[11]。故本实验以五味子干果为样品,研究超声波辅助酶解法对五味子乙素提取率的影响,为酶解制备五味子乙素粗提液的工艺优化提供参考。
1 材料与方法
1.1 材料、试剂与仪器
五味子药材 无限极(中国)公司;五味子乙素对照品(批号110765-200407) 中国药品生物制品鉴定所;纤维素酶(1400U/mg)、果胶酶(500U/mg) 广州市齐云生物技术有限公司;甲醇(色谱纯) 美国Fisher公司;自制超纯水;其余试剂均为分析纯。
LC-10AT型高效液相色谱仪、SPD-10Avp紫外检测器 日本岛津公司;四两装高速中药粉碎机 瑞安市环球药械厂;电子精密天平、pH计 梅特勒-托利多仪器上海有限公司;SH2-88台式水浴恒温振荡器 江苏太仓市实验设备厂;超声波清洗器 昆山禾创超声仪器有限公司;SHZ-III型循环水真空泵 上海亚荣生化仪器厂。
1.2 方法
1.2.1 反相高效液相色谱检测条件
色谱柱:C18(250mm×4.6mm);流动相:甲醇-水(73:27,V/V);流速:1.0mL/min;检测波长:254nm;柱温:室温;进样量:2 0μL。
1.2.2 五味子乙素提取工艺流程
五味子干果→除杂→粉碎→五味子粉→加酶→加一定体积的蒸馏水→调pH值→酶解→加一定体积的无水乙醇→超声波提取→过滤→定容→待测
1.2.3 标准曲线的绘制
精密称取五味子乙素对照品20mg,置100mL容量瓶中,用甲醇溶解并稀释至刻度,摇匀,配制成0.20mg/mL的标准品储液备用。分别精密吸取一定体积上述标准溶液,定容到10mL的容量瓶中,制备成0.01~0.14mg/mL质量浓度梯度的溶液,分别吸取以上溶液20 μL,注入液相色谱仪中,得到扫描曲线图[16]。如图1所示。
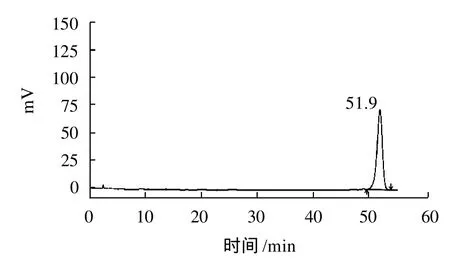
图1 五味子乙素标准品扫描图Fig.1 HPLC chromatogram ofγ-schizandrin standard
以五味子乙素对照品的质量浓度为横坐标、峰面积为纵坐标,检测后得到回归方程为:y=4×107x-17594,R2=0.9996。表明在0.01~0.14mg/mL质量浓度范围内,峰面积与质量浓度呈良好的线性关系。
1.2.4 五味子乙素得率计算
由1.2.3节中标准曲线可以得到:

1.2.5 单因素对五味子乙素得率的影响
五味子干果经过除杂、粉碎后酶解:分别加入果胶酶、纤维素酶、复合酶(纤维素酶与果胶酶质量比为1:1)进行酶解;分别调节酶解液pH值为3.0、3.5、4.0、4.5、5.0进行酶解;分别在温度35、40、45、50、5 5、6 0℃进行酶解;在酶解时间1、2、3、4、5 h进行酶解;分别取酶用量0.1%、0.3%、0.5%、0.7%、0.9%、1.1%进行酶解。分别选取以上单因素进行酶解预处理试验,酶解后加入一定量的乙醇后超声提取30min,过滤后定容待测。
1.2.6 响应面试验优化方案
采用响应面法进行试验数据处理,选用B o x-Behnken模型对影响酶解辅助超声波法提取五味子中五味子乙素得率的因素进行响应面设计,以五味子乙素的含量为响应值进行优化。
2 结果与分析
2.1 单因素试验
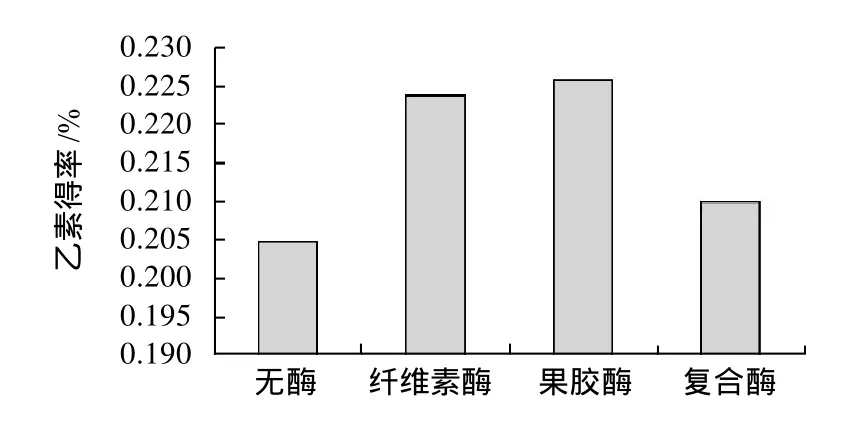
图2 不同酶种类对乙素得率的影响Fig.2 Effect of enzyme type on extraction rate ofγ-schizandrin
2.1.1 最佳酶种类的确定由图2可知,加酶组的乙素得率要高于空白对照组的。通过对加酶组的比较可以看出,采用果胶酶对其进行预处理的作用高于纤维素酶和复合酶,这是因为五味子木脂素主要存在于五味子的种子中[17],并且常常与树脂类的物质共存,故使用果胶酶对乙素提取的效果较好,之后实验均采用果胶酶进行酶解预处理。
2.1.2 酶解液pH值对五味子乙素得率的影响
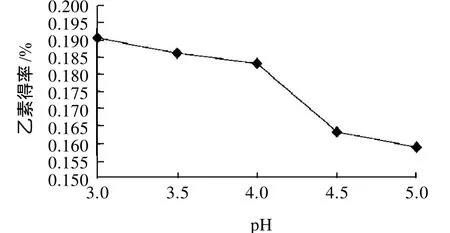
图3 酶解液pH值对乙素得率的影响Fig.3 Effect of pH on extraction rate ofγ-schizandrin
由图3所示,随着pH值的提高乙素得率逐渐降低。所购果胶酶的pH值适用范围是2.5~6.0,其最适pH值为3.5,当pH>3.5时,酶活力会随着pH值的增大而逐渐减小甚至失活,此时乙素的得率也会降低。
2.1.3 酶解温度对五味子乙素得率的影响
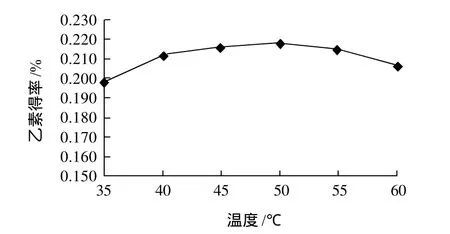
图4 酶解温度对乙素得率的影响Fig.4 Effect of hydrolysis temperature on extraction rate ofγ-schizandrin
由图4可知,酶解温度对乙素得率有较大影响,随着酶解温度的提高,乙素得率呈现先升高后降低的趋势,所购果胶酶作用的温度范围是15~55℃,其最适为50℃。在最适温度作用下,乙素得率达到最大。低于50℃时,酶的活性较低,使得水解度较低,从而使乙素得率也较低;当酶解温度高于50℃时,导致部分果胶酶失活,乙素得率随之降低。说明50℃是最佳的酶解温度。
2.1.4 酶解时间对五味子乙素得率的影响
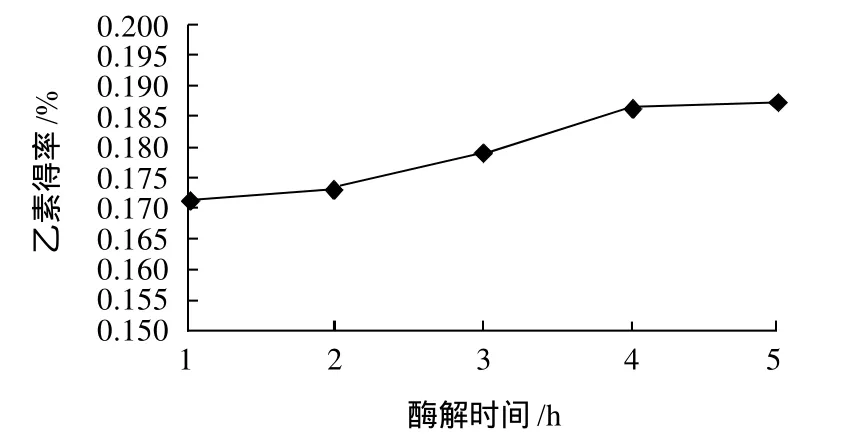
图5 酶解时间对乙素得率的影响Fig.5 Effect of hydrolysis time on extraction rate ofγ-schizandrin
由图5可知,随着酶解时间的延长,乙素得率随之提高。酶解时间在1~4h内,乙素得率增加明显;4h后继续延长酶解反应时间,乙素得率提高并不明显,得率基本趋向稳定。原因是随着加热时间延长,酶可能部分失活,酶的总活力下降,从而导致乙素得率降低。因此酶解反应最佳时间为3~5h。
2.1.5 酶用量对五味子乙素得率的影响
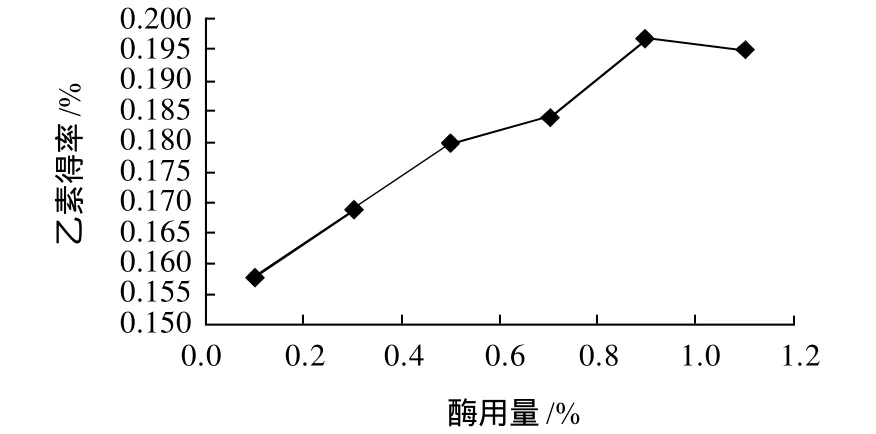
图6 酶用量对乙素得率的影响Fig.6 Effect of enzyme dosage on extraction rate ofγ-schizandrin
由图6可知,酶用量对乙素得率有明显的影响。在一定范围内,乙素提取率随酶用量的增加而先增加后降低。在酶用量0.9%时,乙素得率达到最高值0.197%,之后得率略有降低,故确定酶用量为0.7%~1.1%。
在传感器网络的各种应用中,监测到事件之后关心的一个重要问题就是该事件发生的位置[3]。如在城市交通应用中需要知道交通堵塞信息所对应的具体区域位置;在反恐救灾中需要知道灾害发生的现场位置等。在判断结果位置前,传感器节点必须要先精确定位自身所在的位置,然后才能为最终的结果判定提供依据。但是,在传感器网络中,传感器节点往往是处于移动的状态,如何在移动状态下能够精确定位出节点的位置信息,成为了大家关心热点。
2.2 响应面优化试验
2.2.1 响应面分析因素水平的选取
综合单因素试验结果,故选取酶解温度、时间、酶用量3个因素,在单因素基础上采用三因素三水平的响应面分析方法,试验选用Box-Behnken模型,试验因素与水平设计见表1[18]。

表1 响应面分析因素水平Table 1 Factors and levels in response surface analysis
2.2.2 响应面分析方案及结果
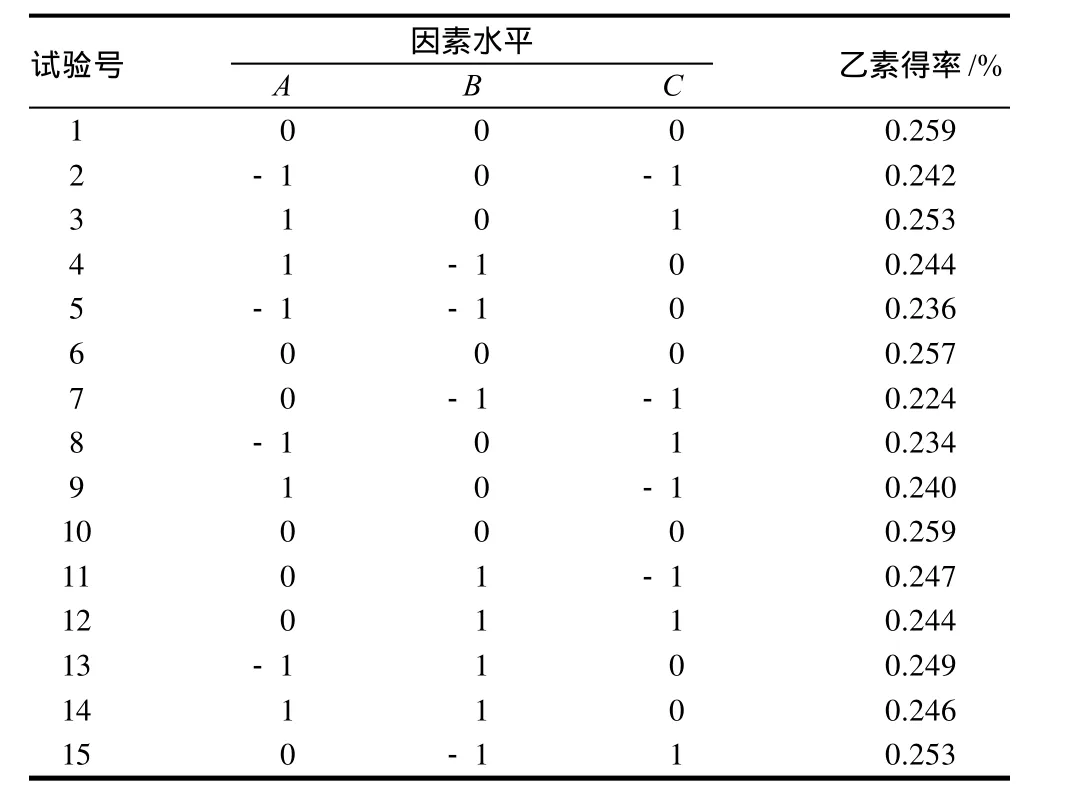
表2 Box-Behnken试验设计及结果Table 2 Scheme and results of Box-Behnken design

表3 回归方程模型的方差分析Table 3 Variance analysis of regression equation
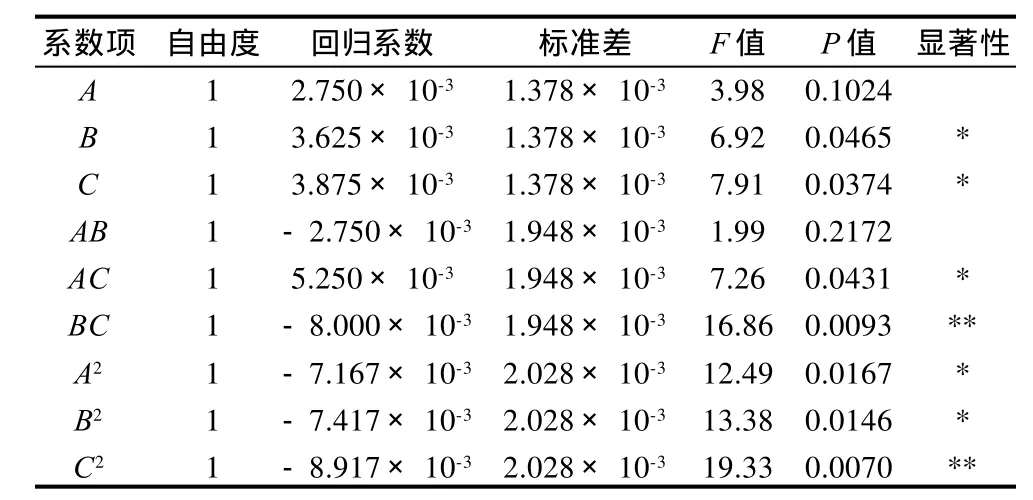
表4 回归方程中回归系数估计值Table 4 Regression coefficient estimates of regression equation
利用Design Expert 7.1.3软件建立的试验设计结果见表2。对表2中数据进行回归分析,得
Y=0.26+2.750×10-3A+3.625×10-3B+3.785×10-3C-2.750×10-3AB+5.250×10-3AC-8.000×10-3BC-7.167×10-3A2-7.417×10-3B2-8.917×10-3C2
由表4回归模型系数显著性检验结果可知,模型的一次项B(时间)、C(酶用量)显著,A(温度)不显著;二次项C2极显著,而A2、B2显著;交互项BC极显著,AC显著,AB不显著。表明各影响因素对于乙素得率不是简单的线性关系。
2.2.3 响应面分析与最优条件的确定
酶解辅助超声波法提取五味子乙素的响应面分析与优化模型的结果见图7。3组图直观地反映了各因素对响应值的影响。
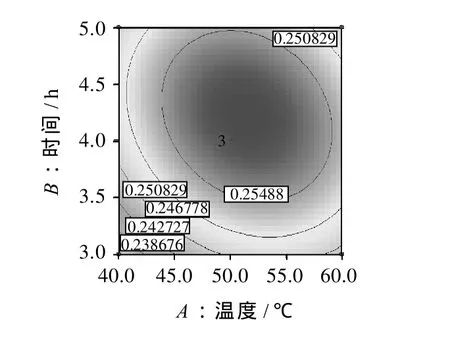
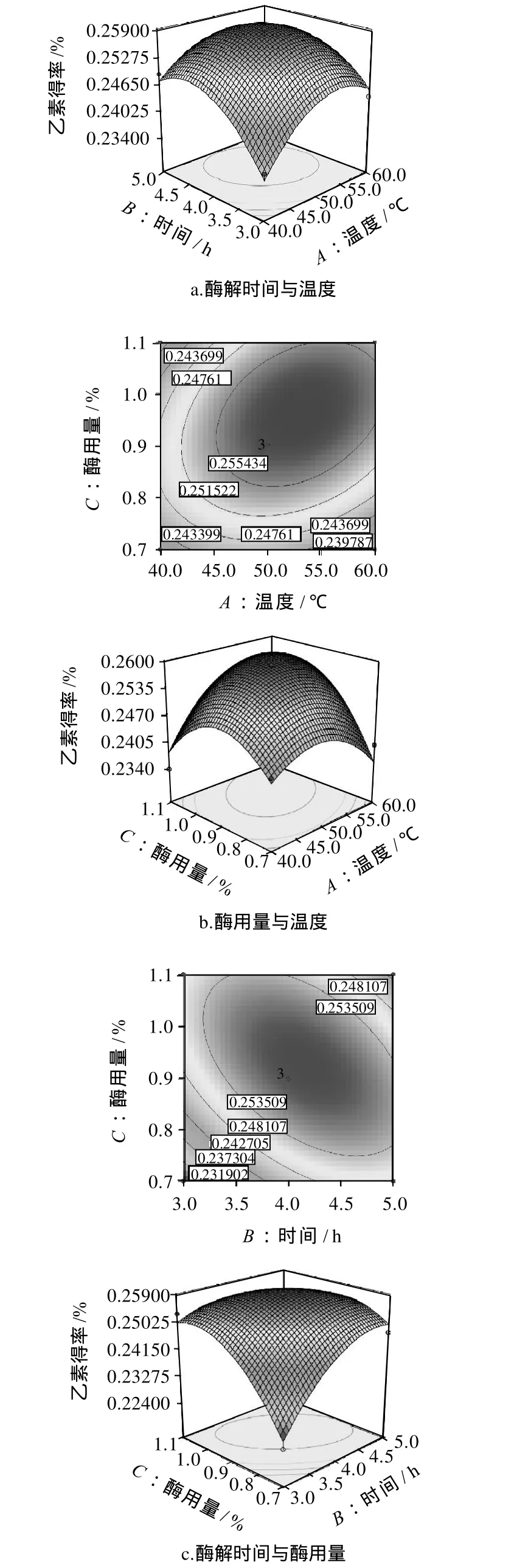
图7 各两因素对乙素得率的响应面图和等高线Fig.7 Response surface and contour plots for the effect of crossinteraction among hydrolysis time, enzyme dosage and hydrolysis temperature on extraction rate ofγ-schizandrin
由图8a、8b可以看出,当酶解温度不变时,随着酶解时间的延长,乙素得率呈现先增大后下降的趋势;当酶解时间不变时,随着酶解温度的升高,乙素得率也呈现出先增大后下降的趋势。这与单因素实验时的分析结果相同,从乙素得率的变化速度来看,酶解时间的主效应大于酶解温度。由图8c可以看出,酶用量与酶解时间对乙素提取率有显著影响,乙素得率随酶解时间、酶用量的增加而增大。比较3组图可知,酶用量的影响为最显著因素,表现为等高线更为陡峭;时间影响次之,表现为等高线曲线较平滑,说明其对响应值影响较小[19]。
采用响应面分析法优化五味子乙素的提取工艺,对方程求导得到最佳工艺条件为A=52.89、B=4.04、C=0.96,即温度52.89℃、提取时间4.04h、酶用量0.96%,在此工艺条件下重复实验3次,乙素的平均得率为0.262%,高于表2中的任一试验组合,证明了用响应面分析法得到的最佳工艺条件的可靠性。
3 结 论
3.1 采用试验设计软件Design Expert 7.1.3,通过Box-Behnken中心组合试验设计得到了酶解辅助超声波法提取五味子乙素的得率与酶解时间、温度及酶用量关系的回归模型,经验证该模型是合理可靠的,能够较好地预测酶解辅助超声波法提取五味子乙素的得率。
3.2 利用模型的响应面及等高线,对影响酶解辅助超声波法提取五味子乙素的关键因素及相互作用进行探讨,得到的优化工艺参数:酶解温度52.89℃、提取时间4.04h、酶用量0.96%;在此工艺条件下验证实验,乙素得率为0.262%。利用响应面分析方法对酶解辅助超声波法提取五味子乙素的工艺条件进行优化,可获得最优的工艺参数,从而为进一步的实验研究提供依据。
[1] 国家药典委员会. 中华人民共和国药典: 一部[M]. 北京: 化学工业出版社, 2005: 44.
[2] 国家药典委员会. 中华人民共和国药典: 一部[M]. 北京: 化学工业出版社, 2005: 169.
[3] 刘超, 朱宏吉. 五味子研究现状[J]. 医药产业资讯, 2007, 4(32):15-16.
[4] LEE I S, JUNG K Y, OH S R, et al. Platelet-activating factor antagonistic activity and13C NMR assignment of pregomisin and chamigrenal fromSchisandra chinensis[J]. Arch Pharmacal Res, 1997, 20(6): 633-636.
[5] 陈业高, 秦国伟, 谢毓元. 五味子科植物的木脂素成分[J]. 武汉植物学研究, 2001, 19(2): 158-168.
[6] 孙成仁, 彭正松. 北五味子的抑菌作用[J]. 四川师范学院学报: 自然科学版, 1993, 14(3): 200-202.
[7] 刘华英. 北五味子木脂素提取工艺及提取物抑菌作用的研究[D]. 长春: 吉林农业大学, 2006.
[8] 刘虹, 地力拜尔, 姚志道. 五味子抗氧化作用的研究与临床应用展望[J]. 新疆医学, 2005, 35(4): 137-139.
[9] 张震. 五味子的营养成分及其价值[J]. 现代农业科技, 2008(16): 112.
[10] 孙友敏, 张红雨. 五味子素清除自由基构效关系的理论解释[J]. 淄博学院学报: 自然科学与工程版, 2001, 3(2): 76-80.
[11] 吴艳玲, 朴惠善. 北五味子活性成分提取工艺的研究[J]. 时珍国医国药, 2007, 18(5): 1176-1177.
[12] 郭春梅. 不同产地的五味子中五味子乙素含量测定[J]. 黑龙江医药,2003, 16(1): 6-7.
[13] 孟宪军, 刘溪, 商红军. 超临界流体萃取五味子乙素研究[J]. 食品研究与开发, 2009, 30(3): 37-39.
[14] 黄天辉, 沈平孃. 均匀设计优选微波萃取五味子的工艺研究[J]. 中成药, 2006, 28(8): 1111-1113.
[15] 孟宪军, 吴倩, 商红军. 微波辅助萃取五味子乙素的研究[J]. 食品工业科技, 2009, 30(6): 254-256.
[16] 中华人民共和国卫生部. 保健食品检验与评价技术规范[M]. 北京:化学工业出版社, 2003: 298-299.
[17] 薛津. 北五味子有效成分研究概况[J]. 黑龙江农业科学, 2006(2):74-76.
[18] 阮桂海. SAS统计分析实用大全[M]. 北京: 清华大学出版社, 2003:334-339.
[19] 张丽晶, 林向阳, 彭树美, 等. 响应面法优化绿茶微波真空干燥工艺条件[J]. 食品科学, 2009, 30(22): 122-125.
Ultrasound-assisted Enzymatic Extraction ofγ-Schizandrin fromSchisandra chinesnsis(Turcz) Baill
YIN Guan-xiu1,DU Bing1,*,HUA Yang-lin2,ZHAO Xiao-yan2,YANG Gong-ming1
(1. College of Food Science, South China Agricultural University, Guangzhou 510642, China;2. Infinitus (China) Company Ltd., Guangzhou 510665, China)
In this study,Schisandra chinesnsis(Turcz) Baill was used as the raw material to extractγ-schizandrin by ultrasound-assisted enzymatic hydrolysis. Single-factor experiments indicated that extraction rate ofγ-schizandrin was greatly affected by hydrolysis temperature, hydrolysis time and enzyme dosage. The optimal extraction conditions were explored by response surface analysis to be hydrolysis temperature of 52.89 ℃, extraction time of 4.04 h, and enzyme dosage of 0.96%. Under the optimal extraction conditions, the extraction rate ofγ-schizandrin was up to 0.262%.
γ-schizandrin;enzymatic hydrolysis;ultrasound;response surface analysis;high performance liquid chromatography (HPLC)
R284.2
A
1002-6630(2011)06-0115-05
2010-05-07
阴冠秀(1984—),女,硕士研究生,研究方向为水产品加工与贮藏。E-mail:yin.gx@163.com
*通信作者:杜冰(1973—),男,副教授,博士,研究方向为食品生物技术。E-mail:gzdubing@163.com

