大孔树脂吸附纯化青钱柳叶三萜化合物
尹忠平,上官新晨,*,张月红,黎冬明,吴少福,陈继光
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.江西农业大学植物资源开发与利用研究室,江西 南昌 330045)
大孔树脂吸附纯化青钱柳叶三萜化合物
尹忠平1,2,上官新晨1,2,*,张月红2,黎冬明2,吴少福2,陈继光2
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.江西农业大学植物资源开发与利用研究室,江西 南昌 330045)
为得到纯度较高的青钱柳叶三萜化合物,采用大孔树脂吸附法对青钱柳叶三萜粗提物进行纯化研究。静态吸附实验结果表明,AB-8树脂对青钱柳叶三萜化合物吸附、解吸性能较好,比饱和吸附量为77.49mg/g,解吸率为85.44%,总回收率可达72.01%。AB-8树脂动态吸附-解吸实验表明:上柱流速增大,吸附率呈降低趋势;随着上柱液质量浓度增大,吸附率先升后降;95%乙醇洗脱效果较好,10BV为合理用量;随着洗脱流速增大,洗脱液峰浓度降低,洗脱率减小,综合考虑以1.5mL/min较为适宜。经AB-8树脂纯化后,三萜类物质纯度可达44.30%。
青钱柳;三萜化合物;大孔树脂;纯化
青钱柳(Cyclocarya paliurus(Batal.) Iljinsk)为我国特有的胡桃科青钱柳属单种属珍稀植物,主要分布于我国长江中下游地区,当地人将其叶制成降糖降脂保健茶饮用已有200多年历史,江西修水青钱柳降糖神茶系列产品还取得了中国原产地标记保护。研究表明,青钱柳富含三萜类、黄酮类、多糖类及微量元素等功能活性成分,具有降糖、降脂、抗肿瘤、抗氧化及提高免疫力等多种功能,是良好的天然保健食品资源[1-3]。研究已经证实,大多数三萜化合物都具有药理活性,如抗糖尿病[4]、抗肿瘤[5]、抗氧化[6]、抗炎[7]等,在医药和保健食品领域具有重要的应用价值。三萜化合物是青钱柳中一类重要的活性物质,具有降糖、降压等功能活性[8],目前关于此类物质的研究报道较少。青钱柳叶三萜粗提物中含有多糖、蛋白质、黄酮等杂质,纯化难度较大。大孔树脂吸附纯化是20世纪70年代发展起来的一种新型纯化方法,具有吸附容量大、再生简单、稳定可靠等诸多优点,是分离纯化三萜类、黄酮类、多糖类等物质的重要方法[9]。本研究以大孔树脂吸附法对青钱柳三萜粗提物的纯化进行探讨,旨在为青钱柳资源的深度开发利用提供参考。
1 材料与方法
1.1 材料与试剂
青钱柳叶采自江西省修水县,去除杂质和枝杆后,常压干燥,粉碎过60目筛备用。
AB-8、DM130、HPD100、HPD722 大孔树脂 沧洲宝恩吸附材料科技有限公司;D3520、D4020大孔树脂 南开大学化工厂;熊果酸标准品 中国药品生物制品检定所;所用化学试剂均为分析纯。
1.2 仪器与设备
UV-754紫外-可见分光光度计 上海光谱仪器有限公司;HF-2.5B超声循环提取机 北京弘祥隆生物技术开发有限公司;RE-52A型旋转蒸发器 上海亚荣生化仪器厂;QT-1旋涡混合器 上海琪特分析仪器系统有限公司。
1.3 方法
1.3.1 三萜化合物检测
参照洪艳平[10]、凌庆枝[11]等的方法。检测标准曲线的绘制过程如下:精确吸取对照品熊果酸溶液(90μg/mL)200、400、600、800、1000、1200、1400、1800、2200μL,分别加入具塞试管,水浴挥干。分别加入50g/L香草醛-冰乙酸和高氯酸各0.3mL和1.0mL,混匀,70℃水浴15min,迅速冷却后加入4.0mL冰乙酸,于550nm波长处测定吸光度。测定回归方程为:y=0.0047x-0.0166,R2=0.9977,式中,y为吸光度,x为熊果酸量/μg。
1.3.2 三萜化合物提取
准确称量青钱柳叶干粉(60℃干燥至质量恒定),石油醚脱脂(等体积脱脂2次),挥干石油醚,以65%乙醇超声辅助提取30min,离心(3000r/min、10min),同条件二次提取,合并各级提取液,真空浓缩得三萜化合物粗提物。
1.3.3 三萜粗提物纯化工艺流程
三萜粗提物水溶液→上大孔树脂层析柱→蒸馏水洗柱→不同乙醇溶液梯度洗柱→收集目标组分(以薄板层析,L-B显色鉴定[12])→真空浓缩干燥→纯化三萜化合物
1.3.4 树脂预处理
按厂家说明书进行处理。
1.3.5 静态吸附-解吸实验
1.3.5.1 静态吸附实验
准确称取经预处理后滤干水分的AB-8、DM130、HPD100、HPD722、D3520、D4020大孔树脂各1g,置于磨口三角瓶中,各加入45mL已测定质量浓度的三萜粗提物水溶液,置于恒温摇床中进行吸附(115r/min,28℃),至上层液吸光度恒定时终止吸附,静置取上清液测三萜化合物质量浓度。
比饱和吸附量(Qe)/(mg/g)=(吸附前质量浓度-吸附后质量浓度)×吸附液体积/树脂质量

1.3.5.2 静态解吸实验
将按1.3.5.1节吸附饱和的树脂加入到60mL 95%的乙醇中,置于恒温摇床中进行解吸(115r/min,28℃),至上层液吸光度恒定时终止解吸,静置取上清液测三萜化合物质量浓度。

1.3.6 动态吸附-解吸实验
1.3.6.1 动态吸附实验
准确称取经预处理后滤干水分的AB-8树脂,湿法上柱,蒸馏水平衡后进行动态吸附-解吸实验。取一定质量浓度的三萜粗提物水溶液,以1.25mL/min的流速上柱,每1BV为1单位收集流出液,测定其三萜类物质含量,至流出液质量浓度接近上柱液且基本恒定时停止上柱,以流出液体积为横坐标、三萜类物质质量浓度为纵坐标绘制动态吸附曲线。
取等量三萜粗提物水溶液,分别以原液、2倍稀释液、4倍稀释液、8倍稀释液以相同流速上柱,同条件洗脱,测定吸附纯化后的三萜类物质含量,以分析上柱液质量浓度对吸附效果的影响。
取等体积等质量浓度三萜粗提物水溶液,分别以0.75、1.5、2.25、3.0mL/min的流速上柱,同条件洗脱,测定吸附纯化后的三萜类物质含量,以分析上柱流速对吸附效果的影响。
1.3.6.2 动态解吸实验
准确称取经预处理后滤干水分的AB-8树脂,湿法上柱,蒸馏水平衡,以一定质量浓度的三萜粗提物水溶液上柱,至流出液三萜类物质质量浓度为上柱液的1/5时停止上柱,10BV蒸馏水冲洗,再以10BV的40%、60%、80%、95%乙醇梯度洗脱,以高效铝质薄板层析,L-B显色鉴定,比较各梯度洗脱液中三萜类物质的种类。
取以相同条件吸附的树脂柱,以10BV蒸馏水冲洗,10BV 40%乙醇洗脱去杂,再分别以20BV 60%、80%、95%、100%乙醇进行洗脱并测定洗脱液中三萜类物质的含量,以确定洗脱液乙醇体积分数。
吸附后完成冲洗的树脂柱,40%乙醇洗脱去杂,再以95%乙醇洗脱,每1BV为1单位收集流出液,测定三萜类物质含量,绘制洗脱曲线。以不同流速进行洗脱,绘制洗脱曲线,以确定优选洗脱流速。
2 结果与分析
2.1 大孔树脂静态吸附性能比较及筛选
大孔树脂种类繁多,因极性、孔径、比表面积不同而对吸附液中各组分的吸附作用有强有弱,解吸的难易也有区别。选择合适的树脂是大孔树脂吸附纯化的第一步,也是其中的关键环节。本研究根据吸附纯化的基本原理,选择6种树脂进行实验,其中D3520和D4020为非极性,AB-8、HPD100和HPD722为弱极性,DM130为中等极性,以静态吸附法对树脂进行筛选。实验结果(表1)表明:非极性的D3520和D4020对青钱柳三萜的吸附率较低,总回收率明显低于弱极性和中等极性的树脂;相对来说,AB-8具有较好的吸附、解吸性能,比饱和吸附量为77.49mg/g,解吸率为85.44%,总回收率可达72.01%。因此,本实验选择AB-8树脂进行下一步的动态吸附-解吸实验。
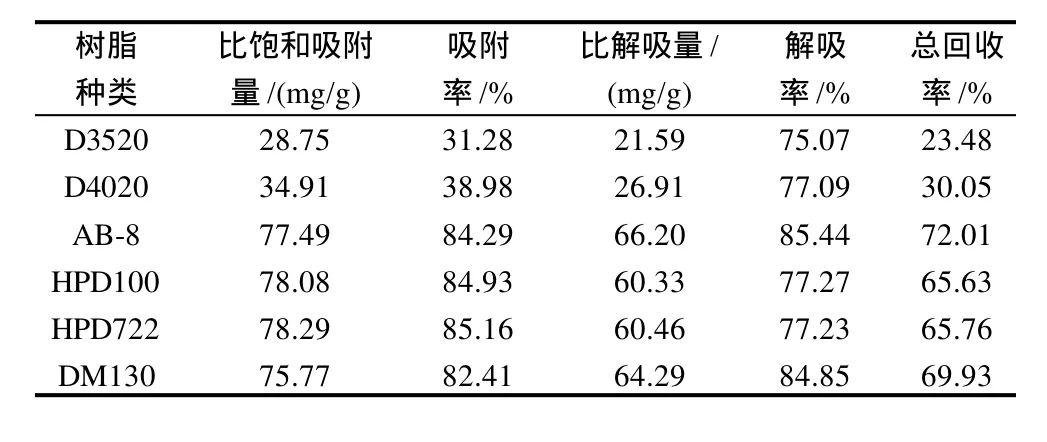
表1 大孔树脂静态吸附性能比较Table 1 Comparison on static adsorption and desorption capabilities of different types of macro-porous resins
2.2 AB-8树脂动态吸附曲线
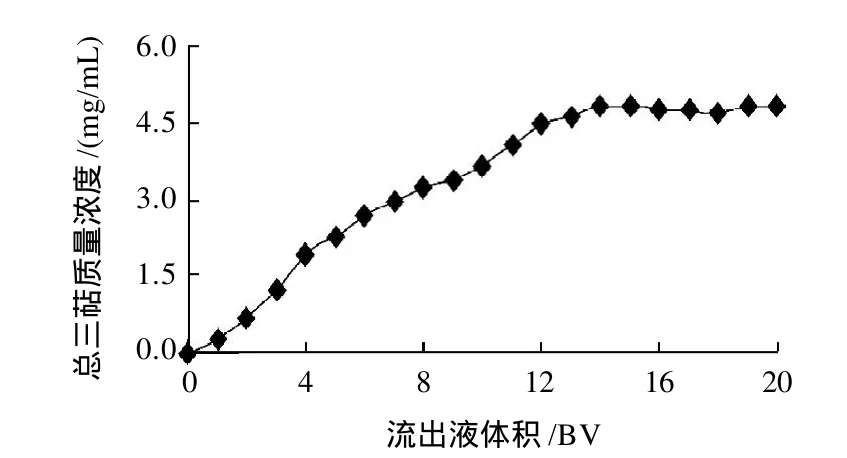
图1 AB-8树脂动态吸附曲线Fig.1 Dynamic adsorption curve of AB-8 resin
取6.070mg/mL的三萜粗提物水溶液,以1.25mL/min的流速上柱,每1BV为1单位收集流出液绘制动态吸附曲线,结果如图1所示。当上柱体积为3BV时,流出液的质量浓度为1.208mg/mL,接近上柱液质量浓度的1/5,达到了泄漏点质量浓度。因此,AB-8树脂吸附纯化6.070mg/mL青钱柳叶三萜粗提物水溶液的处理能力为3BV。当上柱体积达到12BV后,流出液的质量浓度趋于平稳,可以认为达到了树脂的饱和吸附点。为充分利用树脂的吸附能力,可采用循环上柱或多柱串联的形式纯化三萜类物质。
2.3 上样速度对吸附的影响
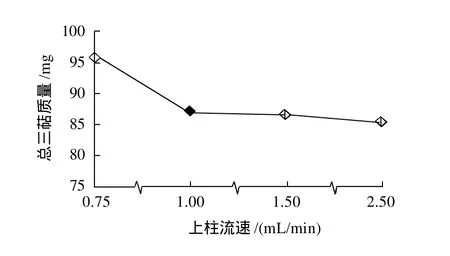
图2 不同上样流速时的吸附效果Fig.2 Effect of sample solution flow rate on adsorption efficiency of AB-8 resin
不同的上样速度,目标物与树脂的接触时间不同,吸附量也因此会发生变化。由图2可知,随着上样速度的增大,三萜类物质的吸附量呈下降的趋势,上样速度为0.75mL/min时吸附率较高。树脂对目标物的吸附需要一个扩散和接触的过程,上样速度过快,目标物与树脂还未来得及充分接触就已下移到下一个吸附层面,以致于很快通过层析柱流出柱外,这样就无法形成有效的吸附,同时造成谱带的扩散,影响分离效果。因此,以AB-8树脂纯化青钱柳叶三萜类物质时,应降低上样速度以提高吸附率,但上样速度太低会使得纯化效率很低,实际应用时可适当提高上样速度。
2.4 上样质量浓度对吸附的影响
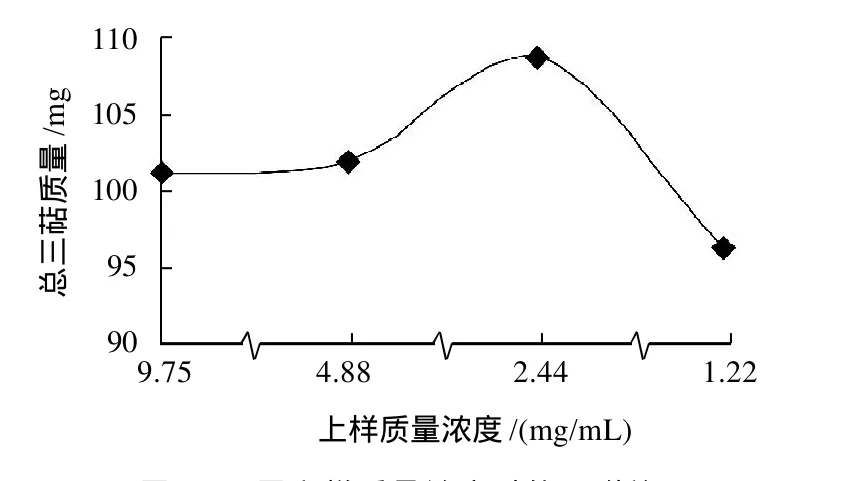
图3 不同上样质量浓度时的吸附效果Fig.3 Effect of sample solution concentration on adsorption efficiency of AB-8 resin
实验结果(图3)表明,随着上样质量浓度的提高,三萜类物质的吸附率呈先升后降之势,以2.44mg/mL的吸附效果最好。从理论上讲,上样质量浓度越高,吸附率应该越高,因为质量浓度差越大越有利于扩散,但本实验结果却表明,在较低的质量浓度范围内增加质量浓度时吸附率升高,而大于一定质量浓度时增加质量浓度反而会降低吸附率,主要原因可能是上样液质量浓度太高时,黏度较大,会阻碍目标物扩散,从而降低吸附率。高侠等[13]、李淑珍等[14]也报道了随着上样质量浓度增加目标物吸附率先升后降的实验结果,冯颖等[15]认为,引起高质量浓度时吸附率下降的原因可能是杂质的竞争性吸附作用。
2.5 不同体积分数乙醇解吸液的解吸效果

图4 不同体积分数乙醇的解吸效果Fig.4 Effect of ethanol concentration on desorption efficiency of AB-8 resin
结果(图4)表明,40%乙醇洗脱液中基本上不含三萜类物质,而大部分吸附在树脂上的色素可被40%乙醇洗脱下来,因而三萜类物质与色素可得到较好的分离。60%、80%、95%和100%四种体积分数的乙醇解吸液中,随着乙醇体积分数的升高解吸率也呈现出升高的趋势,其中95%乙醇、100%乙醇的解吸率明显高于其他体积分数,解吸所得目标物的纯度差别不大。因此,从解吸率的角度考虑,应选用100%的乙醇作为洗脱剂,如果考虑到成本问题,也可以选用95%乙醇。
2.6 动态解吸曲线
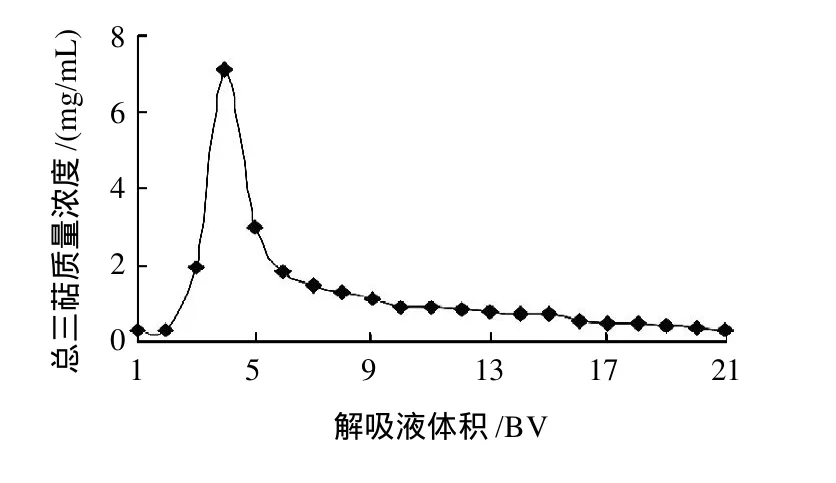
图5 AB-8树脂动态解吸曲线Fig.5 Dynamic desorption curve of AB-8 resin
结果(图5)表明,以95%乙醇洗脱,质量浓度峰值出现在3~6BV,且峰形较尖、峰宽较小,其中以4BV时质量浓度最高,10BV后三萜质量浓度已经很小,大部分三萜在前10BV时已解吸。因此,10BV为合理的洗脱剂用量。
2.7 不同洗脱流速的洗脱效果
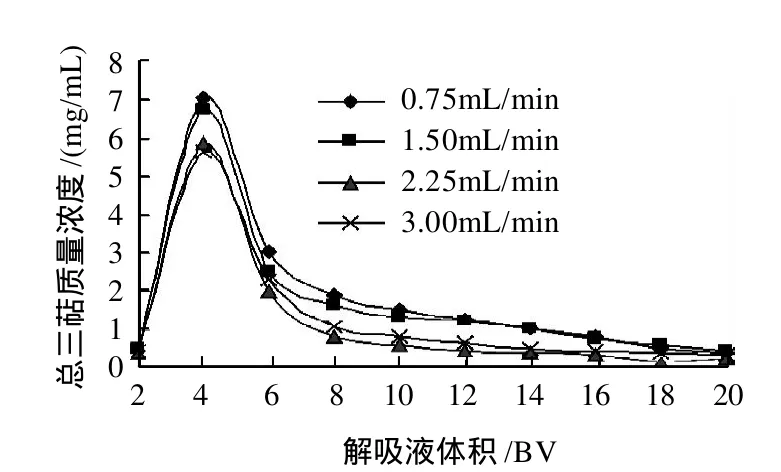
图6 不同解吸流速时的解吸曲线Fig.6 Desorption curve at different flow rates
选择0.75、1.50、2.25、3.00mL/min四种流速进行动态解吸实验,结果(图6)表明:随着洗脱流速的增加,解吸量呈下降的趋势;0.75mL/min与1.50mL/min的解吸量差异不明显,但二者均显著高于2.25mL/min和3.00mL/min;流速越低,洗脱峰质量浓度越高;10BV后曲线均较为平坦。综合考虑洗脱率和洗脱效率,1.5mL/min的洗脱流速较为合理。
2.8 纯化后三萜化合物的纯度
青钱柳叶三萜粗提物,经AB-8大孔树脂吸附、蒸馏水冲洗、40%乙醇冲洗去杂、95%乙醇洗脱、真空浓缩干燥,得到的纯化三萜化合物为棕黄色粉末或片状物,有光泽,纯度可达44.30%。
3 结 论
3.1 所选的6种供试大孔树脂中,AB-8对青钱柳叶三萜化合物具有较好的静态吸附、解吸性能,比饱和吸附量为77.49mg/g,解吸率为85.44%,总回收率可达72.01%,适用于青钱柳叶三萜类物质的纯化。
3.2 采用AB-8树脂动态吸附纯化青钱柳叶三萜化合物时,对6.070mg/mL粗提物水溶液的处理能力为3BV;为获得较好的吸附效果,应以较低流速上样;随着上样质量浓度的提高,三萜类物质的吸附率呈先升后降之势,2.44mg/mL的吸附效果较好;95%乙醇可获得较好的解吸效果,10BV为合理的解吸剂用量;洗脱流速越低,效果越好,综合考虑洗脱效率,1.5mL/min较为合理。
3.3 经AB-8树脂纯化后的青钱柳叶三萜化合物为棕黄色粉末或片状物,有光泽,纯度可达44.30%。
[1] 谢明勇, 谢建华. 青钱柳研究进展[J]. 食品与生物技术学报, 2008,27(1): 113- 121.
[2] 彼香香, 方升佐. 青钱柳次生代谢产物及其生理功能[J]. 安徽农业科学, 2009, 37(28): 13612-13614.
[3] XIE Mingyong, LI Lei, NIE Shaoping, et al. Determination of speciation of elements related to blood sugar in bioactive extracts fromCyclocarya paliurusleaves by FIA-ICP-MS[J]. Eur Food Res Technol, 2006, 223(2): 202-209.
[4] GUTIERREZ R M P, SOLIS R V, BAEZ E G, et al. Hypoglycemic activity of constituents fromAstianthus viminalisin normal and streptozotocin-induced diabetic mice[J]. Journal of Natural Medicines,2009, 63(4): 393-401.
[6] CHOI C W, JUNG H A, KANG S S, et al. Antioxidant constituents and a new triterpenoid glycoside fromFlos Lonicerae[J]. Arch Pharm Res,2007, 30(1): 1-7.
[7] BENSASSON RV, ZOETE V, BERTHIER G, et al. Potency ranking of triterpenoids as inducers of a cytoprotective enzyme and as inhibitors of a cellular inflammatory response via their electron affinity and their electrophilicity index[J]. Chemico-Biological Interactions, 2010, 186(2): 118-126.
[8] 舒任庚. 青钱柳植物化学成分研究简报[J]. 江西中医学院学报, 1996,8(2): 34.
[9] 赵海雯. 癞葡萄皂甙的分离纯化及降血糖功效研究[D]. 无锡: 江南大学, 2005: 31.
[10] 洪艳平, 尹忠平, 上官新晨, 等. 光皮木瓜总三萜化合物提取和含量测定[J]. 江西农业大学学报: 自然科学版, 2007, 29(2): 225-229.
[11] 凌庆枝, 高莉莉, 袁怀波, 等. 大孔树脂吸附纯化女贞子三萜类化合物的研究[J]. 广西科学, 2009, 16(4): 428-431.
[12] 纵伟. 大叶紫薇叶降血糖作用及机理的研究[D]. 无锡: 江南大学,2005: 23.
[13] 高侠, 黎云祥, 蔡凌云, 等. 大孔吸附树脂对白簕叶总皂苷的纯化工艺研究[J]. 中药材, 2009, 32(5): 780-784.
[14] 李淑珍, 李进, 杨志江, 等. 大孔树脂分离纯化黑果枸杞总黄酮的研究[J]. 食品科学, 2009, 30(1): 19-24.
[15] 冯颖, 李天来, 孟宪军, 等. 大孔树脂纯化长白楤木叶皂苷及其生物活性研究[J]. 食品科学, 2009, 30(16): 158-161.
Purification of Triterpenoids fromCyclocarya paliurusLeaves by Macro-porous Resin Adsorption
YIN Zhong-ping1,2,SHANGGUAN Xin-chen1,2,*,ZHANG Yue-hong2,LI Dong-ming2,WU Shao-fu2,CHEN Ji-guang2
(1. State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China;2. Laboratory of Plant Resources Exploitation and Utilization, Jiangxi Agricultural University, Nanchang 330045, China)
In order to obtain triterpenoids with high purity fromCyclocarya paliurusleaves, macro-porous resin was used for purification. Results indicated that macro-porous resin revealed a static absorption mode. AB-8 resin had good adsorption capability on triterpenoids fromCyclocarya paliurusleaves, and its adsorption capacity, desorption rate and total recovery rate were 77.49 mg/g, 85.44% and 72.01%, respectively. Dynamic adsorption and desorption experiments of AB-8 resin suggested that the increasing flow rate of sample solution could result in the decrease of adsorption rate, and the increasing sample amount in resin could result in a pattern of initial increase and final decline for adsorption rate. A better elution efficiency was observed at the concentration of 95% ethanol, and 10 BV was reasonable dosage. Both peak concentration and desorption rate were declined with the increasing flow rate of eluent. The best flow rate was 1.5 mL/min. The purity of triterpenoids purified by AB-8 macro-porous resin was 44.30%.
Cyclocarya paliurus;total triterpenoids;macro-porous resin;purification
TQ028.15
A
1002-6630(2011)06-0061-05
2010-05-17
江西省科技支撑计划项目(2009BSB09100);江西省自然科学基金项目(2007GZN0214)
尹忠平(1971—),男,讲师,博士研究生,主要从事食品化学与营养研究。E-mail:yinzp2008@yahoo.com.cn
*通信作者:上官新晨(1962—),男,教授,博士,主要从事植物资源开发与利用研究。E-mail:shangguanxc_818@sina.com

