甲醇脱硫新工艺的研究
孙玉春 康明艳(天津渤海职业技术学院天津300402)
胡文艳(天津国韵生物材料有限公司天津300462)
甲醇脱硫新工艺的研究
孙玉春 康明艳(天津渤海职业技术学院天津300402)
胡文艳(天津国韵生物材料有限公司天津300462)
生产维生素B1的过程中产生大量的含硫甲醇废液,某制药厂的旧工艺脱硫效果不好,所得产品仍旧含有大量的硫。通过自制的反应精馏装置,经过大量的实验,得到成功的方案,现已用于指导工业生产。
甲醇脱硫精馏
甲醇是重要的有机化工产品,广泛应用于有机合成、染料、医药、农药、涂料、汽车和国防等工业。[1]甲醇在生产维生素B1的过程中主要作为有机溶剂,在生产过程中产生大量的含硫甲醇废液(硫以硫代物的形式存在),若将甲醇循环利用,不仅可以降低企业成本,而且可以减少环境污染。由于硫的存在影响了甲醇的循环利用,如何有效地将甲醇中的硫除去是工业生产中的一个难点。笔者就如何有效地去除硫做了大量的试验研究,得到一个较为成功的方案。
1 脱硫方法
脱硫方法的选择是甲醇项目脱硫技术的关键之一,工业生产中脱硫有很多方法。[2]笔者根据某制药厂提供的脱硫方法,结合其实际生产情况,着重研究了用FeSO4脱硫的方法:FeSO4与甲醇废液中的硫代物反应生成Fe2S3沉淀,过滤出Fe2S3沉淀,然后将滤液精馏得到高纯度的甲醇。
2 旧工艺简介
某制药厂的脱硫旧工艺为:将一定量的甲醇废液加入贮槽中,然后再加入3%(质量百分数)的FeSO4,搅拌并停留一段时间,将混合液加入再沸器中,粗蒸,得塔顶粗产品;然后再向塔顶粗产品中加入3%(质量百分数)的FeSO4,精馏后得产品甲醇。此工艺的缺点为:①由于加入FeSO4后产生大量的沉淀,沉淀没有过滤出去,因此在粗蒸和精馏过程中,再沸器底部有一层厚厚的沉淀物,严重影响了传热,也使再沸器的使用寿命大大降低;②沉淀物受热后粘度变大,附着在再沸器上,给清洗带来很大的困难;③塔顶产品中仍含有大量的硫;④操作为间歇精馏。
考虑到塔顶产品中仍存在硫,认为可能存在的原因有:①FeSO4加入量不够;②工艺流程本身存在缺陷;③精馏时塔设备分离效果所限,不能达到分离要求。
针对可能存在的原因,作者分别对①和②做了实验研究。结果表明,当增大FeSO4的用量时,塔顶仍未得到合格的甲醇,故推断可能是工艺本身存在缺陷。
3 新工艺构想
实验证明:由于FeSO4在甲醇废液中的溶解度较小,FeSO4与甲醇中的硫代物反应缓慢,若将FeSO4溶于水中,则反应迅速,故试验时先将FeSO4溶于水。
实验过程拟定了4套方案:①直接在甲醇废液中加FeSO4溶液,停留一段时间后将混合液加入反应釜,然后精馏得到产品;②直接在废液中加FeSO4溶液,停留一段时间,过滤出Fe2S3沉淀,将滤液加入反应釜中精馏得到产品;③先将废液在精馏塔中粗蒸,然后在塔顶产品中加FeSO4溶液,停留一段时间,再加入反应釜中精馏得到产品;④先将废液在精馏塔中粗蒸,然后在塔顶产品中加FeSO4溶液,停留一段时间,过滤出Fe2S3沉淀,再将滤液加入反应釜中精馏得到产品。
4 新工艺的实验研究
4.1 实验部分
实验原料与试剂:含硫甲醇废液和FeSO4由中津制药厂提供;汞,工业品。
4.2 分析方法
4.2.1 目测法取塔顶甲醇产品约5m L,加入一滴汞,震荡3~5min,观察汞珠的变化。若甲醇中硫含量较高,则汞珠变为黑色,且不再呈球形(发扁);若硫含量较低,则汞珠变为黄色;若基本没有硫,则汞珠不变。
4.2.2 仪器分析法若目测法合格,则再用色谱仪分析。分析仪器为北京分析仪器厂生产的3420型气相色谱仪,热导池检测器,C-R6A数字积分仪。
4.3 实验方案的确定
本工艺的主要目的是有效地将硫除去,通过多次实验,得到方案4可以满足设计的要求,即塔顶产品甲醇中硫的含量在许可范围内。
方案1和方案3同时存在旧工艺的缺点:产生的Fe2S3沉淀没有及时过滤出去,与混合液一起被加入再沸器,Fe2S3附着在再沸器底部和四周,影响了热传导,并且给清洗带来困难;塔顶甲醇中硫的含量仍旧较多。故舍去方案1和3。
方案2比方案4少一粗蒸工序,但经过多次实验发现,无论怎么增加FeSO4的加入量和延长反应时间,塔顶产品中硫的含量仍较高。故此方案亦不可行。
方案4虽然工序最多,但克服了旧工艺的缺点,且塔顶甲醇中硫的含量满足设计要求。
4.4 实验装置与操作步骤
本实验采用的实验设备是塔体为Ф40×1 500mm的填料塔,内装Ф2.5×2.5不锈钢θ网环填料,塔身用加热带保温。塔釜为2 000m L四口烧瓶,用调温电热套加热。塔顶冷凝液体采用摆动式回流比控制器操作。实验装置如图1所示。
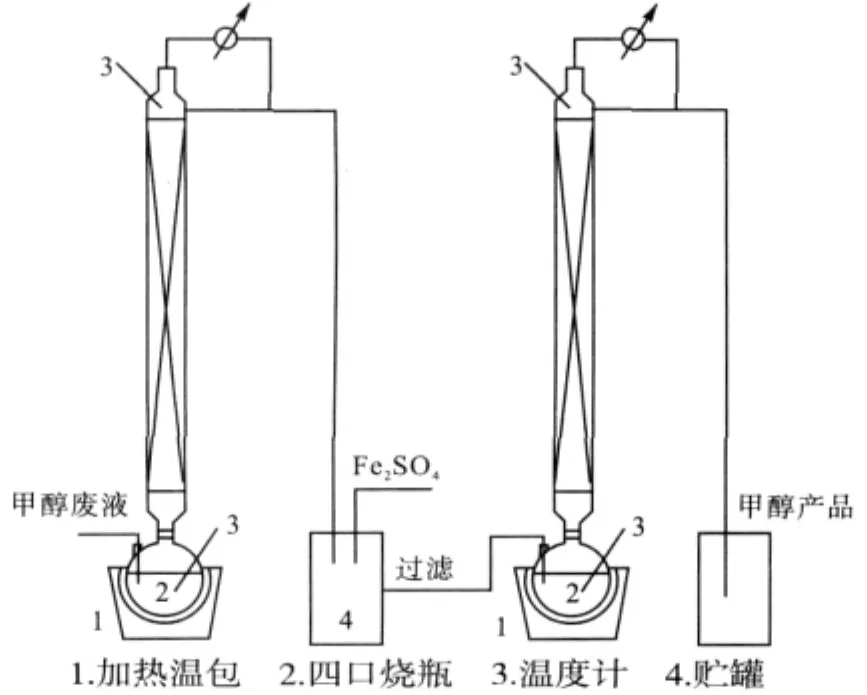
图1 实验装置
在烧瓶中加入含硫甲醇废液,将塔釜加热至沸腾,同时打开塔顶冷凝器。开始时塔顶全回流,当顶温降至65℃时,开始出料,回流比为1∶1。当塔顶温度升至75℃时,可以认为塔釜中的甲醇已经全部蒸出,停止加热。将塔釜废液做进一步处理。
将60 g FeSO4溶于100 m L水中,待充分溶解后再加入1 000m L粗蒸产物,产生大量Fe2S3沉淀,并有刺鼻的臭鸡蛋气味,过滤。过滤后的沉淀物后续处理正在进一步研究之中。
将滤液加入烧瓶中,加热至沸腾,同时开启塔顶冷凝器,开始时塔顶全回流。至塔顶温度降至64℃时开始出料,回流比为1∶1,塔顶得产品甲醇,先用目测法测试合格后再用气相色谱分析。
5 实验结果与讨论
5.1 FeSO4的用量
实验中FeSO4用量的多少是一个关键因素。若用量少则不能将硫全部除去;若用量过多,一则对企业是一种浪费,二则未完全反应的FeSO4给后续处理增加了困难。
向1 000m L粗蒸甲醇产品中加入FeSO4,生成的沉淀量与FeSO4用量之间的关系曲线如图2所示。
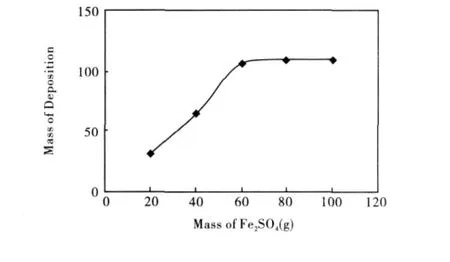
图2 生成的Fe2S3沉淀量与FeSO4用量关系曲线图
由图2中可以看出,开始时随FeSO4用量的增加,Fe2S3沉淀量上升较快,当FeSO4用量大于60 g后,沉淀量变化不大,只是略有增加,原因是当FeSO4用量大于60 g,FeSO4未反应完全,过滤时部分FeSO4结晶,与Fe2S3一起被过滤出。
5.2 反应时间
FeSO4与甲醇中的硫代物反应迅速,一接触即生成Fe2S3沉淀,并有刺激性臭鸡蛋气味。将60 g FeSO4溶于100m L水中,然后加入1 000m L甲醇粗蒸产品,分别放置2min、5min、10min、15min后过滤,生成沉淀量与反应时间关系曲线如图3所示。
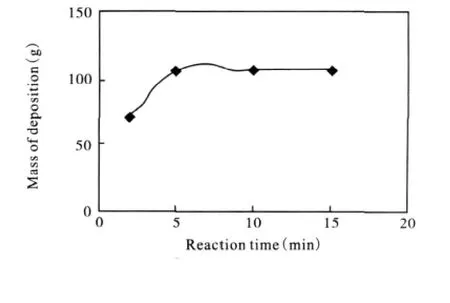
图3 Fe2S3沉淀与反应时间关系曲线图
由图中可以看出,当反应时间为5min时,即可认为FeSO4与硫代物反应完全。在实际生产中,由于容器的放大、反应温度、混合均匀与否等诸多因素的影响,反应时间有待进一步试验测定。
5.3 塔顶温度
粗蒸时塔顶温度控制在64~74℃,当顶温高于74℃时,可认为塔釜中的甲醇已经全部蒸出。精馏时,塔顶温度严格控制在64~65℃。
5.4 回流比的控制
根据经验,回流比可控制在1∶1。
5.5 新旧工艺对比
5.5.1 FeSO4用量及产品质量(见表1)。5.5.2旧工艺为间歇操作,效率较低。采用新工艺后可以进行连续操作,大大提高了生产效率。

表1 FeSO4用量及产品质量
6 结论
根据以上实验结果及分析,得到如下结论:先将甲醇粗蒸,然后在蒸出组分中加FeSO4溶液,过滤后精馏,此方案可以满足工艺生产的需要,产品合格。■
[1]段志成,赫文秀.甲醇的生产工艺及其发展现状[J].内蒙古石油化工,2010(4):50-51.
[2]盛于蓝.大型甲醇装置中几种常用脱硫方法[J].化学工业与工程技术,2006(2):73-74,77.

2011-01-05

