双核铜(Ⅱ)配合物的合成、晶体结构与性质研究
康 伟 邓兆鹏 高 山
(黑龙江大学化学化工与材料学院,功能无机材料教育部重点实验室,哈尔滨 150080)
双核铜(Ⅱ)配合物的合成、晶体结构与性质研究
康 伟 邓兆鹏 高 山*
(黑龙江大学化学化工与材料学院,功能无机材料教育部重点实验室,哈尔滨 150080)
本文合成了1个新的铜双核配合物[(CuI)(PMN)]2·2CH3CN(PMN=2、4-二氨基-5-氯苯基-6-乙基嘧啶),并且通过元素分析、红外、荧光、热重和单晶X-射线进行了表征。该配合物属三斜晶系,空间群P1,a=0.8100(16)nm,b=0.96950(19)nm,c=1.2049(2)nm,α=97.88(3)°,β=93.31(3)°,γ=94.14(3)°,V=0.9338(3)nm3,Z=1,R=0.0371。 在配合物中,每个 Cu(Ⅰ)离子与 PMN 配体的 1 个 N原子和2个I原子配位,展示出三角几何构型。相邻的2个Cu(Ⅰ)离子通过碘原子相连形成双核铜配合物,并进一步通过氢键和I…I作用形成三维网状结构。
铜配合物;合成;晶体结构
0 引 言
金属有机配合物因其新颖的拓扑结构和潜在的物理化学性质而备受关注[1-3]。在金属有机配合物的组装过程中,有机配体的选择起着极为重要的作用。含有氨基取代的嘧啶及其衍生物不仅是一类非常重要的生物活性物质和有机合成中间体,而且具有多个潜在的N原子配位点,因此它是建构金属有机配合物较佳的有机配体。2,4-二氨基-5-氯苯基-6-乙基嘧啶(PMN)是一种非常重要的抗疟药物[4],目前对它的研究多集中于氢键超分子的构筑[5-11]。相比而言,以PMN为配体建构的金属配合物报道非常少,仅见[Rh2(O2CCH3)4(PMN)2]一例[12]。为了进一步探索PMN和金属离子构筑的配合物的结构特点和物化性能,本文通过PMN和碘化亚铜在乙氰溶剂中的溶剂热反应合成了一个具有双核铜(Ⅰ)结构的配合物[(CuI)(PMN)]2·2CH3CN,并对其进行了元素分析、红外、热稳定性、荧光性能及单晶结构表征。
1 实验部分
1.1 仪器与试剂
元素分析是采用意大利Carlo Erba 1106型元素分析仪测定。红外光谱是在德国BRUKER公司的EQUINOX 55型傅立叶红外光谱仪上记录。晶体结构采用日本理学公司的Rigaku RAXIS-RAPID型单晶X射线衍射仪测定。荧光曲线是在美国PERKIN ELMER公司LS55型荧光光谱仪上测定。热重曲线是在美国PERKIN ELMER公司的TG/DTA 6300热分析仪上进行,实验条件为N2气氛,升温速率为10℃·min-1。
配体2,4-二氨基-5-氯苯基-6-乙基嘧啶和其它试剂均为市售分析纯试剂。
1.2 配合物的合成
将 1 mmol 2,4-二氨基-5-氯苯基-6-乙基嘧啶和1 mmol CuI加入到15 mL的乙氰溶剂中,搅拌10 min后,将溶液装入到25 mL内衬聚四氟乙烯的不锈钢反应釜内,于140℃下晶化48 h,自然冷却致室温,过滤。滤液放置几天后,无色柱状晶体从溶液中长出。化学式为C28H32N10Cl2I2Cu2,元素分析结果(括号内为计算值,%):C 34.96(34.98),H 3.26(3.33),N 14.56(14.58)。
1.3 晶体结构测定
选取大小为 0.30 mm×0.25 mm×0.20 mm 柱状无色的单晶样品,采用RIGAKU RAXIS-RAPID型单晶X射线衍射仪于295 K温度下收集衍射数据,使用经石墨单色器单色化的Mo Kα射线(λ=0.071073 nm)。 以 φ-ω 扫描方式在 3.14°≤θ≤27.44°范围内共收集9229个衍射数据,其中独立衍射数据4276个(Rint=0.0264),I>2σ(I)的可观测数据是 3436 个。 数据经Lp因子和经验吸收校正。采用直接法并经数轮差值Fourier合成,找到全部非氢原子。所有的氢原子坐标采用几何加氢法得到,所有非氢原子的坐标及其各向异性温度因子用全矩阵最小二乘法进行精修。所有结构计算工作均用SHELX 97程序[13]完成。
CCDC:794866。
2 结果与讨论
2.1 FTIR光谱
用KBr压片法测定了配合物的红外光谱(400~4000 cm-1)。 配合物在 1615、1559 和 1458 cm-1处的红外吸收峰可归属为嘧啶环、苯环骨架的ν(C=C)和 ν(C=N)伸缩振动,2254 cm-1为 ν(C≡N)的伸缩振动,表明配合物中存在乙氰分子。3 152、3 351和3437 cm-1处为氨基ν(N-H)伸缩振动。
2.2 晶体结构
标题配合物的主要键长和键角数据列于表1,氢键健长和健角数据列于表2,其晶体结构如图1所示。

表1配合物的主要键长和键角Table 1 Selected bond lengths(nm)and bond angles(°)for the complex

表2 配合物的氢键键长和键角Table 2 Hydrogen bonds and angles for the complex

图1 配合物的分子结构Fig.1 Molecular structure of complex with 30%probability ellipsoid
从图1中可见,配合物包含双核结构单元[(CuI)(PMN)]2和2个游离的乙氰分子。每个Cu(Ⅰ)离子分别与来自PMN配体的1个氮原子和2个桥联的碘原子形成三配位的平面三角构型,且构筑了1个Cu2I2的菱形结构,相邻 Cu…Cu间距离为0.2608(11)nm,表明存在着较强的 Cu…Cu 作用[14]。Cu(Ⅰ)离子与氮原子间的健长为 0.200 1(2)nm,Cu(Ⅰ)离子与碘原子间的健长分别为0.255 6(9)和0.2559(9)nm,健角 I1-Cu1-I1i为 118.69(3)°。 此外,游离的乙腈分子与双核结构单元[(CuI)(PMN)]2间通过乙氰氮原子与嘧啶环氨基的氢原子形成分子间氢键 N(4)-H(4B)…N(5)。
由图2可以看出,相邻的2个双核结构单元[(CuI)(PMN)]2通过N(4)-H(4A)…N(2)ii氢键作用形成了一维链状结构。一维链间通过I…I弱作用连接形成二维层状结构,其 I…I距离为 0.421 7 nm,处在文献报道的 I…I距离之间(0.41~0.45 nm)[15-16]。此外,相邻层间通过C(12)iii-H(12A)…I1氢键进一步构筑成三维超分子网状结构(图3)。
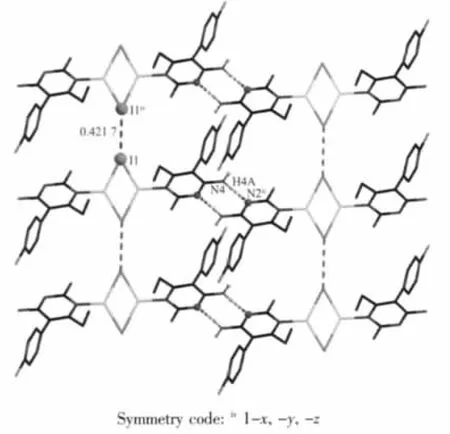
图2 配合物的二维超分子层状结构Fig.2 2D supramolecular layer of the complex
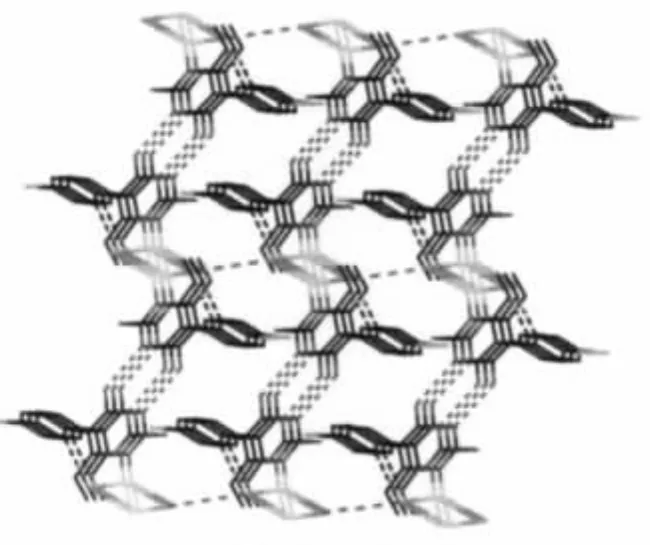
图3 配合物的三维网状结构Fig.3 3D network of the complex
2.3 热稳定性分析
标题配合物的热失重曲线如图4所示,在112~135℃之间配合物失去游离的乙氰分子 (实验值8.49%,理论值 8.54%)。 之后,配合物在 199~904 ℃间累计失重75.67%,相当于失去PMN配体和碘(理论 75.41%)。最终残余物为单质 Cu(实验值 13.33%,理论值 13.32%)。
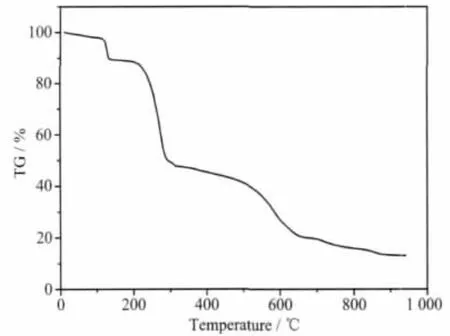
图4 配合物的TG曲线Fig.4 TG curve of the title complex
2.4 荧光性质

图5 室温下的配合物和配体的固态荧光光谱Fig.5 Emission spectra of the complex and ligand in solid state at room temperature
室温下配合物的固态荧光光谱,如图5所示。在344 nm波长激发下,配合物在423 nm处有荧光发射峰且可以指认为配体内发光。相比游离配体(激发波长244 nm,发射波长413 nm)的荧光发射峰,配合物的荧光发射强度明显减弱且红移了10 nm,这可能是因为形成配合物后增加了配体内的能量损失。
[1]Ellsworth J M,Loye H C.Dalton.Trans.,2008:5823-5835
[2]WangXY,WangZM,GaoS.Chem.Commun.,2008:281-294
[3]Soares-Santos P C R,Cunha-Silva L,Paz F A A,et al.Inorg.Chem.,2010,49:3428-3440
[4]Tarnchompoo B,Sirichaiwat C,Phupong W,et al.J.Med.Chem.,2002,45:1244-1252
[5]Sethuraman V,Stanley N,Muthiah P T,et al.Crystal Growth Design,2003,3(5):823-828
[6]Stanley N,Sethuraman V,Muthiah P T,et al.Crystal Growth Design,2002,2(6):631-635
[7]Stanley N,Muthiah P T,Geib S J,et al.Tetrahedron,2005,61:7201-7210
[8]Balasubramani K,Muthiah P T,Lyncy D E.Acta Crystallogr.,Sect.E,2007,63(6):o2966-o2966
[9]Devi P,Rychleewska U,Muthiah P T,et al.Acta Crystallogr.,Sect.E,2007,63(11):o4452-o4452
[10]Thanigaimani K,Subashini A,Muthiah P T,et al.Acta Crystallogr.:Sect.C,2009,65(2):o42-o45
[11]Balasubramani K,Muthiah P T,Rychleewska U.Acta Crystallogr.:Sect.C,2005,61(10):o586-o588
[12]Zoroddu M A.Inorganica Chimica Acta,1987,128:179-183
[13]Sheldrick G M.SHELXS-97and SHELXL-97,Program for X-ray Crystal Structure Refinement and Solution,University of Göttingen,1997.
[14]Ren S B,Zhou L,Zhang J,et al.CrystEngComm,2009,11:1834-1836
[15]Song Y L,Niu Y Y,Hou H W,et al.Journal of Molecular Structure,2004,689:69-74
[16]Lewis M,Barnes C L,Glaser R.J.Chem.Crystallog.,1999,9:1043-1048
Synthesis,Crystal Structure and Properties of Dinuclear Copper(Ⅰ)Complex
KANG WeiDENG Zhao-Peng GAO Shan*
(Key Laboratory of Functional Inorganic Material Chemistry,Ministry of Education,Heilongjiang University,Harbin 150080,China)
A new copper(Ⅰ)complex has been synthesized and characterized by elemental analysis,IR,PL,TG and X-ray single crystal diffraction.The title complex crystallizes in triclinic with space group P1,a=0.81100(16)nm,b=0.969 50(19)nm,c=1.204 9(2)nm,α=97.88(3)°,β=93.31(3)°,γ=94.14(3)°and V=0.933 8(3)nm3,Z=1,R=0.037 1.In the title complex,each Cu(Ⅰ)ion displays a triangle geometry,with one N atom from 2,4-diamino-5-(p-chlorophenyl)-6-ethyl-pyrimidine (PMN)and two iodine atoms.Two adjacent Cu(Ⅰ) ions are linked by two μ2-I atoms into a dinuclear copper(I)complex,which are further connected by intermolecular hydrogen bond(N-H…N,C-H…I)and I…I interactions to form a three-dimensional supramolecular network.Furthermore,the solidstate fluorescence property of the complex was studied at room temperature.CCDC:794866.
copper complex;synthesis;crystal structure
O614.121
:A
:1001-4861(2011)04-0655-04
2010-10-18。收修改稿日期:2010-12-20。
黑龙江省自然科学重点基金(No.ZD200903),黑龙江省高等学校科技创新团队(No.2010td03)和黑龙江大学学生创新资助项目。
*通讯联系人。 E-mail:shangao67@yahoo.com

