牛卵母细胞玻璃化冷冻对基因mRNA表达量的影响
林嘉鹏,王 静,2,赵云程,陈 童,汪立芹,陈 博,2,黄俊成
(1.新疆畜牧科学院农业部家畜繁育生物技术重点开放实验室,新疆畜牧科学院生物技术中心,乌鲁木齐 830000;2.新疆农业大学农学院,乌鲁木齐 830052)
牛卵母细胞玻璃化冷冻对基因mRNA表达量的影响
林嘉鹏1,王 静1,2,赵云程1,陈 童1,汪立芹1,陈 博1,2,黄俊成1
(1.新疆畜牧科学院农业部家畜繁育生物技术重点开放实验室,新疆畜牧科学院生物技术中心,乌鲁木齐 830000;2.新疆农业大学农学院,乌鲁木齐 830052)
目的 将处于生发泡期(GV期)和体外成熟期(IVM)的牛卵母细胞进行玻璃化冷冻-解冻,对其卵裂率和囊胚率以及一些与发育相关基因的mRNA表达量进行评价。方法 玻璃化冷冻GV期(n=224)和IVM期(n=235)牛卵母细胞,解冻后对其进行体外培养并采用quantitative real time-PCR技术对冷冻-解冻后的GV和IVM期卵母细胞中 Bax、Dnmt1、Hdac1、Cyclinb1、Cdc2和 Cu Zn SOD等基因的 mRNA表达量进行检测。结果 GV期和IVM期卵母细胞经过冷冻-解冻后,卵裂率(14.7% ~89.4%,34.5% ~89.4%,P<0.001)及囊胚率(3.0% ~28.4%,12.3% ~28.4%,P<0.001)均极显著低于对照组(n=238),且冷冻-解冻后的 GV期卵母细胞卵裂率(14.7% ~34.5%,P<0.001)和囊胚率(3.0% ~12.3%,P<0.001)极显著低于冷冻-解冻后的 IVM期卵母细胞;GV期卵母细胞经玻璃化冷冻后,Dnmt1和Cu Zn SOD基因的mRNA表达量显著低于对照组 (P<0.05),其余基因mRNA表达量变化不显著;对M期卵母细胞而言,Bax基因 mRNA表达量极显著低于对照组 (P<0.01),Cyclinb1、Cdc2和Cu Zn SOD基因的mRNA表达量显著低于对照组(P<0.05),其余基因表达量没有发生显著变化。结论 对牛GV期或IVM卵母细胞进行玻璃化冷冻可能会导致基因mRNA表达量降低,可能会对胚胎发育产生负面影响。
玻璃化冷冻;基因表达;牛卵母细胞;发育能力
哺乳动物卵母细胞的冷冻保存,可充分利用各种卵母细胞资源,为体外受精、核移植等胚胎工程技术提供丰富而方便的材料来源,为科研和生产服务,已逐渐被人们作为一项辅助生殖技术而广泛应用于人类医学和畜牧兽医行业。
但是,由于卵母细胞对低温存在高灵敏性,所以卵母细胞超低温冷藏技术仍不像精液冷冻技术那样成功。尽管与慢速冷冻相比,玻璃化冷冻能使卵母细胞在短时间内急速降至低温,从而减少冰晶的产生,对卵母细胞的保护具有一定优势,但解冻后的胚胎发育情况却仍然不尽如人意[1]。近年来研究已表明卵母细胞经玻璃化冷冻后,在形态学和生物物理学方面会产生不同程度的变化甚至损坏[2],如透明带发生变化,减少细胞膜选择透性,微绒毛减少或消失,各种细胞器及内含物如线粒体、微管、高尔基复合体、内质网及囊泡的损伤[3],改变微管和微丝[4],破坏纺锤体构造,出现非整倍体,并使细胞核破裂[5]。目前,仅小鼠成熟卵母细胞的冷冻保存技术趋为完善,家畜中虽然牛卵母细胞冷冻保存研究最多,但只获得了极少数来自冷冻牛GV期和体外成熟卵母细胞的牛犊,其冷冻卵母细胞的成熟率、受精率和发育率与未冷冻卵母细胞相比都还很低,如此看来,冷冻对卵母细胞的损伤还是很大的。
大量研究表明,受精后早期胚胎细胞分裂的速度以及各种卵裂球所处的位置都是由贮存在卵内的母源性mRNA和蛋白质控制的[6],受精作用介导卵母细胞中母源mRNA募集,受精后,蛋白质合成急剧增长,储存的mRNA被转录、翻译,这些基因的发育能力包括对转录和翻译的调节、调整细胞周期、应激反应、合成组蛋白、胞间连丝传递信号、生长因子和胞内信号的传导、新陈代谢等[7]。而关于玻璃化冷冻给卵母细胞,特别是给哺乳动物卵母细胞所带来的生物化学或分子生物学方面的影响的报道较少,目前国内对卵母细胞玻璃化冷冻的研究也主要集中在形态学和细胞水平上。
因此,我们分别将处于GV期和M期的牛卵母细胞进行玻璃化冷冻以及解冻,采用quantitative real time-PCR技术对玻璃化冷冻-解冻牛卵母细胞中的 Bax、Dnmt1、Hdac1、cyclinb1、Cdc2 和 Cu Zn SOD等基因的mRNA表达量进行检测,分析玻璃化冷冻-解冻对处于不同体外培养时期的牛卵母细胞中与发育相关的以上基因的表达量影响情况,以期为玻璃化冷冻后卵母细胞体外成熟培养体系的优化、辅助生殖技术效率的提高提供理论基础。
1 材料与方法
1.1 牛卵母细胞的收集和体外成熟
从屠宰厂收集成年牛的卵巢放入37℃的生理盐水中,2 h内送到实验室。将卵巢在37℃生理盐水中洗3遍后放入烧杯内,选择直径为2~8 mm的卵泡用10 mL注射器吸取卵泡液,回收颗粒细胞紧密的卵丘-卵母细胞复合体。
用M199(Gibco)+5 U/mL肝素钠+10 U/mL PVA洗2遍,再用成熟液洗涤2遍(成熟培养液为M199(Gibco)+10%FBS(Gibco)+10 U/mL FSH(Sigma)+100 U/mL LH(Sigma)+1 mg/L estradiol(Sigma)+100 U/mL青霉素+100 mg/L链霉素)。事先将成熟液在培养皿中做成50 μL微滴,覆盖矿物油(Sigma),在38.5℃,5%CO2培养箱中平衡2 h以上,然后将50~60枚/孔的卵丘-卵母细胞复合体放入成熟液滴中培养成熟。
1.2 卵母细胞玻璃化冷冻与解冻
将成熟 18 h的卵丘-卵母细胞复合体放入0.1%透明质酸酶(Sigma)中消化2~3 min。再用玻璃吸管轻轻吹打卵母细胞,使卵丘与卵母细胞完全脱离后进行玻璃化冷冻;GV期卵母细胞直接进行玻璃化冷冻。
卵母细胞玻璃化冷冻:将卵母细胞放入冷冻基础液 HM[M199(Gibco)+20%FBS(Gibco)]中平衡10 min,每次5枚卵母细胞先后放入冷冻液1[HM+10%EG(Sigma)+10%DMSO(Sigma)]中 2 min,冷冻液 2中[HM+20%EG(Sigma)+20%DMSO(Sigma)]+0.5 mol/L sucrose(Sigma)30 s,并迅速投入液氮表面,形成微滴。
解冻:将微滴依次放入0.25 mol/L sucrose(Sigma)中 2 min,0.15 mol/L sucrose(Sigma)中 2 min后,最后在HM中洗3遍。成熟卵母细胞再放入成熟液滴中恢复2 h后,进行收集。
1.3 体外受精及体外培养
取西门塔尔牛细管冻精,38℃水浴中快速解冻30 s,酒精消毒细管外壁,将细管两头剪开后滴入1.5 mL离心管内,用移液器分别加入3~4个装有500 μL 精子洗涤液[BO 液 +肝素钠(10 μg/mL,国产)]+咖啡因(2.5 mmol/L,Sigma)+BSA(6 mg/mL,Sigma)的试管底部,置于 CO2培养箱中使精子上浮15~20 min,小心收集上层液体,1800 r/min,离心5 min,弃掉上清液,再加入1 mL的精子洗涤液离心洗涤,保留离心管底部的200 μL精子。
将解冻后的卵母细胞在受精液中洗涤3次,转入受精微滴内,微滴已提前做好,覆盖石蜡油,并置于CO2培养箱中孵育2 h以上。
然后将上述处理的精子浓度调至1.5×106后加入受精微滴内,置于培养箱中使精卵作用18~20 h后,将各组受精卵转入已制备好的饲养单层上【mCR1aa+5%FBS(Gibco)】,受精后48 h检查卵裂率,并把未卵裂的卵母细胞吸出,继续培养6~7 d。每48 h半量更换培养液,直至将胚胎培养至囊胚阶段,并进行记录。
1.4 卵母细胞总RNA提取与RT-PCR
将收集的卵母细胞用PBS(Gibco without Ca2+、Mg2+)洗3遍,放入DEPC水处理过的1.5 mL离心管中,10 000 r/min离心1 min,小心吸去上清液,按照RNeasy Micro Kit(Qiagen)试剂盒介绍的方法提取卵母细胞总RNA。
RT-PCR 体系:将 1 μg总 RNA 与 1 μL随机六聚物引物混合后,RNase free water补足至14.5 μL,70℃ 10 min,冰浴10 min,瞬时离心后加入 RNA inhibiter 0.5 μL,5 × buffer 2 μL,10 mmol/L dNTP 2 μL,AMV 1 μL(TaKaRa),42℃ 40 min。
1.5 标准曲线的制作
分别把牛 Bax、Dnmt1、Hdac1、cyclinb1、Cdc2、Cu Zn SOD基因和18S rRNA与pMD20-T载体进行连接,用限制性内切酶EcoRⅤ将各个基因的质粒线性化,并将各个基因线性化的质粒进行浓度稀释后制作标准曲线。
分别根据 GenBank 中牛 Bax、Dnmt1、Hdac1、cyclinb1、Cdc2、Cu Zn SOD 和 18S rRNA 序列,用 Oligo 6.0软件设计上述基因的PCR扩增的上下游引物。

表1 Quantitative real time-PCR引物Tab.1 Primers for quantitative real-time PCR assay
1.6 Quantitative real-time PCR检测
1.6.1 Quantitative real time-PCR 反应体系:2 μL标准质粒和样品 cDNA,上下游引物各5 pM,2 ×FastStart DNA master SYBR green I 10 μL(Qiagen),加 RNase free water 至 20 μL。
1.6.2 反应条件:95℃预变性10 min,55个循环中包括95℃ 10 s,60℃ 20 s以及72℃ 20 s。熔解曲线从40~99℃,每秒增加2℃,并收集荧光信号。为减小误差,将 Quantitative real time-PCR重复一次,以平均值参与分析。
1.7 统计分析
实验所得数据利用SAS 9.0软件,采用х2检验进行分析处理。
2 结果
2.1 不同时期牛卵母细胞玻璃化冷冻效果分析
采用微滴法分别对GV期和M期牛卵母细胞进行玻璃化冷冻-解冻、体外受精、体外培养,结果显示(表2):GV期和 M期牛卵母细胞冷冻-解冻后的卵裂率均极显著低于对照组(P<0.01),囊胚率也极显著低于对照组(P<0.01),这两时期卵母细胞的体外受精及囊胚率相比,GV期均极显著低于M期 (P<0.01)。
2.2 玻璃化冷冻对牛卵母细胞中相关基因mRNA水平的影响
对GV期和M期体外培养的卵母细胞进行玻璃化冷冻后,采用quantitative real-time PCR进行检测,结果见图1,GV期卵母细胞经玻璃化冷冻后,Dnmt1和Cu Zn SOD基因的mRNA表达量显著低于对照组(P<0.05),其余基因mRNA表达量变化不显著;对M期卵母细胞而言,Bax基因 mRNA表达量极显著低于对照组(P<0.01),cyclinb1、Cdc2和Cu Zn SOD基因的mRNA表达量显著低于对照组(P<0.05),其余基因表达量没有发生显著变化。
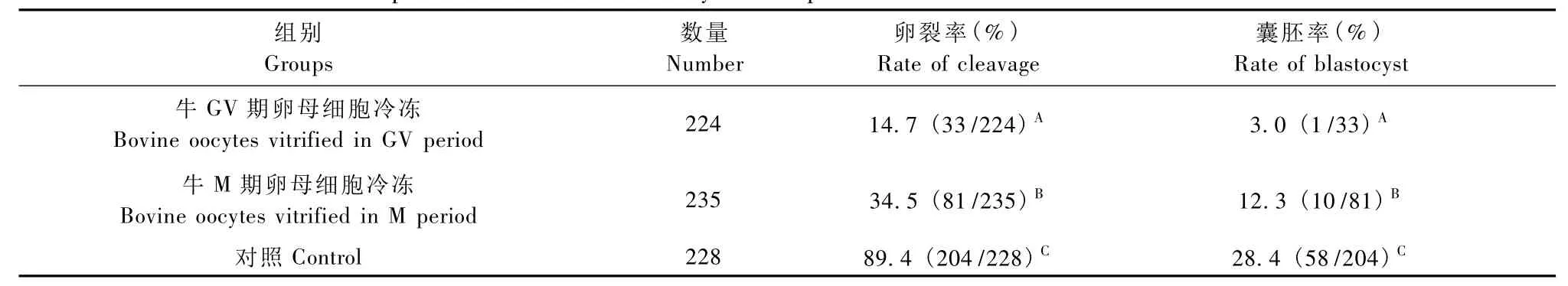
表2 不同时期卵母细胞玻璃化冷冻对胚胎发育的影响Tab.2 Effect of different period vitrification on embryo development
3 讨论
本研究的目的在于探索玻璃化冷冻对牛GV期及体外成熟(M期)期卵母细胞中一些与细胞周期、细胞凋亡、DNA甲基化等发育因素相关基因(Bax、Dnmt1、Hdac1、cyclinb1、Cdc2、Cu Zn SOD)mRNA 表达量的变化,及玻璃化冷冻牛GV期及体外成熟(M期)期卵母细胞对其体外发育能力的影响。从结果中我们发现,不论是GV期还是体外成熟(M期)期的卵母细胞,经过玻璃化冷冻后,上述基因的mRNA表达量都会发生变化,并且这两个时期的卵母细胞经玻璃化冷冻后的胚胎发育率都比对照组低,从一定角度说明玻璃化冷冻过程可能对卵母细胞内部的一些转录因子的功能或发育能力产生了消极影响。
为了能够克服玻璃化程序或操作带来的不良影响,人们都在致力于改进或开发新的冷冻系统,能够有效地提高降温和升温速率,而这些研究路线都是以将玻璃化溶液体积缩减到最小为宗旨。围绕这一根本目的,不同冷冻介质或载体相继出现,如电子显微镜铜网、OPS、冷冻环、微滴法及冷冻帽法[8-10]。本实验根据实验室长年积累的一套玻璃化冷冻体系,采用微滴法进行冷冻,其特点是操作简便,卵母细胞在冷冻液中平衡一段时间后,将含有卵母细胞的冷冻液小滴(约6 μL)直接投入液氮中,使其快速冷冻,然后将这些冷冻后的颗粒装入管中,可长期保存于液氮罐中。这种方法的缺点是小液滴刚滴入液氮时不是立即沉下去,而是漂在液氮上面,由于液滴体积较大(5~6 μL),可能降低了冷冻速度;往液氮中滴入小液滴时可能丢失卵母细胞。
关于卵母细胞发育阶段的选择一直存在争议,因为不同的发育阶段冷冻各有利弊:MⅡ期卵母细胞优越性在于卵母细胞已处于成熟期,解冻后可直接授精,无需进行体外成熟。其不足之处在于具有对温度敏感性非常高的纺锤体,在降温过程中极易解聚,使出现非整倍染色体的几率增加,影响卵母细胞的发育[2]。冷冻保存GV期卵母细胞因为染色体有核膜包裹,可能避免其受到损伤。但是,新问题随即出现,比如:GV期卵母细胞有卵丘细胞包裹,所以体积较大,并且卵母细胞膜对水和冷冻保护剂的渗透性(影响冷冻能力的关键因素)比MⅡ期低,解冻后会严重损伤其超微结构,而最大的障碍就是GV期卵母细胞外层包裹着的卵丘细胞,冷冻过程中会影响冷冻渗透液的进入、胞内水分向外渗透以及快速冷却的速率等,而且卵丘细胞的质膜与卵母细胞之间是通过冠状细胞进行锚定连接的,在快速降温之前、处于冷冻液中的卵母细胞是处在一个不等渗的环境,这势必会引起卵母细胞收缩,而导致卵母细胞膜发生破裂或出现损伤,尤其是在急速降温条件下[11-13]。Cetin[19]和 Tharasanit等[20]发现,玻璃化冷冻的GV期卵母细胞对玻璃化冷冻的敏感性比MⅡ卵母细胞更高,他们认为冷冻未成熟卵母细胞虽然没有纺锤体微管存在所引起的冷冻问题,但随后纺锤体形成以及极体释放仍受影响,表明降温可导致未成熟卵母细胞的主要调控因子,如细胞成熟促进因子(MPF),促细胞分裂激活蛋白(MAPK)以及其他微管组织影响因素的损伤,而且冷冻同时也可破坏转录激活、翻译等生化过程从而对胞质成熟产生不良反应。
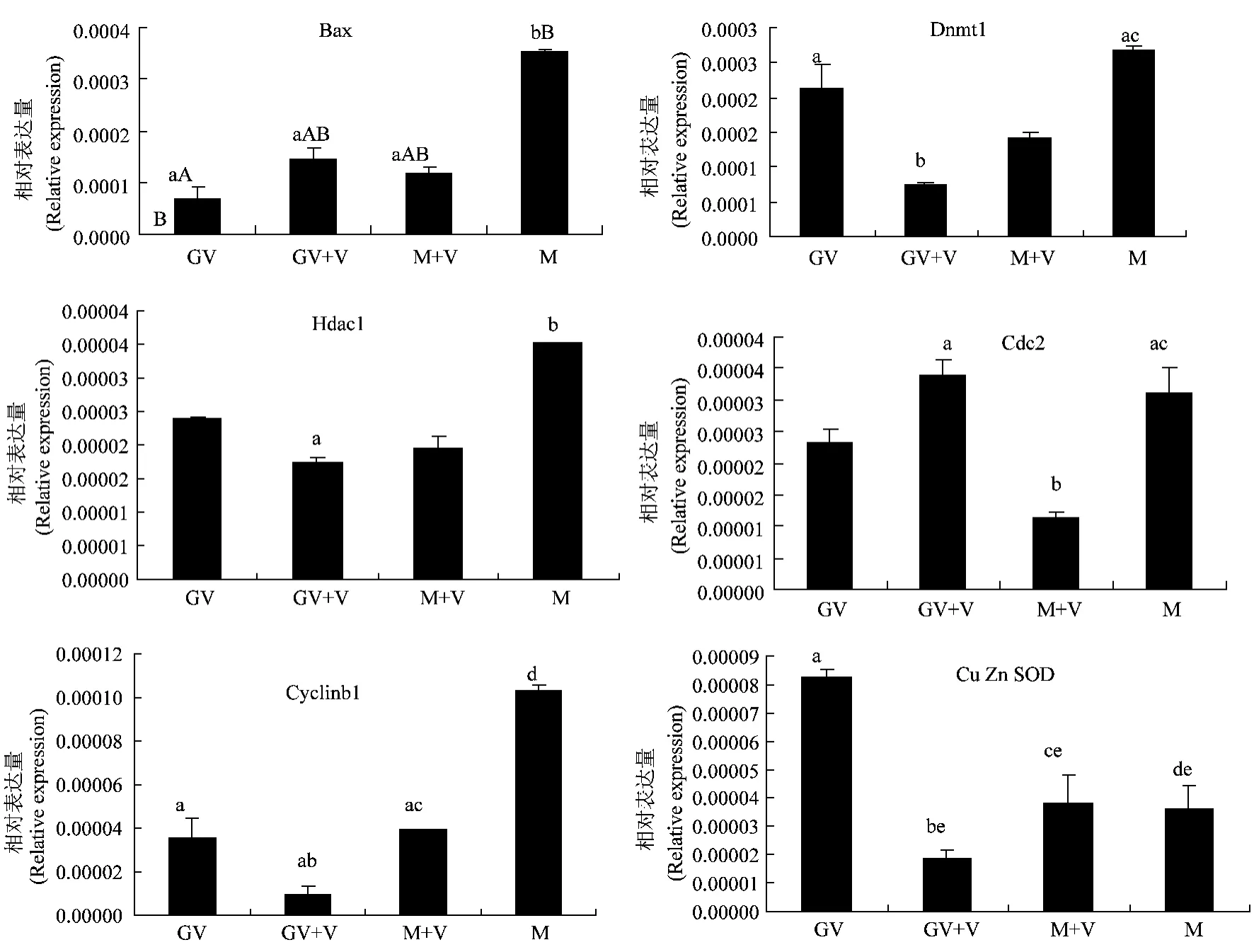
图1 GV期及M期卵母细胞玻璃化冷冻后Bax、Dnmt1、Hdac1、Cyclinb1、Cdc2和Cu Zn SOD基因mRNA相对表达量Fig.1 Relative mRNA expression of Bax,Dnmt1,Hdac1,Cyclinb1,Cdc2 and Cu Zn SOD in vitrified-warmed oocytes in GV and IVM periods
而Chian等[14]报道没有卵丘细胞包裹的成熟牛卵母细胞经过玻璃化冷冻后,仍有较高的存活率;Ledda等[16]认为,在玻璃化冷冻羊 GV期卵母细胞之前,将卵丘细胞去掉,有益于其解冻后的体外成熟;Baka 等[17]和 Van DerElst等[18]也证明不成熟卵母细胞经过冷冻后,不会提高减数分裂纺锤体的异常率。本实验结果中,GV期卵母细胞经玻璃化冷冻后的囊胚率(3.0%)极显著低于对照组(P<0.01),与 Dong-Hoon KIM 和 Hyo-Sok PARK 等[15]用微滴法冷冻牛 GV期卵母细胞的结果(囊胚率为2.3%)较为一致;而冷冻M期卵母细胞后的囊胚率显著高于GV期,又印证了成熟卵母细胞较GV期卵母细胞耐冻这一说法。
哺乳动物胚胎能够发生分裂,是靠在卵母细胞时期所积累的母源mRNA和蛋白质所支持完成的,而卵母细胞的发育能力被认为是依赖卵母细胞中那些特殊的转录因子和 mRNA的组成以及丰度[21]。因此,我们对玻璃化冷冻和对照组(不冷冻)卵母细胞中的一些与发育相关的重要基因进行了mRNA定量分析,以此来衡量玻璃化冷冻对这些mRNA的影响。
总体来看,牛卵母细胞在 GV期时,这些基因mRNA表达量会有一定积累,可能是处于这一时期的卵母细胞为后期发育积蓄物质基础;对这一时期的卵母细胞进行玻璃化冷冻后,除了Bax基因有所升高外,其他基因mRNA表达量均降低;当牛卵母细胞处于M期时,除了Cu Zn SOD基因以外,其余基因mRNA表达量在M期均为最高,暗示卵母细胞在M期将会为紧接着发生的受精作用蓄积大量的mRNA,而将此时的卵母细胞采用微滴法进行玻璃化冷冻,则会降低这些基因的mRNA表达量,尤其是 Cdc2(P<0.05)、cyclin b1(P<0.05)和 Bax(P<0.01)基因较对照组 mRNA表达量下降较为明显。说明不论卵母细胞处于GV期还是M期,玻璃化冷冻在改变或影响卵母细胞生理或形态的同时,也对其积累的这些基因的表达量起到了抑制作用,从基因的角度说明玻璃化冷冻牛卵母细胞后,一些基因的mRNA表达量会降低,可能会对其转录或蛋白质翻译产生负面影响,从而导致其后期发育受到阻滞,但对其转录或蛋白质翻译会产生哪些具体影响,还需要进一步进行研究和探索。
[1] Vajta G,Nagy ZP.Are programmable freezers still needed in the embryo laboratory?Review on vitrification[J].Reprod Biomed Online,2006,12:779-796.
[2] Men H,Monson RL,Parrish JJ,et al.Detection of DNA damage in bovine metaphase II oocytes resulting from cryopreservation[J].Mol Reprod Dev,2003,64:245-250.
[3] Diez C,Duque P,Gomez E,et al.Bovine oocyte vitrification before or after meiotic arrest:effects on ultrastructure and developmental ability[J].Theriogenology,2005,64:317-333.
[4] Rizos D,Gutierrez-Adan A,Moreira P,et al.Species-related differences in blastocyst quality are associated with differences in relative mRNA transcription[J].Mol Reprod Dev,2004,69:381-386.
[5] Liu RH,Sun QY,Li YH,et al.Effects of cooling on meiotic spindle structure and chromosome alignment within in vitro matured porcine oocytes[J].Mol Reprod Dev,2003,65:212-218.
[6] Telford NA,Watson AJ,Schultz GA.Transition from maternal to embryonic control in early mammalian development:a comparison of several species[J].Mol Reprod Dev,1990,26:90-100.
[7] Wrenzycki C,Herrmann D,Lucas-Hahn A,et al.Messenger RNA expression patterns in bovine embryos derived from in vitro procedures and their implications for development[J].Reprod Fertil Dev,2005,17:23-35.
[8] 陆文昊,程晋,王维,等.自制载体冷冻小鼠原核期胚胎效果分析[J].中国实验动物学报,2010,18(4):283-288.
[9] Vajta G,Holm P,Kuwayama M,et al.Open pulled straw(OPS)vitrification:A new way to reduce cryoinjuries of bovine ova and embryos[J].Mol Repro Dev,1998,51:53-58.
[10] Lane M,Scholcraft WB,Gardener DK.Vitrification of mouse and human blastocysts using a novel cryoloop container-less technique[J].Fert Steril,1999,72:1073-1078.
[11] Comizzoli P,Wildt DE,Pukazhenthi BS.Impact of anisosmotic conditions on structural and functional integrity of cumulus-oocyte complexes at the germinal vesicle stage in the domestic cat[J].Mol Reprod Dev 2008a,75:345-354.
[12] Shaw JM,Oranratnachai A,Trounson AO.Fundamental cryobiology of mammalian oocytes and ovarian tissue[J].Theriogenology,2000,53:59-72.
[13] Luvoni GC,Pellizzari P.Embryo development in vitro of cat oocytes cryopreserved at different maturation stages[J].Theriogenology,2000,53:1529-1540.
[14] Chian,Kuwayama,Tan,et al.High survival rate of bovine oocytes matured in vitro following vitrification[J].J Reprod Dev,2004,50:685-696.
[15] Kim DH,Park HS,Kim SW,et al.Vitrification of immature bovine oocytes by the microdrop method[J].J Reprod Dev,2007,53(4):843-51.
[16] Ledda S,Bogliolo L,Succu S,et al.Oocyte cryopreservation:oocyte assessment and strategies for improving survival[J].Reprod Fertil Dev,2007,19:13-23.
[17] Baka SG,Toth TL,Veeck LL,et al.Evaluation of the spindle apparatus of in-vitro matured human oocytes following cryopreservation[J].Hum Reprod,1995,10(7):1816-1820.
[18] Van der Elst J,Van den Abbeel E,Vitrier S,et al.Selective transfer of cryopreserved human embryos with further cleavage after thawing increases delivery and implantation rates[J].Hum Reprod,1997,12(7):1513-1521.
[19] Cetin Y,Bastan A.Cryopreservation of immature bovine oocytes by vitrification in straws[J].Anim Reprod Sci,2006,92(12):29-36.
[20] Tharasanit T,Colenbrander B,Stout TA.Effect of maturation stage at cryopreservation on post-thaw cytoskeleton quality and fertilizability of equine oocytes[J].Mol Reprod Dev,2006,73(5):627-637.
[21] De Sousa PA,Caveney A,Westhusin ME,et al.Temporal patterns of embryonic gene expression and their dependence on oogenetic factors[J].Theriogenology,1998,49:115-128.
Vitrification of bovine oocytes affects their gene mRNA abundance
LIN Jia-peng1,WANG Jing1,2,ZHAO Yun-cheng1,CHEN Tong1,WANG Li-qin1,CHEN Bo1,2,HUANG Jun-cheng1
(1.Xinjiang Academy of Animal Sciences,The Key Laboratory of Livestock Reproduction& Breed Biotechnology of Ministry of Agriculture,Xinjiang Academy of Biotechnological Center,Urumqi 830000,China;2.Xinjiang Agricultural University Agronomy College,Urumqi 830052)
Objective To evaluate the mRNA expression abundance of genes,which are related with embryonic development and ability to undergo successful fertilization,cleavage and blastocyst development,in the GV stage and in vitro matured(IVM)bovine oocytes.Methods The oocytes that vitrified-warmed at GV(n=224)and IVM(n=235)were in vitro fertilized and cultured up to blastocyst stage under standard conditions.In parallel,we analyzed the relative abundance of Bax,Dnmt1,Hdac1,cyclinb1,Cdc2 and Cu Zn SOD transcripts of the vitrified-warmed oocytes by quantitative real time-PCR.Result Vitrified oocytes in both GV and IVM stages showed a lower cleavage rate(14.7% ~89.4%,34.5% ~89.4%,P<0.001)and development to blastocyst stage(3.0% ~28.4%,12.3% ~28.4%,P<0.001)than that in the control group(n=238). In addition,vitrified oocytes in GV stage showed a lower cleavage rate(14.7% ~34.5%,P<0.001)and development to blastocyst stage(3.0% ~12.3%,P<0.001)than those of vitrified oocytes in IVM period.In the oocytes vitrified in GV period,the Dnmt1 and Cu Zn SOD expression abundance was significantly lower than that of controls(P <0.05).In the oocytes in M phase,the expression of Bax mRNA was very significantly lower thanthat in controls(P<0.01),and the mRNA expression of cyclinb1,Cdc2 and Cu Zn SOD was significantly lower than that of controls(P<0.05).(P<0.05).No other significant changes were found in the expression abundance of other genes.Conclusions Following vitrification the bovine oocytes in GV or IVM stage may lead to a lower transcript abundance,that may have negative effects on embryonic development.
Vitrification;Gene expression;Expression abundance;Bovine oocyte;Developmental competence
Q95-33,R-114
A
1005-4847(2011)02-0134-06
10.3969/j.issn.1005-4847.2011.02.011
新疆自治区自然科学基金(200821182);新疆自治区科技攻关(200841122);新疆自治区科技计划项目(200711104);国家支撑计划(2008BADB2B05-10);国家“十一五”863计划(2008aa101005)。
林嘉鹏(1983-),男,助理研究员,硕士,研究方向:胚胎生物技术。E-mail:350083204@qq.com
黄俊成(1968-),男,研究员,博士,研究方向:动物生殖与发育研究。E-mail:h_jc@sina.com
2010-09-29

