哺乳期接触双酚A对子代雄鼠睾丸结构及雌激素受体β表达的影响
丁保清,张义军,解美娜,李莎莎
(1.潍坊医学院药理学教研室,潍坊 261053;2.潍坊医学院医学研究实验中心,潍坊 261053)
哺乳期接触双酚A对子代雄鼠睾丸结构及雌激素受体β表达的影响
丁保清1,张义军1,解美娜2,李莎莎1
(1.潍坊医学院药理学教研室,潍坊 261053;2.潍坊医学院医学研究实验中心,潍坊 261053)
目的 研究哺乳期接触双酚A(BPA)对雄性小鼠睾丸结构及雌激素受体β(ERβ)表达的影响。方法 20只妊娠母鼠,待分娩后随机分为高、中、低剂量组,BPA染毒剂量为100、50、5 mg/(kg·d)和对照组,母鼠分娩后第2天开始每天灌服BPA,仔鼠通过乳汁暴露于BPA,一直持续到第22天断奶,研究其成年后睾丸组织形态学改变,并用免疫组织化学、RT-PCR和Western blot方法研究BPA对其成年后睾丸内ERβ表达的影响。结果 睾丸形态学分析表明BPA处理组睾丸发育受到严重影响,生精细胞排列紊乱,支持细胞和各级生精细胞生长受到不同程度的抑制;免疫组化、RT-PCR及Western blot均显示,高、中、低剂量组雄鼠成年后睾丸组织中ERβ的表达均高于对照组,差异均有统计学意义(P<0.05,P<0.01)。结论 哺乳期接触BPA影响雄鼠睾丸发育,改变其成年后睾丸形态,提高睾丸组织内ERβ表达,提示BPA可能通过改变雌激素受体表达从而影响睾丸发育。
双酚A;哺乳期;睾丸;雌激素受体β
双酚A(bisphenol A,BPA)是一种环境内分泌干扰物,有弱的雌激素活性,能进入环境而被人类和野生动物长期慢性接触,因其有脂溶性,不仅存在于食物、水、人类尿液、血液,在怀孕妇女的胎盘、羊水及母乳中也检测到了 BPA[1-3]。妊娠期和哺乳早期阶段是对雌激素样活性物质特别敏感的时期,母体染毒BPA后,可通过胎盘和乳汁传递给下一代,影响组织形成和发育,对人类和野生动物造成严重影响[4]。BPA可影响激素的水平,改变其靶组织的雌激素受体表达[5]。雌激素受体(estrogen receptor,ER)为核受体超家族成员之一,分为 ERα和ERβ[6,7]。在男性生殖系统中,ERβ 大量表达的组织是睾丸,成年ERβ主要见于生精细胞、精子细胞和支持细胞[8]。
目前有关BPA对发育中雄性小鼠生殖系统影响的研究还很少,以往对新生期暴露于BPA的实验多选择皮下注射[9,10],不能代表人类和动物的污染程度。另一方面,没有令人信服的证据证明BPA是否改变睾丸结构及组织内ERβ的表达。本实验采用ICR妊娠母鼠灌服 BPA,仔鼠通过乳汁暴露于BPA的给药方式,研究不同剂量双酚A污染对其子代雄鼠睾丸结构及组织中ERβ的表达量变化。
1 材料与方法
1.1 实验动物
怀孕的 ICR(Institute of Cancer Research)小鼠(Mus musculus),购自上海实验动物中心【SYXK(沪)2007-0005】,体重38~40 g,动物质量属于一级标准。饲养于清洁级动物实验室,饲养环境控制在室温(24±2)℃,相对湿度40% ~50%,饲喂颗粒料,自由饮清洁水,自动通风,并按实验动物使用的3R原则给予人道的关怀。
1.2 实验方法
1.2.1 动物模型的制备:20只怀孕的ICR小鼠,待分娩后随机分为高、中、低剂量组[BPA染毒剂量为100、50、5 mg/(kg·d)]和对照组,从分娩第 2 天起一直持续到第22天断奶给母鼠每天灌服溶于食用玉米油的 BPA(Sigma-Aldrich公司,纯度 99%),BPA先用无水乙醇溶解,再用玉米油稀释成所需浓度,配制成 40、20、2 mg/mL,灌胃体积为 2.5 mL/kg,即 3 个实验组剂量分别为 100、50、5 mg/kg,对照组用食用玉米油灌胃作为试剂对照。断奶后,雄性仔鼠与母鼠分笼饲养至成年,到第75天,雄鼠称体重后处死,取一部分睾丸组织固定于4%甲醛中,另一部分置于DEPC处理过的冻存管中,标记后放入-152℃冰箱低温保存备用。
1.2.2 睾丸形态学分析:固定后的睾丸经脱水、透明、浸蜡后包埋,制作成5 μm石蜡切片,HE染色后观察睾丸形态学变化。
1.2.3 免疫组织化学法检测睾丸内 ERβ表达:5 μm厚的切片常规脱蜡入水,微波修复抗原,3%H2O2溶液孵育20 min以消除内源性过氧化物酶的活性,PBS冲洗(5 min×3次),正常山羊血清37℃孵育30 min,滴加1∶50稀释的一抗ERβ(购自Santa Cruz Biotechnology Inc,商品号 SC-8974),4℃ 过夜,以PBS代替一抗为阴性对照。PBS冲洗(5 min×3次),滴加生物素化羊抗兔IgG二抗工作液,37℃孵育30 min,PBS冲洗(5 min×3次),滴加辣根酶标记链霉卵白素工作液,37℃孵育30 min,PBS冲洗(5 min × 3次),DAB(3,3-二氨基联苯胺)显色,然后按常规脱水、透明、中性树胶封片,光镜下观察染色情况。采用Image-Pro Plus图像分析系统对ERβ表达情况进行分析。
1.2.4 RT-PCR方法检测睾丸内ERβ:取新鲜冻存睾丸组织25 mg,按Trizol试剂盒(上海生物工程技术服务有限公司)提供方法,提取总RNA,取总RNA 2 μL转录成 cDNA进行扩增,取 β-actin作为内参照。ERβ引物和β-actin引物由上海生物工程技术服 务 有 限 公 司 合 成,ERβ:forward 5′-CAGTAACAAGGGCATGGAAC-3′, reverse5′-GTACATGTCCCACTTCTGAC-3′,退火温度 50℃,35 个循环,扩增片 段 长 度 243bp; β-actin: forward 5′-GAGAGGGAAATCGTGCGTGAC-3′,reverse5′-CATCTGCTGGAAGGTGGACA3-′,退火温度 48℃,30 个循环,扩增片段长度452-bp。PCR产物经1%琼脂糖凝胶电泳观察结果、照相,用凝胶图像分析系统分析结果,分别计算各组睾丸组织条带的积分吸光度(IA)与相对的β-actin条带 IA的比值,为各目的基因 mRNA表达的相对水平。
1.2.5 Western blot检测睾丸组织 ERβ的表达:取新鲜冻存睾丸组织,按蛋白抽提试剂盒(明日百奥科技有限公司)提供方法,提取蛋白,采用 10%SDS-聚丙烯酰胺凝胶进行电泳,积层胶时用80 V恒压电泳,待溴酚兰前沿进入分离胶后,电压改为120 V继续电泳,总时间2 h左右。电泳后将凝胶中的蛋白通过半干转移方法转移到PVDF膜上。将膜从电转槽中取出,浸没于5%奶粉封闭液中缓慢摇荡1h。将膜置于1∶1000的 ERβ 2 mL或 1∶1000稀释的β-actin抗体中4℃孵育过夜;用1‰ TBST在摇床上摇动漂洗膜三次,每次15 min;将膜置于 HRP标记的山羊抗兔 IgG(1∶1000)2 mL中室温轻摇孵育2 h;1‰ TBST摇动漂洗膜3次,每次15 min;ECL光试剂盒显影、X片感光后显影定影,清水冲净晾干。
表2给出了对碟式太阳能热发电系统进行能量分析和 分析的结果。从表2可以看出最大的能量损耗发生在斯特林发电机,为42.27 kW,其次是集热子系统,为19.38 kW。集热子系统热效率为77.87%,整个碟式太阳能热发电系统的热效率是29.67%。对碟式太阳能热发电系统 分析的结果显示,集热子系统的 损失为33.14 kW,斯特林发电机 损失为22.44 kW。集热子系统的 效率为59.37%。碟式太阳能热发电系统的整体 效率31.88%。
1.3 数据分析
所有免疫组化、RT-PCR及Western blot数据表示为(¯x±s),应用SPSS13.0统计软件进行方差分析,差异显著性水平P<0.05。
2 结果
2.1 BPA对仔鼠成年后睾丸发育的影响
在对照组中,曲细精管内的细胞排列规则,细胞质和细胞核饱满丰富,在BPA处理组中,睾丸发育受到严重影响,生殖细胞排列层次发生不同程度的紊乱,管腔内的精子细胞数目稀少,支持细胞和各级生精细胞生长受到不同程度的抑制,曲细精管管腔中出现大量胞质残余体,部分管腔出现潴留管腔液(图 1,彩插 8)。
2.2 免疫组织化学检测睾丸组织ERβ蛋白和定量分析
免疫组织化学的结果表明ERβ主要为胞核表达,主要表达在支持细胞、初级精母细胞和次级精母细胞,个别间质细胞胞核也表达,并且在不同的生精小管中有两种形式的表达,部分生精小管内ERβ只在支持细胞表达,而在另外一些生精小管除了支持细胞外精母细胞也有 ERβ的表达(图2,彩插8)。图像分析结果表明,高、中、低剂量组仔鼠成年后睾丸组织中单个阳性细胞ERβ的表达均高于对照组,平均吸光度值高于对照组(P<0.01)(表1)。
2.3 RT-PCR检测ERβ mRNA的表达
表1 接触BPA后雄鼠睾丸中ERβ免疫组化分析(s,n=20)Tab.1 Immunohistochemistry analysis of the expression of ERβ in the testis of BPA-treated mice(s,n=20)

表1 接触BPA后雄鼠睾丸中ERβ免疫组化分析(s,n=20)Tab.1 Immunohistochemistry analysis of the expression of ERβ in the testis of BPA-treated mice(s,n=20)
注:与对照组比较,**P<0.01。Note:compared with the control group,**P <0.01.
?
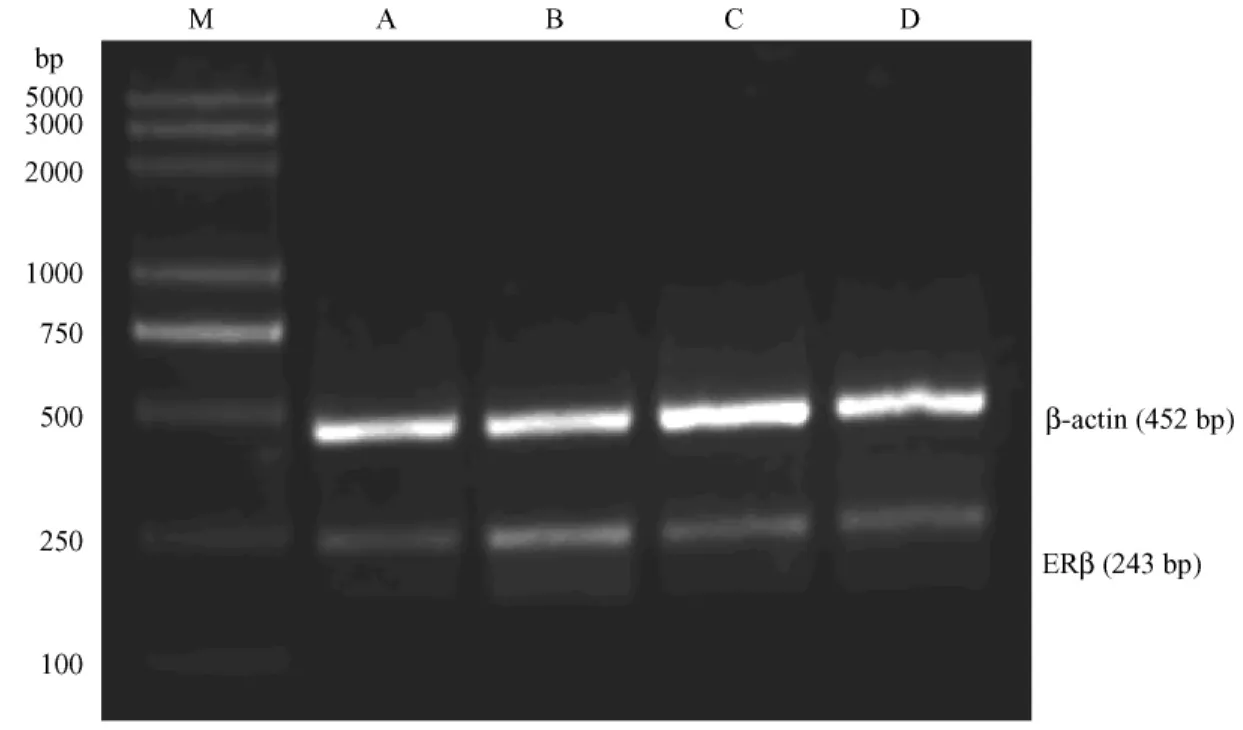
图3 睾丸组织ERβ与β-actin mRNA的表达Fig.3 RT-PCR results of ERβ and β-actin mRNA experssion in the testis tissues
2.4 Western blot测定不同组别ERβ的表达情况
采用Gel-Pro图像分析系统进行分析(表3),高、中、低剂量组雄性睾丸组织中ERβ的表达均高于对照组(P<0.05,P<0.01),且中、低剂量组比高剂量组增加明显(图4)。
表2 雄性小鼠成年后睾丸组织ERβ与β-actin mRNA比值(s,n=20)Tab.2 The IA ratio of ERβ/β-actin mRNA in the testis of adult male mice(s,n=20)

表2 雄性小鼠成年后睾丸组织ERβ与β-actin mRNA比值(s,n=20)Tab.2 The IA ratio of ERβ/β-actin mRNA in the testis of adult male mice(s,n=20)
注:与对照组比较,**P<0.01。Note: compared with the control group,**P <0.01.
?
表3 睾丸中ERβ蛋白表达的Western blot分析(s,n=20)Tab.3 Western blot analysis of the expression of ERβ protein in the testis of BPA-treated mice(s,n=20)

表3 睾丸中ERβ蛋白表达的Western blot分析(s,n=20)Tab.3 Western blot analysis of the expression of ERβ protein in the testis of BPA-treated mice(s,n=20)
注:与对照组比较,*P <0.05,**P <0.01。Note: compared with the control group,*P <0.05,**P <0.01.
?

图4 睾丸组织ERβ与β-actin蛋白的表达Fig.4 Western blot results of ERβ and β-actin protein experssion in the testis tissues
3 讨论
最近几年,对环境内分泌干扰物的研究已成为各国学者关注的热点。已有大量证据表明BPA影响生殖系统的发育[11,12],给哺乳期大鼠口服 C14标记的BPA,发现一部分放射性物质经受试大鼠母乳转移给新生仔鼠,证明 BPA可进入母乳[12]。母体内蓄积的BPA会使新生儿暴露于 BPA,另外,一些塑料制品包括哺乳瓶内所溶解出的BPA也对新生儿存在着潜在的危害。子代哺乳期,是生殖系统发育的一个敏感时期。生殖系统的正常发育受激素的调控,发育阶段暴露于环境内分泌干扰物,将破坏体内性激素的代谢平衡,干扰支持细胞早期的快速增殖,影响生精小管的发育成熟,严重的可导致永久的,不可逆的生殖系统发育异常[13,14]。BPA 为环境内分泌干扰物的一种,可干扰内源性性激素正常水平的维持而影响生殖系统发育。吕毅等[15]研究胚胎期接触双酚A对雄性仔鼠的生殖功能的影响,发现妊娠小鼠灌服 BPA,可使仔鼠曲细精管排列紊乱,曲细精管管腔中成熟精子数减少,睾丸乳酸脱氢酶和6-磷酸葡萄糖脱氢酶活性改变。但目前对BPA是否干扰睾丸内雌激素受体表达的研究还很少。本实验通过雄性仔鼠在哺乳期接触BPA,在研究BPA暴露对子代雄鼠睾丸组织结构的影响的同时,通过研究睾丸组织 ERβ的表达量变化情况,探讨BPA影响睾丸发育的机制。
实验发现雄性仔鼠在哺乳期接触BPA导致睾丸支持细胞生长被抑制,不同发育阶段的生精细胞的生长受到不良影响。支持细胞在睾丸中起到支持和营养生精细胞的作用,曲细精管结构和生精细胞形态的改变可能源自支持细胞的生长和功能受到抑制。另外在睾丸发育的过程中,雌激素对支持细胞功能的实现和生殖细胞附着在支持细胞上起重要作用。BPA的雌激素样作用可能会干扰睾丸支持细胞和生精细胞的发育[16]。而雌激素的作用主要是由靶细胞上特异的胞内受体介导的。在生殖系统中,雌激素主要通过与 ERα、ERβ结合,形成“配体-受体复合体”调节基因的转录活性[17]。ER上具有多个配体结合部位,某些部位可与内源性雌激素结合,而其他部位则可与环境雌激素样物质相结合,环境雌激素样物质与ER结合后则可与雌激素发挥协同作用,激发雌激素效应的产生[18]。
我们前期实验发现哺乳期暴露于BPA后,子代雌激素水平升高,精子畸形率显著升高,睾丸内ERα表达上调[19]。除 ERα外,另外也有研究发现ERβ在不同发育阶段的生精细胞及支持细胞上也有表达[8],说明ERβ在睾丸发育和精子发生的过程中也发挥作用,影响精子的生成。BPA有雌激素样作用,可影响生殖功能[16],在本实验中,我们发现哺乳期暴露于BPA导致了雄性仔鼠成年后睾丸组织中ERβ的mRNA和蛋白表达上调,这可能也与BPA的雌激素样作用有关,BPA与睾丸中 ERβ结合,模拟雌激素的作用,导致受体激活和引发相应的生物效应。同时实验中也发现低剂量组ERβ表达最高,这可能与激素和内分泌干扰物的剂量和效应通常呈非线性关系,而表现为U型或倒U型剂量效应关系有关。但激素受体的表达是一个非常复杂的过程,通常受到体内多种激素的调控,如下丘脑、垂体分泌的激素也会影响到雌激素的分泌,从而影响ER的表达。双酚A本身也可诱导或抑制下丘脑、垂体等器官相应激素的释放[20],本实验中双酚A对睾丸发育的影响也有可能是通过干扰下丘脑、垂体的内分泌功能而产生的间接影响,具体原因还有待于进一步研究。
哺乳期接触BPA对雄鼠睾丸发育有着长期的不良影响。BPA可能通过改变雌激素受体表达从而影响睾丸发育,继而可能影响睾丸功能、精子质量及生育功能,导致相关的行为学的异常。
(本文图 1,2 见彩插 8。)
[1] Heemken OP,Reincke H,Stachel B,et al.The occurrence of xenoestrogens in the Elbe River and the North Sea[J].Chemosphere,2001,45(3):245-259.
[2] Thomson BM,Grounds PR.Bisphenol A in canned foods in New Zealand: an exposure assessment[J].Food Addit Contam,2005,22(1):65-72.
[3] Kuruto-Niwa R,Tateoka Y,Usuki Y,et al.Measurement of bisphenol A concentrations in human colostrum[J].Chemosphere,2007,66(6):1160-1164.
[4] Kang JH,Kondo F,Katayama Y.Human exposure to bisphenol A[J].Toxicology,2006,226(2-3):79-89.
[5] Richter CA,Birnbaum LS,Farabollini F,et al.In vivo effects of bisphenol A in laboratory rodent studies[J].Reprod Toxicol,2007,24(2):199-224.
[6] Nilsson S,Makela S,Treuter E,et al.Mechanisms of estrogen action[J].Physiol Rev,2001(81):1535-1565.
[7] 关铮,李亚里,宫庭钰等.ERβ对子宫内膜异位症小鼠模型的影响[J]. 中国实验动物学报,2009(17)4:270-274.
[8 ] Sar M,Welsch F.Oestrogen receptor α and β in rat prostate and epididymis[J].Andrologia,2000,32(4-5):295-301.
[9] Nagao T,Saito Y,Usumi K,et al.Low-dose bisphenol A does not affect reproductive organs in estrogen-sensitive C57BL/6N mice exposed at the sexually mature,juvenile,or embryonic stage[J].Reprod Toxicol,2002,16(2): 123-130.
[10] Noda S,Muroi T,Mitoma H,et al.Reproductive toxicity study of isphenol A,nonylphenol,and genistein in neonatally exposed rats[J].Toxicol Pathol,2005,18(4): 203-207.
[11] Goyal HO,Robateau A,Braden TD,et al.Neonatal estrogen exposure of male rats alters reproductive functions at adulthood[J].Biol Reprod,2003,68(6):2081-2091.
[12] Tando S,Itoh K,Yaoi T,et al.Effects of pre-and neonatal exposure to bisphenol A on murine brain development[J].Brain and Dev,2007,29(6):352-356.
[13] Morrissey RE,George JD,Price CJ,et al.The developmental toxicity of bisphenol-A in rats and mice[J].Fundam Appl Toxicol,1987,8(4):571-582.
[14] Akita M,Yokoyama A,Shimizu S.et al.Effects of bisphenol A on cultured rat embryos[J].Teratology,2000,62(3):15A.
[15] 吕毅,吕海霞,王洪海,等.双酚A对雄性仔鼠生殖功能的影响.吉林大学学报(医学版)[J], 2008,34(4):618-620.
[16] Toppari J,Larsen JC,Christiansen P,et al.Male reproductive health and environmental xenoestrogens(special reports)[J].Environ Health Perspect,1996,104(4):741-803.
[17] 蒋春霞,潘连军,黄宇烽.雌激素受体在雄性生殖系统中的作用及其对雄性生殖的作用[J].中华男科学杂志,2007,13(6):550-553.
[18] 卢军萍,蔡德培.环境内分泌干扰物与青春期发育异常[J].国外医学儿科学分册,2005,32(3):108-111.
[19] 解美娜,李锋杰,丁保清,等.哺乳期接触双酚A对雄鼠生殖发育的影响及其机制的研究[J].动物学杂志,2010,45(4):31-38.
[20] 秦定霞,崔毓桂,刘嘉茵.双酚A对生殖系统的影响及其作用机制[J].国际生殖健康/计划生育杂志,2010,29(1):26-29.
Effects of lactational exposure to bisphenol A on the structure of testis and the expression of estrogen receptor β in adult male mouse offsprings
DING Bao-qing1,ZHANG Yi-jun1,XIE Mei-na2,LI Sha-sha1
(1.Department of Pharmacology,2.Medical Experiment Center,Weifang Medical University,Weifang Medical University,Weifang 261053,China)
Objective To study the effects of lactational exposure to bisphenol A(BPA)on the structure of testis and the expression of estrogen receptor β in adult male mouse offsprings.Methods BPA(at a dose of 100,50,or 5 mg/kg)was given daily by gastric gavage to female mice(Mus musculus)on postpartum days 2-22,and the mice offsprings were exposed to BPA by maternal milk.The pups were sacrificed on postnatal day(PND)75 and the testes were removed for pathological examination,and the expression of estrogen receptor β by was assessed by immunohistochemistry,RT-PCR and Western blot analysis.Result BPA inhibited the development of testis.The appearance of the spermatogenic cells was disordered.BPA treatment caused an up-regulation of ERβ relative expression in the testis,especially it was significantly in the low-dose group.Conclusions Lactation exposure to BPA causes morphological changes in the testis,and an up-regulation of ERβ expression in the testis of the male offsprings,leading to changes in the development of testis.
Bisphenol A;Lactation;Testis;ERβ
Q95-33,R-114
A
1005-4847(2011)02-0140-05
10.3969/j.issn.1005-4847.2011.02.012
山东省高等学校科技计划项目(No.J08LG77)。
丁保清(1984-),女,硕士研究生,研究方向:内分泌干扰物生殖毒理研究。
张义军,教授。Email:zhangyijun200839@sina.com
2010-10-11

