微流控技术与芯片实验室
赵亮 黄岩谊
(北京大学工学院 北京大学生物动态光学成像中心 北京 100871)
芯片实验室是lab-on-a-chip的直译,它并不是一个精确定义的科学概念,而是一个新兴的领域。原则上,所有生物与化学实验室功能的微型化手段均可以用芯片实验室技术来指代。芯片实验室概念中的代表性技术就是针对小尺度液体操控的微流控技术(microfluidics)。 除此之外,芯片实验室技术也包括了非流动的静态微型实验系统,例如传统定义中的生物芯片。这类芯片系统通常是微阵列芯片(micro-arrays),如基因芯片、蛋白质芯片等。它们的特点是流体的流量通常未被控制,可以认为是微流控芯片的特殊类型。这类芯片一般通过检测点阵上的不同反应(如杂交或者蛋白相互作用等)来进行分析,功能较为有限。相对而言,可以控制流体精确运动的微流控芯片则具有更广泛的类型、功能与用途。这一技术受到许多从事物理科学(物理学、化学、力学等)、生命科学以及工程科学的研究者的广泛关注,被应用到这些领域的实验研究中。本文主要介绍微流控芯片技术及其基本发展过程,着重介绍微流控芯片技术的最新研究进展及其在化学和生命科学领域的应用。
在化学和生物学研究中,绝大部分实验都是在溶液状态下进行的。由于研究人员对化学和生物学实验的液体体积要求越来越小,通量要求越来越高,对实验自动化与可操控性的要求也越来越迫切,传统的承载和转移操作液体的器材和工具(如烧杯、试管、培养皿等)已经不再满足科学工作者的需求。新型技术手段必须具备可操作更小体积的液体、更小型化的尺寸、更高的实验通量、更加自动化控制的特点。 微流控芯片就是一种在这样的需求中应运而生的技术,用以进行微量甚至是极微量液体的操控与分析。
从微流控芯片的发展历史上看,这一技术的孕育和发展具有一定的必然性。科研市场和医疗的需求,加上在微电子领域的相关加工技术日渐成熟,催生了微流控芯片技术并加速了它的发展[1]。在医疗健康、检验检疫、环境监测、劳动保护、司法鉴定等领域,对分子分析的需求越来越多,要求也越来越高。对分离分析技术如色谱和毛细管电泳手段的微型化,成为市场的实际需求。这一需求的背后,是庞大的医疗诊断消费群体以及国家安全的需要。随着分子生物学的研究日渐深入,更大通量和更低消耗的实验技术成为必需。微流控芯片技术正好代表了这种趋势,符合现代分子生物学、基因组学、蛋白质组学等学科的发展步伐。20世纪后半叶迅速发展的微电子工业积累了大量的微加工经验,这些经验不仅使得许多微流控芯片加工所必需的理论和技术得以成熟,而且成型了许多相关设备和仪器,发明了许多相应的新材料;同时,由于产业的推动和市场的不断扩大,加工成本也大大降低。
1975年,斯坦福大学的Terry等人[2]利用微加工手段,在一片硅晶片上蚀刻出了微细的管道,用作气相色谱的色谱柱,进行微量气体分离分析的研究。这个器件可能是第一个现代意义上的微流控装置。但是由于技术等因素的制约,这种芯片并未引起足够广泛的重视。随后,微流控技术的发展进入了相对迟滞的时期。1990年,Manz等人提出微全分析系统(micro total analysis system,μTAS)的概念[3],微流控芯片进入快速发展时期。Manz和Harrison等进行了深入合作,开展了一系列早期芯片毛细管电泳的开拓性研究工作[4]。这一时期,绝大多数芯片都是在硅和玻璃基底上制备的,直接借鉴微电子领域成熟的硅基微加工技术。1998年,G.M.Whitesides提出了软蚀刻(soft lithography)技术的概念,从此宣告微流控芯片进入了以弹性材料聚二甲基硅氧烷(poly (dimethlysiloxane),PDMS)为关键材料的时代[5],微流控芯片技术又进入了新一阶段的快速发展时期。2000年,S.R.Quake 等在加州理工学院提出了一种基于PDMS材料的多层软蚀刻技术(multilayer soft lithography)制作新型的气动微阀和微泵的概念[6]。2002年10月,Quake研究组正式应用气动微阀技术以“大规模集成微流控芯片”为题在美国《科学》杂志上发表文章,介绍集成了上千个微阀和反应器的微流控芯片[7],标志着芯片从简单的电泳分离到大规模集成化的技术飞跃。如今微流控芯片已经成为涵盖了从分离分析、化学合成 、医学诊断学、细胞生物学、神经生物学、系统生物学、结构生物学、微生物学等一系列应用研究领域的综合性交叉学科。
1 微流控芯片的加工与制备
微流控芯片技术从概念提出到诞生和发展,都离不开微加工技术。微加工技术的发展与微流控芯片的发展息息相关。另一方面,由于新材料应用和发展,微加工本身的内涵也得到了丰富。从早期微流控领域文献可以看到,大部分探索是直接采用电子学上的基片材料如硅片、玻璃等作为基本的芯片制作材料。如今这些材料大多已经被更为经济廉价的高分子塑胶材料代替。这种变化的主要原因在于许多时候硅片并不合适用作制作分离分析和液体操作的微流控芯片材料,因为它不透明且刚性较大,难以与成熟的光学检测平台集成在一起;而玻璃的光学性能虽然较好,但要加工制作复杂的多层结构比较困难,步骤相对繁琐,而且要想制作对液体操控所必需的微泵和微阀是非常困难的。
1998年,哈佛大学的Whitesides课题组发明了利用弹性高分子材料PDMS的快速复制成型的微加工方法,用于微流控芯片制备,该方法被称为软蚀刻技术(soft lithography)[5]。相对于玻璃材料和硅材料,这种技术加工制作方便,无须特别苛刻的微加工条件和实验条件,一次制成的模板可以多次重复使用,极大地缩短了芯片制作所需的时间,加快了研究的速度,降低了芯片制作的难度和成本。这些优点促使微流控芯片的研究进入了一个快速发展的时期。
软蚀刻技术的主要过程如图1A所示。首先,微流控芯片图形利用计算机图形软件设计,设计好的图形通过高分辨率打印而得到掩膜,再将该光刻掩模通过光刻的方法将图形转移到涂有光胶的基底上。以SU-8负性光胶为例,曝光的部分发生聚合反应而得以保留,未曝光的部分被显影液溶解洗去,留下的图形就作为芯片复制的阳模。然后,将PDMS预聚体倾倒在阳模上,进行烘烤使得PDMS预聚体交联固化形成浇铸的图形,从图形的四周切下PDMS芯片并从阳模上剥离起来,此时芯片管道已经在PDMS上形成凹槽。最后,在适当的地方打孔形成溶液的进出口,将带有图形的PDMS基片与另一片平面结合,进行可逆或者不可逆的封接,完成芯片的制作。

图1 软蚀刻技术和多层软刻蚀技术制作微流控芯片[5-6](A)软刻蚀技术原理示意图;(B)多层软刻蚀技术原理示意图,并列的微阀形成主动式微泵示意图及实物照片。
软蚀刻技术诞生后,人们开始可以利用PDMS弹性材料大量制作微流控芯片,同时也开始寻找各种可能的方法,以便能够在芯片上集成微阀和微泵等能够操控液体的控制元件。2000年,加州理工学院的Quake等人发明了多层软蚀刻技术,使得大规模集成微阀和微泵成为可能[6]。该技术巧妙地利用了PDMS材料的弹性,在芯片中可以方便地制作能够快速开关的气动微阀。2002年,他们又在美国《科学》杂志上报道集成了上千个微阀和上百个微反应腔室的微流控芯片,真正实现了芯片从简单控制到高密度大规模集成的飞跃。多层软蚀刻技术制作微阀微泵的过程如图1B所示。基于软蚀刻PDMS芯片复制技术,将两次制作的PDMS芯片管道上下交叠,中间以极薄的PDMS薄膜隔开分别作为流体层和控制层,当向控制层的管道施加气压的时候,PDMS薄膜会受挤压形变从而关闭流体层的管道,这样就形成了芯片中的主动微阀。这种主动阀的响应时间为毫秒量级,可以快速地在开与关两种状态之间切换。将3个主动阀并列排列,交叉相应,就形成了微型蠕动泵,可以有效地在芯片中传输液体。这种通过多层软蚀刻技术制备的主动阀有体积小、密封性好、透光性好、反应快、可精确驱动、高度集成化、使用时间长、制作简单、成本低等优势,因而被广泛使用到高通量的集成微流控芯片中。
2 微流控芯片的应用
2.1 微流控芯片用于生物大分子的分析
在某种程度上说,早期的微流控芯片是一种集成化的微分离器件。微分离已经成为微流控芯片领域中最成熟的一类技术,它在工业和商业上的率先成功应用有力地推动了微流控芯片的发展和壮大。在芯片上进行电泳的研究仍然是微流控领域的主流之一,微流控芯片的最早一轮应用也大都是从芯片毛细管电泳开始的。分离,特别是电泳分离,无疑在微流控芯片的研究中占有极为特殊的地位。需要强调的是,微流控芯片所涉及的分离只是芯片众多功能操作单元中的一种,而不是全部,尽管很多时候它还会被单独使用。
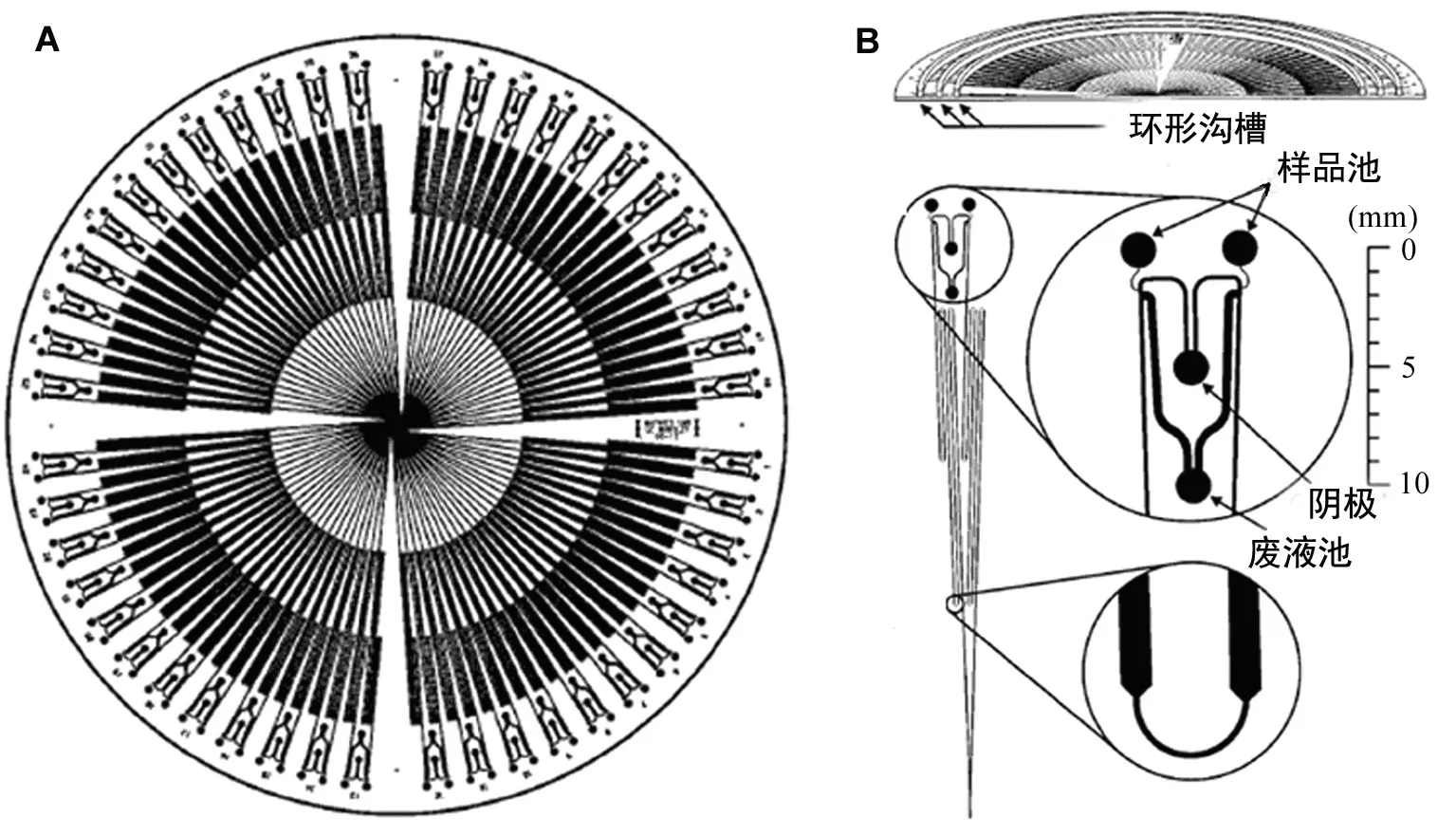
图2 用于高通量DNA测序的集成CD微流控芯片[8]蜿蜒管道能有效增加通道长度
DNA测序是核酸分析的最根本的手段,基于Sanger末端中止法的阵列毛细管电泳更是第一代DNA测序仪所采用的主流技术。随着微流控芯片技术的开端,最先用于其上的分析手段就是毛细管电泳,而如何利用芯片能够大规模集成的特点进行高通量快速的测序成为人们关注的热点问题。加州大学伯克利分校的Mathies等人设计了一种96通道微阵列电泳微流控芯片,使高通量的DNA测序第一次得以在微流控芯片上实现[8]。该芯片采用了转角蜿蜒设计(图2),将有效分离管道的长度加长到16cm,从而增加了一次电泳分析的可读片断长度,极大地提高了分析的通量。
蛋白质结构解析是结构生物学的基础,如何得到所需蛋白的单质结晶是确定整个蛋白质结构的一个主要瓶颈。微流控芯片上管道和流路精确可控、高度集成,从而为蛋白质结晶过程中的条件优化提供了一种新型平台,而且由于芯片中的液体体积多在纳升级别,可以极大节省辛苦提纯得到的蛋白质样品。芝加哥大学的Ismagilov研究组提出了一种芯片中高效简单的蛋白质单晶条件筛选新方法。他们在“T”字形管道芯片中的“T”节点处控制产生微液滴,从而形成一个个单独分散的微反应器,并在下游直接由X射线衍射出微液滴中蛋白单晶的衍射图,从而最终确定蛋白质分子的结构。通过控制各个分支管道中的流量,可以精确地控制蛋白和共沉淀剂的比例,此外单晶的结构可以直接在下游读出[9]。而Quake小组则通过高度集成的“配方芯片”和通过微尺度下自由扩散的方式,在芯片上实现了对结晶条件的快速筛选、对结晶过程的细微控制和晶体衍射数据的采集,极大提高了工作效率[10]。
2.2 微流控芯片用于细胞生物学的研究
细胞是生命的基本组成单元,细胞生物学的发展是推动现代生命科学进步的重要动力。我们对生命过程的深入了解和对人类健康的研究都离不开高效准确的细胞生物学实验。随着细胞生物学不断发展,我们对细胞的结构、组成和功能有了越来越多的了解,绝大多数认识是建立在针对大量细胞的系综平均结果基础上的。然而,近年来的一些深入研究表明,许多生命现象无法简单地从系综平均上得以理解和阐明,故在少量细胞乃至单个细胞层次上进行生命科学的研究显现出了迫切的重要性。绝大多数细胞的大小位于微米尺度,正好同微流控芯片中的通道大小相适应,这一匹配为操纵少数或者单个细胞提供了极为便捷的条件。集成微流控芯片在操作上可控性很强,从而为进行细胞培养、原位观察以及实时动态的微环境调控提供了可能性,在小体积内进行这样的实验还有助于保持合适的浓度、较短的传质时间、较快的时间响应和长时间的动态追踪。
微流控芯片发展的一个重要方面就是要从生物学家的角度制造和发明为他们所乐于接受和易于使用的芯片装置。威斯康辛大学的Beebe研究组发明了一种细胞培养芯片,其结构很简单而想法却很巧妙。他们利用微通道两端开口处的表面张力差作为驱动力产生持续的流动,控制细胞和相应的溶液(图 3A),还可以利用芯片管道中的层流效应来处理管道中的部分细胞[11]。该芯片可以与移液器一起配合进行高通量的细胞培养和实验,更易于被生物学家接受和采用。
Quake等人则将微生物培养恒化器集成在微流控芯片上,对大肠杆菌的恒化培养中所需的关键步骤,如洗涤、注入、恒化培养、循环泵流等,都能够实现自动化(图 3B)。在应用该装置研究大肠杆菌的基因反馈回路的恒化培养时,他们发现该装置能够维持几百个大肠杆菌的恒化培养长达几天;而通常情况下,在大体积的体系中的反应都会由于杆菌数量较多而增加了基因变异的概率,从而使得菌落很快失去基因的自反馈调节。相对于传统方法,该芯片装置更适合长期进行的细菌恒化培养研究,而且具有单细胞水平的分辨率[12]。

图3 表面张力驱动的高通量细胞培养微流控芯片和用于微生物恒化培养的微流控生物反应控制体系[11-12] (A) 表面张力驱动液流示意图,192通道阵列细胞培养芯片照片以及其中一个管道在连续培养3T3-L1细胞5天之后照片;(B) 微生物微流控芯片恒化培养反应装置,芯片实物图和芯片结构照片。
细胞内组分复杂,胞内特定组分或内涵物的分析测定对研究细胞代谢过程、细胞内信号转导以及细胞功能具有重要意义。微流控芯片有可能将各种细胞操作技术与电泳过程集成为一体,是实现细胞内(特别是单个细胞内)组分分析的重要技术平台;特别是在其中还可以结合多层芯片的集成技术加工微泵、微阀、微腔室进行单细胞的操作和分析。斯坦福大学的Zare研究组设计制作了一种多功能集成的单细胞分析芯片,实现了对单个T淋巴瘤细胞内氨基酸的测定[13]。该芯片将单个细胞的操纵、化学试剂定量运输、细胞裂解、胞内氨基酸荧光标记和电泳分离等功能单元集成在一块芯片上,并通过调节控制“全开”、“半开”和“全关”功能的三相阀来控制液体的运输,整个反应池体积很小(约70pL),试剂消耗大大减少,单细胞内涵物的稀释被大大地降低。结果显示,单细胞内氨基酸电泳分离效果较好,并与群体细胞的胞内氨基酸电泳结果做了比较。该课题组在随后的研究中进一步发展了这种方法(图4A),在芯片中全集成了单细胞的分离、操作、细胞裂解、荧光标记等功能单元,在管道下游用聚焦成线状的激光来激发单个分子的荧光并通过高灵敏度的CCD进行收集,计数并分析了单个细胞内极低拷贝数的蛋白质β2AR。该方法可以对单个细胞中少于1000个的蛋白质分子进行计数,同时通过校正消除PDMS材料自发荧光的影响[14],这一方法对单个细胞的研究提供了一个很可行的思路。
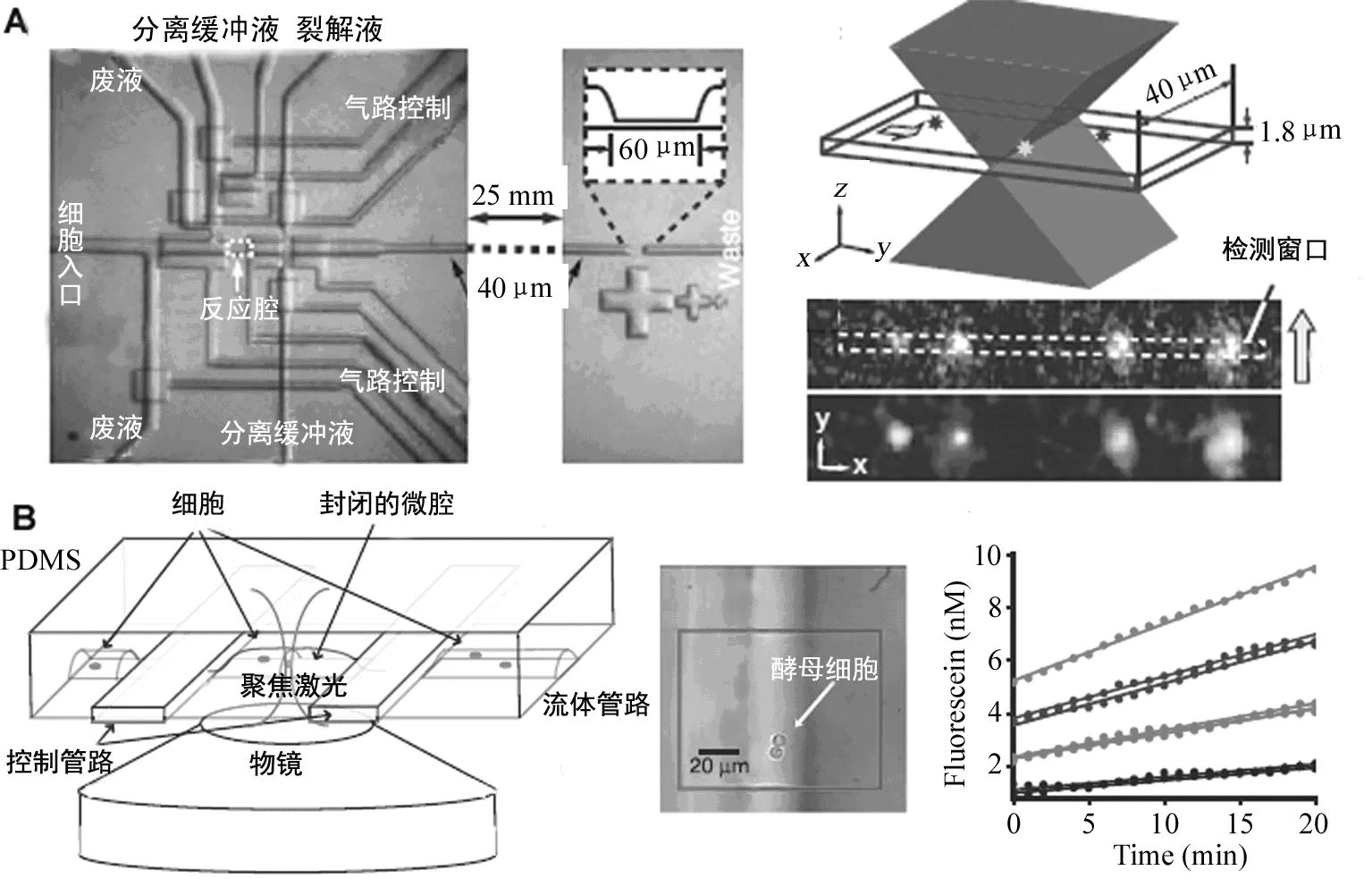
图4 用于单细胞中低丰度蛋白计数的微流控芯片装置和单细胞中随机蛋白表达的单分子荧光分析芯片[14-15](A) 用于单细胞操纵与低拷贝蛋白计数的微流控芯片(左侧)以及分子技术微管道(居中),物镜聚焦的激发光位置示意图和CCD分子荧光成像的照片(右侧);(B) 用于研究单细胞中蛋白随机表达的芯片结构示意图(左图),酵母细胞被固定限制在芯片的微管道中,封闭微管道中的荧光素浓度随时间变化曲线。
细胞是极为复杂的体系,在细胞中的随机生物学事件,如随机的蛋白表达,往往在特定的时刻决定细胞功能甚至细胞的命运。传统的生物学方法缺乏很好的手段来研究细胞中的随机过程。哈佛大学的谢晓亮研究组利用微流控芯片技术结合β-半乳糖苷酶基因作为报告基因,应用单分子荧光技术将单个酵母和大肠杆菌细胞封闭在微流控芯片的微培养腔室中,研究了单个细胞中蛋白表达的随机性(图 4B)。芯片封闭了单个细菌细胞的微环境,既可使β-半乳糖苷酶催化生成的荧光产物迅速地被泵到细胞外,也可以很快在微腔室中积累到足以被检测的浓度[15]。因此芯片上的实验从技术上弥补了传统方法的不足,使人们可以更容易在单分子水平上观察到原先传统方法难以观察的生物学现象和事件。
要从根本上研究细胞生物学,最直接的方法就是对单细胞的基因进行测序和分析,甚至是在给定的环境、给定的时间点进行全基因组的分析,这就要求对单细胞的mRNA通过逆转录合成cDNA,然后PCR扩增将低丰度的基因信号放大。Quake研究组应用他们发展的多层芯片制作技术为这一目标提供了一种基本的方法,他们通过大规模集成微阀、微泵和微腔室,在PDMS芯片中全集成了从单细胞分选到mRNA逆转录成cDNA,并分析了基因表型[16]。
2.3 微流控芯片用于生物医学诊断的研究
随着微流控芯片技术的日臻成熟,人们希望微流控芯片能够走出实验室,真正进入到应用领域并对人们的日常生活产生真正的影响,生物医学诊断无疑是微流控芯片最为适合也是最具有潜力的应用领域。

图5 芯片中快速合成放射性诊断辅助药物[18F]FDG[17](A) 合成路线图及芯片结构示意图;(B) 芯片实物图;(C) 芯片中快速制备的[18F]FDG纯度分析;(D) 芯片中快速制备的[18F]FDG注射小鼠后的PET成像结果。
经典的化学合成通常在烧瓶、烧杯等较大体积容器中进行,而有些反应产物由于其自身寿命的限制,需要人们更快地合成制备所需的产物,比如在临床诊断特别是癌症诊断和治疗监测中重要的医学成像技术正电子发射断层扫描(positron emission tomography,PET)诊断中,重要的放射性显像药物18氟-2-脱氧葡萄糖(2-deoxy-2-[18F]fluoro-D-glucose,[18F]FDG)的常规合成需要训练有素的工作人员使用特有的设备并花费几十分钟的工作时间。但是该化合物的半衰期却只有110分钟,这在很大程度上限制了这一技术的临床应用。美国加州理工学院和加州大学洛杉矶分校的科学家利用在微流控芯片中集成大量微阀、微泵,将[18F]FDG合成中的氟化物富集、脱水、标记、脱乙腈、水解5步反应高度集成在微流控芯片上(图5),使该化合物的合成全过程缩短至仅仅14分钟,并将芯片上合成产物直接注射入小鼠体内,利用PET得到肿瘤分布的清晰图像[17]。
弗吉尼亚大学的Landers课题组发明了一种能够直接接受全血作为分析样品的集成微流控芯片,该芯片集成了样品前处理(从全血中实现核酸的固相萃取)、PCR扩增和核酸电泳分析3个功能区域,各个区域之间以微阀分隔开来,最大程度地避免了上游操作对下游分析的污染。为了展示这种“样品进-结果出”(sample-in-answer-out)的全集成式微流控芯片的分析能力,作者检测了750nL被炭疽病毒感染的小鼠全血中的炭疽病毒DNA,并且仅用1μL鼻腔提取液确诊了一名患者体中的百日咳病毒,全部分析过程只用了不到30分钟[18]。
美国哈佛医学院的Toner课题组最近在微流控芯片上实现了从未经任何处理的全血中分离出循环肿瘤细胞(circulating tumor cell)[19]。该芯片采用硅作为基片,加工出了密集的微立柱,用表面化学的方法在硅基片上修饰了肿瘤细胞抗体EpCAM,当全血流经芯片时,由于细胞与基底的结合力,循环肿瘤细胞被从全血中分离出来以便进一步检测。他们用该芯片成功地从117例患有前列腺癌、乳腺癌、肺癌、胰腺癌、结肠癌的患者的全血中分离检测到了116例样品中的循环肿瘤细胞,检出率达到99%。

图6 微流控芯片装置用于活力精子细胞的分选[20](A) 实验显微观察图,活力精子穿过原有流层;(B) 实验原理示意图。
密西根大学的Takayama实验室提出了一种在微流控芯片上简单分离有活力的精子的方法(图6)[20]。该方法利用微通道中流体所特有的层流的性质,在Y形分叉的一个分支中加入精子样品,在另一个分支中添加缓冲溶液。由于层流作用的存在,这两股流体在通过合并管道后,除了少量扩散外不会有其他因素促进混合,因此绝大多数没有活力的精子细胞会平直地流出,而有活力的精子由于自身的游动会从原有的流层中游出,“主动扩散”到相邻的缓冲液层。该芯片构造极为简单,无须外界注射泵等外源能量的介入,利用表面张力和重力将待测样品从入口一端泵到出口,而有活力的精子在侧边的一个出口得以有效地富集。
3 结论
微流控芯片技术作为一种新兴的技术手段,尽管只经历了短短20年的发展,已经从最初单纯的毛细管电泳的微型化技术演变成为一种涵盖了从基础生物技术到生物医学诊断等各个领域的富有活力的工具性方法平台。随着微流芯片技术和科技的不断发展,相信在不久的将来,微流控芯片技术与其他的代表性技术会在更为广泛的研究领域中交叉渗透,快速发展,而且也会更加直接地深入到人们的日常生活甚至平常使用的器件当中,真正实现“μ-fluidic inside”。当前微流控芯片技术的发展处于理性的发展阶段,既没有了20世纪90年代领域兴起时的过度乐观,也彻底摆脱了10年前这一领域发展的低谷期。从近年来微流控技术的发展和应用实例上可以推测,这一技术今后的发展将集中在大规模、高通量、低消耗的生命科学和分析化学实验中,包括单细胞培养与分析、干细胞操控与培养、单分子生物物理学、高通量的细胞与分子生物学筛选实验、药物发现、高通量合成生物学、高通量测序技术、单细胞基因组学等领域都将大大受惠于微流控的实验平台。在今后的发展中,微流控技术不可避免地会持续面临一些挑战和受到芯片形式局限性的制约,特别是如何在保证实验可靠性和平行性的前提下提高芯片操控的简便性、解决芯片与外界连接的损耗过大问题、在简化芯片复杂度的同时提高实验通量、实现芯片上成熟分析化学手段的高效移植、发展更加有效的芯片观察手段等方面的进步与突破,将成为推动微流控技术应用进一步发展的重要动力。
参 考 文 献
[1] Whitesides G M.Nature,2006,442:368
[2] Terry S C.A Gas Chromatographic Air Analyser Fabricated on Silicon Wafer Using Integrated Circuit Technology.Doctor Dissertation,Stanford University,1975
[3] Manz A,Graber N,Widmer H M.SensorActuatB-Chem,1990,1:244
[4] Harrison D J,Fluri K,Seiler K,etal.Science,1993,261:895
[5] Duffy D C,McDonald J C,Schueller O J A,etal.AnalChem,1998,70:4974
[6] Unger M A,Chou H P,Thorsen T,etal.Science,2000,288:113
[7] Thorsen T,Maerkl S J,Quake S R.Science,2002,298:580
[8] Paegel B M,Emrich C A,Weyemayer G J,etal.PNatlAcadSciUSA,2002,99:574
[9] Zheng B,Tice J D,Roach L S,etal.AngewChemIntEd,2004,43:2508
[10] Hansen C L,Sommer M O A,Quake S R.PNatlAcadSciUSA,2004,101:14431
[11] Meyvantsson I,Warrick J W,Hayes S,etal.LabChip,2008,8:717
[12] Balagadde F K,You L C,Hansen C L,etal.Science,2005,309:137
[13] Wu H K,Wheeler A,Zare R N.PNatlAcadSciUSA,2004,101:12809
[14] Huang B,Wu H K,Bhaya D,etal.Science,2007,315:81
[15] Cai L,Friedman N,Xie X S.Nature,2006,440:358
[16] Marcus J S,Anderson W F,Quake S R.AnalChem,2006,78:3084
[17] Lee C C,Sui G D,Elizarov A,etal.Science,2005,310:1793
[18] Easley C J,Karlinsey J M,Bienvenue J M,etal.PNatlAcadSciUSA,2006,103:19272
[19] Nagrath S,Sequist L V,Maheswaran S,etal.Nature,2007,450:1235
[20] Cho B S,Schuster T G,Zhu X Y,etal.AnalChem,2003,75:1671

