三聚氰胺在大菱鲆体内的代谢消除规律研究
邢丽红, 孙伟红, 苗钧魁, 谭志军, 翟毓秀, 冷凯良
(中国水产科学研究院 黄海水产研究所, 山东 青岛 266071)
三聚氰胺在大菱鲆体内的代谢消除规律研究
邢丽红, 孙伟红, 苗钧魁, 谭志军, 翟毓秀, 冷凯良
(中国水产科学研究院 黄海水产研究所, 山东 青岛 266071)
采用LC-MS/MS法研究三聚氰胺在大菱鲆(Scophthalmus maximus)体内的代谢消除规律。三聚氰胺以5 g/kg浓度添加到饲料中, 连续投喂大菱鲆30 d, 停药后, 对大菱鲆肌肉、肝脏、肾脏组织残留的三聚氰胺进行测定。结果表明: 三聚氰胺能够在大菱鲆肌肉、肝脏、肾脏各组织中富集并消除, 最高血药浓度由高到低依次为Cmax肝脏>Cmax肾脏>Cmax肌肉, 药时曲线下面积 AUC肝脏>AUC肾脏>AUC肌肉, 三聚氰胺在肾脏中消除最快, 肝脏次之, 肌肉最慢。停止给药30 d后, 肌肉中三聚氰胺的含量降至检出限以下。建议在本实验条件下, 三聚氰胺在肌肉中的代谢周期为40 d。
大菱鲆(Scophthalmus maximus); 三聚氰胺; 代谢; 消除
2007年 3月以来, 美国相继发生多起猫狗死亡事件, 美国食品药品管理局(FDA)调查发现, 宠物食品使用的小麦蛋白粉和大米蛋白粉中含有的三聚氰胺是导致宠物致死的原因, 2008年9月国内继而又发生了三鹿奶粉事件, 引起了国内外对三聚氰胺的高度关注。
三聚氰胺简称三胺, 是一种重要的氮杂环有机化工原料, 其结构中含有多个氨基氮, 添加到动、植物蛋白制品中可以提高表观氮含量或以凯氏定氮法所测的蛋白质含量。关于三聚氰胺的检测方法, 目前主要有气相色谱法[1]、气相色谱-质谱法[2-3]、高效液相色谱法[4-5]和液相色谱-串联质谱法[6-9]。液相色谱串联质谱法不但具有较高的灵敏度, 又不需要衍生,操作较简便, 可作为理想的确证方法而得到广泛应用。
关于三聚氰胺的研究, 在检测方法、药理毒理学方面均有相关报道[10-13], 目前已有三聚氰胺在鸡、鸡蛋和猪体内的代谢消除规律研究[14-16], 但三聚氰胺在水生生物体内的药代动力学方面的报道却很少。本文通过在饲料中添加一定浓度的三聚氰胺, 采用液相色谱-串联质谱法测定三聚氰胺的残留量, 研究其在大菱鲆体内的代谢过程, 为防范三聚氰胺残留提供理论依据。
1 材料与方法
1.1 药品与试剂
三聚氰胺标准品(纯度≥99.5%, 美国 Sigma 公司); 氘代三聚氰胺(100 μg/mL, 美国 Sigma公司);三聚氰胺原药、三氯乙酸、氨水、乙酸铵(均为分析纯); 二氯甲烷、乙腈、甲醇(均为分析纯); Oasis MCX固相萃取柱(60 mg, 3 mL)。
1.2 仪器
Thermo TSQ Quantum Access 液相色谱-串联质谱仪, 高速离心机, 超声波清洗仪, 氮吹仪, 固相萃取装置, 旋涡振荡器等。
1.2.1 液相色谱条件
色谱柱: CAPCELL PAK CR (2.0 ×150 mm, SCX:C18=1 : 4, 5 μm); 进样量: 10 µL; 柱温: 室温; 流动相: 20 mmol/L乙酸铵: 乙腈=1 : 1(V/V), 用乙酸调至pH=3.0; 流速: 0.2 mL/min。
1.2.2 质谱条件
离子化模式: 大气压电喷雾离子源(ESI), 正离子模式; 喷雾电压: 4 500 V; 鞘气压力: 12 L/min; 辅助气流量: 2 L/min; 离子传输毛细管温度: 350 ℃;源内碰撞诱导解离电压: 6 V; 扫描模式: 选择反应监测(SRM), 选择反应监测母离子、子离子和碰撞能量见表1。Q1半峰宽: 0.7 Da; Q3半峰宽: 0.7 Da; 碰撞气压力: 氩气, 1.5 mTorr。

表1 三聚氰胺的质谱条件Tab. 1 ESI MS/MS set up for melamine analysis
1.3 试验动物
健康大菱鲆(Scophthalmus maximus), 平均体质量 0.05 kg, 试验前检测表明大菱鲆各组织中无三聚氰胺残留。试验前将大菱鲆暂养于清洁、充气和循环海水的养殖桶内, 试验期间温度控制在16℃±3 ℃,每日投喂新鲜、不含任何药物的饲料。
1.4 三聚氰胺药代动力学和残留实验给药方法
实验前将大菱鲆随机分为对照组和实验组两组,分别编号、称质量记录。实验组三聚氰胺的添加浓度为5 g/kg, 称取适量三聚氰胺, 将其和粉末状饲料充分搅拌均匀, 再制成含三聚氰胺的颗粒饲料。然后将药物饲料连续投喂 30 d, 进行三聚氰胺的富集实验, 之后改投不含三聚氰胺的饲料, 连续投喂 40 d,进行三聚氰胺的消除实验。在消除实验阶段, 分别在第 0、2、6、12 h 和 1、2、4、6、9、12、16、20、25、30、35、40 d, 实验组各采样点取6尾大菱鲆, 取其肌肉、肝脏、肾脏, 提取残留的三聚氰胺进行测定。
1.5 三聚氰胺的提取
1.5.1 制样
取大菱鲆肌肉、肝脏、肾脏组织, 切成不大于0.5 cm × 0.5 cm × 0.5 cm 的小块, 充分匀浆, 备用。
1.5.2 提取
准确称取肌肉2 g(精确到0.01 g), 加入10 mg/L三聚氰胺内标100 μL, 加入20 mL1%三氯乙酸, 充分涡旋混合均匀, 超声20 min, 10 000 r/min离心5 min, 将上清液过滤。取10 mL过滤后的上清液, 待净化。
分别准确称取肝脏、肾脏1 g(精确到0.01 g), 加入10 mg/L三聚氰胺内标50 μL, 加入5 mL1%三氯乙酸, 5 mL乙腈, 充分涡旋混合均匀, 超声20 min,10 000 r/min离心5 min, 取上清液于50 mL另一具塞离心管中, 加入15 mL二氯甲烷, 涡旋1 min, 5 ℃下以不低于8 000 r/min离心5 min。将上清液全部转移到15 mL离心管中, 加入3 mL水于二氯甲烷层中,涡漩1 min, 离心, 5 ℃下以不低于8 000 r/min离心5min。将上清液合并于上述 15 mL离心管中, 涡旋混匀, 待净化。
1.5.3 净化
将MCX固相萃取柱预先用5 mL甲醇和5 mL水活化, 将1.5.2上清液过柱, 依次用3 mL水、3 mL甲醇淋洗, 抽至近干后, 用 6 mL 5%氨化甲醇洗脱,整个萃取过程流速保持每秒一滴。收集洗脱液于 10 mL离心管, 50 ℃下砂浴氮气吹干。残留物用1 mL流动相定容, 涡旋混合, 过 0.2 μm有机相微孔滤膜后, 进LC-MS/MS分析。
1.6 工作曲线制备
准确称取三聚氰胺标准品 0.01 g, 用乙腈溶解并定容至10 mL, 配成1 g/L母液。将0.1 g/L氘代三聚氰胺内标储备液用 50%乙腈水溶液稀释 0.01 g/L中间液。将1 g/L母液三聚氰胺和氘代三聚氰胺内标溶液用 50%乙腈水溶液稀释成三聚氰胺的浓度分别为 0.02、0.05、0.1、0.2、0.5、1、2 mg/L, 氘代三聚氰胺内标浓度为 0.5 mg/L的标准工作溶液, 进行LC-MS/MS测定。
1.7 回收率和精密度实验
在空白大菱鲆肌肉、肝脏、肾脏中分别按照0.1、0.5、1.0 mg/kg的添加水平进行添加回收率实验, 样品前处理按照1.5进行, 每个添加水平6个重复。
1.8 数据处理方法
采用DNS 2.0数据分析软件对三种组织中三聚氰胺药物浓度进行统计处理。
2 结果与讨论
2.1 线性范围和最低检出限
三聚氰胺标准溶液在0.02 ~2 mg/L浓度范围内,线性关系良好, 相关系数大于 0.99, 该方法的最低检出限为0.02 mg/kg。
2.2 回收率与精密度
在本实验条件下, 以0.1、0.5和1.0 mg/kg 三个水平分别测定在肌肉、肝脏和肾脏中的回收率(表2)。三个组织中的回收率在(84.6±7.4)%~(92.1±8.1)%之间, 相对标准偏差均小于15%。

表2 大菱鲆各组织回收率数据表(n=6)Tab. 2 Recoveries of melamine for muscle, liver and kidney (n=6)
2.3 三聚氰胺在大菱鲆体内的药-时曲线(Ci-Ti)图
大菱鲆连续投喂三聚氰胺药饵停药后, 采用LC-MS/MS法测定各组织中三聚氰胺的含量, 其肌肉、肝脏、肾脏中的三聚氰胺的残留量随时间变化的药-时曲线图见图1。

图1 三聚氰胺在各组织中的药-时曲线图Fig. 1 The drug concentration-time curves of melamine in muscle, liver and kidney
2.4 三聚氰胺的主要药动学参数
DAS 2.0程序可自动计算出药代动力学参数。表3给出了以5 g/kg浓度在饲料中添加三聚氰胺投喂大菱鲆30 d, 停药后三聚氰胺的药动学参数。
2.5 三聚氰胺的富集和代谢
通过前期三聚氰胺在大菱鲆体内的富集实验发现, 以5 g/kg添加浓度将三聚氰胺添加到饲料中, 三聚氰胺可以富集到大菱鲆体内, 但不同组织对三聚氰胺的富集能力不同, 肌肉、肝脏、肾脏中的三聚氰胺含量随时间的延长而增大。富集30 d后, 改投不含三聚氰胺的饲料, 各组织中药物浓度很快降低,由此表明, 各组织吸收的药物通过代谢途径减少。
通过在饲料中添加三聚氰胺的方式投喂大菱鲆,停药后, 各组织中三聚氰胺的含量均较高, 且在各组织中的最高血药浓度由高到低依次为Cmax肝脏>Cmax肾脏>Cmax肌肉。三聚氰胺在各组织中的含量相差很大, 在肌肉中的浓度远低于肝脏和肾脏中的浓度,肝脏中Cmax是肌肉中的十多倍, 肾脏中的Cmax是肌肉中的大约 5倍。余晓华等[14]在研究鸡体内三聚氰胺的残留及代谢规律时, 测定了肾脏、鸡肺、肝脏,鸡胸肉、鸡心、鸡油组织, 结果发现, 三聚氰胺在肾脏中的残留量最高, 高于其在肝脏中的残留量。而在猪体内三聚氰胺的残留也表现出相似的规律, 即肾脏中残留量最高[16], 与本实验结果有些差异。
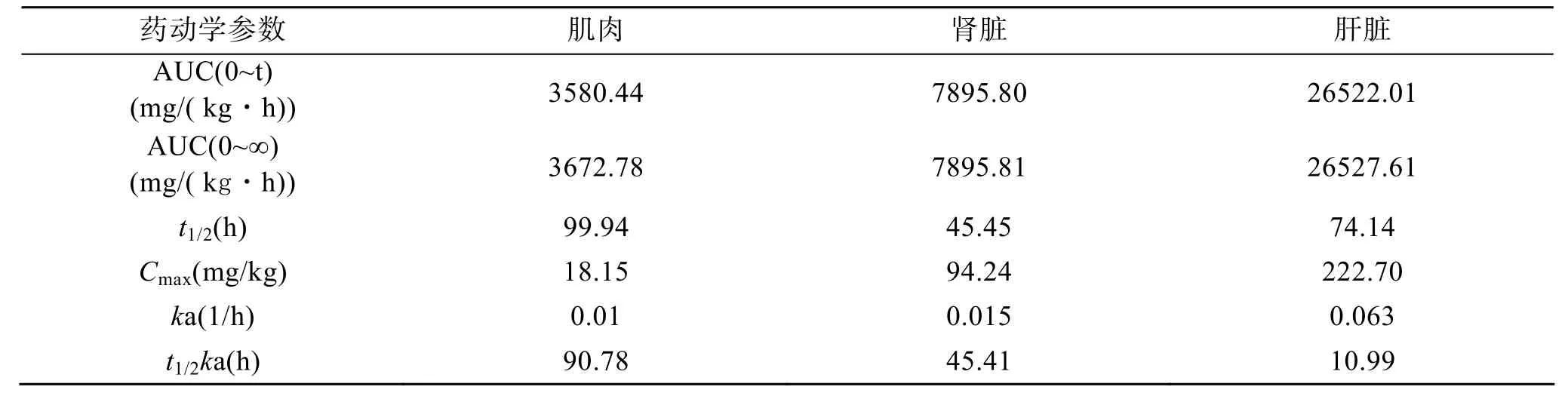
表3 三聚氰胺的主要药动学参数(n=6)Tab. 3 The pharmacokinetic parameters of melamin in various tuibot tissues of (n=6)
药时曲线下面积(AUC)反应药物进入循环系统药量的多少, 是一个衡量药物在鱼体内各组织器官的吸收的重要指标。三聚氰胺在大菱鲆三个组织中AUC 由高到低依次为(表 3): AUC肝脏>AUC肾脏>AUC肌肉。在相同给药剂量条件下, 各组织的AUC差别很大, 说明组织不同, 对药物的蓄积能力有很大差别。肝脏的AUC大约是肾脏的3倍, 是肌肉的7倍, 说明肝脏对三聚氰胺的蓄积能力较强, 吸收后的药物大部分蓄积在肝脏组织, 之后缓慢释放到肌肉、血液等其他组织。
消除相半衰期(t1/2)反映了药物在机体内的消除速度, 指血药浓度消除到一半所用的时间, 是药动学的一个重要参数。不同组织间的t1/2差异较大, 三聚氰胺在大菱鲆肌肉中的消除半衰期为 4.2 d, 在肾脏中的消除半衰期为 1.9 d, 在肝脏中的消除半衰期为 3.1 d, 可见不同组织间的三聚氰胺t1/2差异较大(表 3), 在肾脏中消除最快, 肝脏次之, 肌肉最慢。Mast等[10]对成年雄性Fischer 344大鼠研究表明, 三聚氰胺在大鼠体内经过第一个24 h后, 约90%以原形形式从尿中排出, 血浆消除半衰期约 2.7 h, 尿中消除半衰期约 3 h, 二者接近。用含三聚氰胺 200 mg/kg和1 000 mg/kg的饲料投喂蛋鸡, 5 d后代谢均较快, 停药 20 d后各组织中均未检出三聚氰胺残留[14]。用含三聚氰胺2.5、100和500 mg/kg的饲料饲喂猪, 食用组织中残留物需要停药10 d后才能降至0.5 mg/kg以下[16]。三聚氰胺在大菱鲆体内消除速率低于在哺乳动物体内的消除速率, 这可能与它们长期所处的较低的环境温度有关。研究表明, 在一定温度范围内, 药物的代谢强度与水温成正比, 水温越高, 代谢速度越快, 温度变化 1℃, 药物代谢速度变化10%[17]。
2.6 代谢周期
目前我国、欧盟、澳大利亚、新西兰、加拿大等均规定婴幼儿配方乳粉中三聚氰胺的最大限量值为 1 mg/kg, 液态奶(包括原料乳)、奶粉、其他配方乳粉中三聚氰胺的最大限量值为 2.5 mg/kg, 含乳15%以上的其他食品中三聚氰胺的最大限量值为2.5 mg/kg。三聚氰胺在饲料中的最大残留限量为 2 mg/kg。三聚氰胺在水生生物体内的残留限量还没有规定。对大菱鲆投喂三聚氰胺饲料30 d后研究其代谢情况, 三聚氰胺在大菱鲆肌肉中的残留量30 d后降至检测限以下, 由于肌肉是可食性组织, 为确保食品安全系数更高一些, 建议在此实验条件下, 三聚氰胺在肌肉中的代谢周期为40 d。
[1] 辛若竹, 丁梅, 张新杰, 等.气相色谱法测定乳品中三聚氰胺含量的研究[J].中国卫生检验杂志, 2009,19(3): 485-487.
[2] 王征. GC-MS法测定动物食品中的三聚氰胺[J]. 福建分析测试, 2008, 17(2): 1-4.
[3] Jonathan J L, Gregory E M, Kevin J M. GC-MS Screen for the Presence of Melamine, Ammeline, Ammelide,and Cyanuric Acid[J]. Laboratory Information Bulletin,2008, 24: 4 423-4 424.
[4] 汪辉、曹小彦, 彭新凯, 等. 高效液相色谱-二极管阵列法测定高蛋白食品中的三聚氰胺[J]. 食品与机械,2007, 23(5): 114-115, 124.
[5] 丁涛, 徐锦忠, 李健忠, 等. 高效液相色谱-二极管阵列检测法及高效液相色谱-电喷雾串联质谱法测定植物源性蛋白中残留的三聚氰胺[J]. 色谱, 2008, 26(1):6-9.
[6] 蔡勤仁, 欧阳颖瑜, 前贞洁, 等. 超高相液相色谱-电喷雾串联质谱法测定饲料中残留的三聚氰胺[J]. 色谱, 2008, 26(3): 339-342.
[7] Wendy C A, Sherri B T, Christine M K, et al. Determination of Melamine Residues in Catfish Tissue by Triple Quadrupole LC-MS-MS with HILIC Chromatography[J]. Laboratory Information Bulletin, 2007, 23:4 396-4 404.
[8] 刘梅, 李金强, 田德金, 等. 固相萃取-液相色谱-串联质谱法检测食品中的三聚氰胺[J]. 化学分析计量,2008, 17(2): 48-50.
[9] 王浩, 刘艳琴, 曹红, 等. 固相萃取与高效液相色谱联用测定宠物食品中三聚氰胺[J]. 分析化学, 2008,36(2): 273.
[10] Mast R W, Jeffcoat A R, Sadler B M, et al. Metabolism,disposition and excretion of [14C]melamine in male Fischer 344 rats[J]. Food Chem Toxicol, 1983, 21(6):807-810.
[11] 盛夏冰, 罗超, 李俐桦, 等. 三聚氰胺的毒性及其检测方法[J]. 饲料博览(技术版), 2009, 7: 27-28.
[12] 刘海燕, 张伟, 薛敏, 等. 三聚氰胺对吉富罗非鱼的急性毒性研究[J]. 河北师范大学学报(自然科学版),2009, 33(5): 559-665.
[13] 李友杰, 赵术燕, 王延华, 等. 动物性食品中三聚氰胺残留的危害及其检测技术研究进展[J]. 农产品加工(创新版), 2009, 8: 48-52.
[14] 余晓华, 孙泽祥, 吕燕, 等. GC/MS法研究鸡体内三聚氰胺的残留及代谢规律[J]. 浙江农业大学学报,2009, 21(4): 379-384.
[15] 吕燕, 孙泽祥, 杨挺, 等. 鸡蛋中三聚氰胺检测方法与残留消除规律研究[J]. 宁波农业科技, 2009, 3: 2-4.
[16] 孙泽祥, 杨挺, 鲍伟华, 等. 猪鸡体内三聚氰胺残留与代谢规律研究[J]. 兽医导刊, 2009, 8: 49-50.
[17] Ingebrigtsen K. Factors affecting drug disposition in fish[J]. Acta Vet Scand, 1991, 87: 44-56.
Received: Jan., 06, 2010
Key words:turbot; melamine; metabolism; elimination
Abstract:We studied the metabolism and elimination of melamine in turbots. The melamine was fed to turbot at 5 mg/kg, and the melamine retained in muscle, liver and kidney was determined. The results indicate that melamine can be accumulated and eliminated in turbot muscle, liver, and kidney. The order of maximum residues of melamine from high to low wasCmaxliver>Cmaxkidney>Cmaxmuscle, while the area under the curve was AUCliver>AUCkidney>AUCmuscle. The elimination speed of melamine in various tissues followed the order of kidney > muscle > liver.Thirty days post the feeding of melamine, the melamine level in muscle was below the detection limit.
(本文编辑:康亦兼)
Metabolism and elimination of melamine in turbot
XING Li-hong, SUN Wei-hong, MIAO Jun-kui, TAN Zhi-jun, ZHAI Yu-xiu, LENG Kai-liang
(Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China)
X171.5
A
1000-3096(2011)01-0066-04
2010-01-06;
2010-06-02
基本科研业务费专项资金项目(2009-CB-02); 国家 863计划项目(2008AA100805)
邢丽红(1981-), 女, 山东青岛人, 主要从事水产品质量安全检测及研究, 电话: 0532-85836348, E-mail: xinglh@ysfri.ac.cn; 冷凯良, 通信作者, E-mail: lengkl@ysfri.ac.cn.

