痛宁胶囊对硝酸甘油型偏头痛大鼠血浆NO和5-HT浓度的影响1)
付秋菊,杨德功,黄厚才,王志国,姚盛名,朱婉华,田耀洲
偏头痛是由于发作性血管舒缩功能障碍以及某些物质暂时性改变所致的一种伴有脑及自主神经系统功能暂时性障碍的头痛[1]。世界卫生组织指出严重的偏头痛将与瘫痪一同位居人类疾病致残率之首,但其发病机制仍不明确,存在多种学说,其中血管学说、神经递质学说仍是各国学者比较公认的学说。研究表明[2],一氧化氮(NO)可引发神经源性炎症,激活伤害感觉神经元的敏感性,介导机体内痛觉信号的传导,从而放大其生物学作用,致使痛觉的发生[3]。另外在偏头痛患者中存在一系列的生化改变,在已进行的所有偏头痛生化研究中,5-羟色胺(5-HT)含量变化最恒定,并具有相对特异性,是公认的在偏头痛发病中起重要作用的神经递质。
为阐明痛宁胶囊治疗偏头痛的作用机制,以硝酸甘油型偏头痛大鼠为研究对象,以血浆NO和5-HT浓度变化为偏头痛发作时的观察指标,研究痛宁胶囊对上述指标的影响。
1 材料与方法
1.1 材料
1.1.1 动物与分组 SD大鼠60只,上海西普尔-必凯实验动物有限公司,许可证号:SCXK(沪):2008-0016,雌雄各半,体重283g±23g。随机分为空白对照组及偏头痛模型对照组、阳性药物对照组及痛宁胶囊药液高、中、低剂量组,每组8只。
1.1.2 主要药物、试剂及仪器 痛宁胶囊,南通良春风湿病医院院内制剂,批准文号:苏药制字Z04001376;产品批号:091208。硝酸甘油注射液,5mg/mL,北京益民药业有限公司生产,批准文号:国药准字 H11020289,生产批号:20100911;琥珀酸舒马普坦片,天津华津制药有限公司,批准文号:国药准字H20040700,生产批号:006909T,用蒸馏水配制成浓度为1 mg/mL的舒马普坦药液备用;NO试剂盒,南京建成生物工程研究所,生产批号:20100726;大鼠5-HT试剂盒,上海江莱生物科技有限公司,LOT:10-05;分光光度计721;全自动酶免分析仪等。
1.2 方法
1.2.1 偏头痛模型建立及药物干预 根据Cristina等[4]方法,除空白对照组不作处理,其余各组动物予以大鼠皮下注射硝酸甘油10mL/kg,制作偏头痛模型。30min后按组灌胃给药。空白对照组和模型对照组灌胃等容积的蒸馏水,阳性药物对照组灌胃琥珀酸舒马普坦药液6mL/kg,研究药物组痛宁胶囊药液高、中、低剂量组分别以8.64g/kg、4.32g/kg、2.16g/kg灌胃。1.2.2 NO、5-HT检测 大鼠造模后4h,予以用10%水合氯醛300mg/kg腹腔麻醉动物,腹主动脉采血约4mL加入肝素锂的真空采血管中,混匀后3 000r/min离心10min,分离血浆,提取上清,于-20℃保存样品。NO以硝酸还原酶法测定其浓度。5-HT采用ELISA法测定。
2 结 果
2.1 各组大鼠血浆NO浓度比较(见表1) 模型对照组大鼠血浆NO浓度较空白对照组显著升高(P<0.01)。阳性药物对照组,痛宁胶囊高、中剂量组均能显著降低血浆NO浓度,与模型对照组比较有统计学意义(P<0.05)。痛宁胶囊高剂量组与阳性药物对照组比较无统计学意义(P>0.05)。
表1 痛宁胶囊对硝酸甘油型偏头痛大鼠NO的影响(±s)
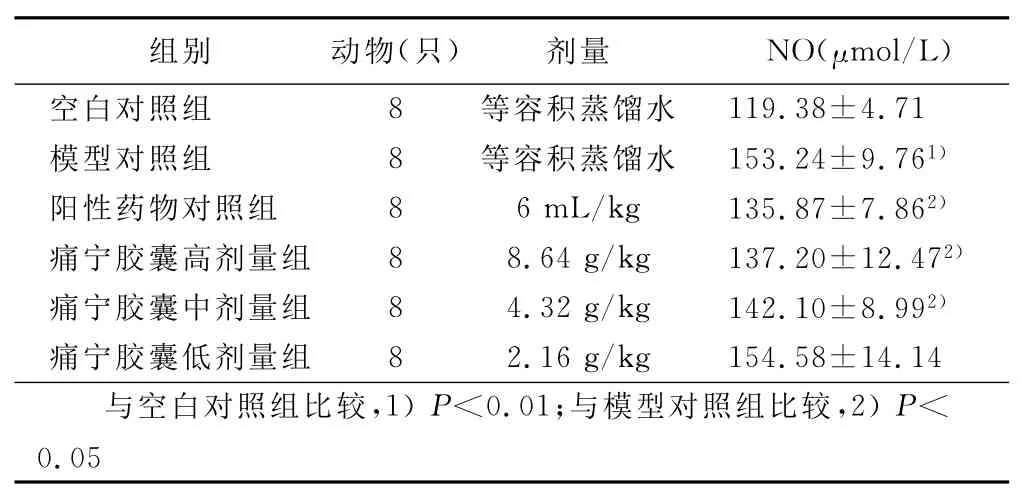
表1 痛宁胶囊对硝酸甘油型偏头痛大鼠NO的影响(±s)
组别 动物(只) 剂量 NO(μmol/L)空白对照组 8 等容积蒸馏水119.38±4.71模型对照组 8 等容积蒸馏水 153.24±9.761)阳性药物对照组 8 6mL/kg 135.87±7.862)痛宁胶囊高剂量组 8 8.64g/kg 137.20±12.472)痛宁胶囊中剂量组 8 4.32g/kg 142.10±8.992)痛宁胶囊低剂量组 8 2.16g/kg 154.58±14.14与空白对照组比较,1)P<0.01;与模型对照组比较,2)P<0.05
2.2 各组大鼠血浆5-HT浓度比较(见表2) 与空白对照组比较,模型对照组大鼠血浆5-HT浓度显著降低(P<0.01)。与模型对照组比较,阳性药物对照组,痛宁胶囊高剂量能显著升高血浆5-HT浓度(P<0.05)。痛宁胶囊高剂量组与阳性药物对照组比较无统计学意义,高剂量痛宁胶囊与舒马普坦升高血浆5-HT浓度作用强度相当。
表2 痛宁胶囊对硝酸甘油偏头痛大鼠5-HT浓度的影响(±s)

表2 痛宁胶囊对硝酸甘油偏头痛大鼠5-HT浓度的影响(±s)
组别 动物(只) 剂量 5-HT(ng/mL)空白对照组 8 等容积蒸馏水83.6±2.5模型对照组 8 等容积蒸馏水 39.4±1.71)阳性药物对照组 8 6mL/kg 58.7±2.02)痛宁胶囊高剂量组 8 8.64g/kg 56.3±2.42)痛宁胶囊中剂量组 8 4.32g/kg 42.0±2.0痛宁胶囊低剂量组 8 2.16g/kg 40.5±1.3与空白对照组比较,1)P<0.01;与模型对照组比较,2)P<0.05
3 讨 论
本实验所选造模方法简单、经济、机制单一,可在短期内复制[5]。该模型具有表面效度,能够在活体清醒状态下观察大鼠的行为学特征,可用于中药治疗作用的研究[6]。
舒马普坦作为经典的抗偏头痛药物,通过激动5-HT1B/1D受体发挥其药理作用,是目前已知具有确切作用机制的治疗偏头痛药物[7]。
偏头痛发作期间,发现全血中硝酸盐类升高[8],而近年来使用NOS抑制剂(L-NMMA)能够有效治疗偏头痛、紧张型头痛以及丛集性头痛[9],更加证实NO在偏头痛和其他头痛产生中是一个十分关键的因子[10]。如激活NO引发偏头痛的可能机制是:通过扩张脑及脑以外的血管,或直接作用于血管周围感觉神经引发头痛[10];调整三叉神经元降钙素相关基因肽(CGRP)基因的表达[11],引起CGRP的释放[12];增强三叉神经脊束核内第一突触中对有害刺激的反应[13];激活NO-环单磷酸鸟苷(cGMP)途径进一步引发瀑布反应[9];通过作用于核转录因子(NF-κB)引 AP-I的亚单位c-fos和junB的表达增加[1],参与机体内痛觉信号的传导,提示NO诱发偏头痛存在一系列的级联反应。
本实验中亦发现模型组大鼠血浆NO浓度升高,可能是硝酸甘油作为NO的前药[9],使得其向NO的转化率升高[1],通过导致脑膜血管扩张、神经源性炎症形成及激活下丘脑、脑干及脊髓节段神经元功能等作用,引起三叉神经纤维的超敏性,诱发头痛[14]。而痛宁胶囊能显著降低硝酸甘油诱导的偏头痛大鼠血浆NO的浓度,提示抑制NO的合成,或者减少其释放,或者加速其分解代谢可能是痛宁胶囊治疗偏头痛的作用机制之一。
5-HT是一种神经递质,可加重偏头痛相关症状[15]。无论是有无先兆的偏头痛患者头痛发作期间中均发现,低血浆5-HT和高5-羟吲哚乙酸(5-HIAA)水平,且在脑脊液亦有5-HIAA的升高,这种水平的改变不仅是血小板功能障碍更主要是脑功能障碍的反应[16]。应用5-HT耗竭药物致低5-HT状态的大鼠皮质扩散抑布波增强,三叉神经血管感受伤害途径的激活[17]。应用单光子发射计算机体层成像技术亦发现,偏头痛发作期间脑干5-羟色胺转运蛋白(5-HTT)的升高,这种改变与突出间隙5-HT水平的下降相吻合[18]。而曲坦类选择性抗偏头痛药物起作用与三叉神经与背根神经节神经元5-HT1B/1D/1F受体表达有关[19]。可进一步导致大脑微血管对NO反应的敏感性增高[20],部分5-HT漏出到血管周围的细胞外液中,与组胺、缓激肽、血管迟缓激肽等神经肽类物质一起使血管壁痛阈降低,并造成动脉的“无菌性炎症”[21]。
本实验就痛宁胶囊对5-HT的浓度是否有影响进行研究,观察到皮下注射硝酸甘油可明显引起偏头痛大鼠血浆5-HT浓度的显著降低,而予以痛宁胶囊干预后,能够显著升高其血浆浓度,提示痛宁胶囊通过升高5-HT的浓度途径治疗偏头痛,而具体通过何种机制升高5-HT,目前尚不清楚,有待进一步的研究。
[1]陈宝田,朱成全,谢炜.头面部疼痛诊断治疗学[M].北京.北京科学技术出版社,2003:70-99.
[2]赵永烈,王玉来,高颖,等.一氧化氮在偏头痛发病中的作用[J].中国临床康复,2006,10(7):138-139.
[3]Jansen-Olesen I,Zhou I,Zinck T,et al.Expression of inducible nitric oxide synthase in trigeminal ganglion cells during culture[J].Basic Clin Pharmacol Toxicol,2005,97(6):355-363.
[4]Tassorelli C,Joseph SA.Systemic nitroglycerin induces Fos immunoreactivity in rat brainsten and for brain structures of the rat[J].Brain Res,1995,682(1-2):167-181.
[5]彭成,任永欣,姚干,等.实验性偏头痛动物模型c-fos、c-jun基因表达[J].中国实验动物学报,2000,8(2):112-119.
[6]章正祥,曹克刚,高永红,等.实验性偏头痛动物模型效度评价与中药新药研究的探讨[J].中医研究,2009,22(2):6-8.
[7]Arulmozhi DK,Veeranjaneyulu A,Bodhankar SL.Migraine:Current concepts and emerging therapies[J].Vascular Pharmacology,2005,43(3):176-187.
[8]Fidan I,Yuksel S,Ymir T,et al.The importance of cytokines,chemokines and nitric oxide in pathophysiology of migraine[J].Neuroimmunology,2006,171(1):184-188.
[9]Jes Olesen.The role of nitric oxide(NO)in migraine,tension-type headache and cluster headache[J]Pharmacology & Therapeutics,2008,120(2):157-171.
[10]Olesen J,Thomsen LL,Lassen LH,et al.The nitricoxide hypothesis of migraine and other vascular headaches[J].Cephalalgia,1995,15(2):94-100.
[11]Bellamy J,Bowen EJ,Russo AF,et al.Nitric oxide regulation of calcitonin gene-related peptide gene expression in rat trigeminal ganglia neurons[J].Eur J Neurosci,2006,23(8):2057-2066.
[12]Glyceroltrinitrate facilitates stimulated CGRP release but not gene expression of CGRP or its receptor components in rat trigeminal ganglia[J].Neuropeptides,2009,43(6):483-489.
[13]Lambert GA,Hoskin KL,Zagami AS.Nitrergic and glutamatergic neuronal mechanisms at the trigeminovascular first-order synapse.[J].Neuropharmacology,2004,47(1):92-105.
[14]郭琳,洪治平.硝酸甘油型实验性偏头痛模型原理与研究现状[J].中国疼痛医学杂志,2004,10(6):357-364.
[15]Drummond PD.Tryptophan depletion increases nausea,headache and photophobia in migraine sufferers[J].Cephalalgia,2006,26(10):1225-1233.
[16]Hamel E.Serotonin and migraine:Biology and clinical implications[J].Cephalalgia,2007(11):1293-1300.
[17]Supornsilpchai W,Sanguanrangsirikul S,Maneesri S,et al.Sero-tonin depletion,cortical spreading depression,and trigeminal nociception[J].Headache,2006,46(1):34-39.
[18]Schuh-Hofer S,Richter M,Geworski L,et al.Increased serotonin transporter availability in the brainstem of migraineurs[J].J Neurol,2007,254(6):789-796.
[19]Classey JD,Bartsch T,Goadsby PG.Distribution of 5-HT1B,5-HT1Dand 5-HT1Freceptor expression in rat trigeminal and dorsal root ganglia neurons:Relevance to the selective anti-migraine effect of triptans[J].Brain Research,2010,1361(18):76-85.
[20]Srikiatkhachorn A,Anuntasethakul T,Maneesri S,et al.Hyposerotonin-induced nitric oxide supersensitivity in the cerebral microcirculation[J].Headache,2007,40(4):267-275.
[21]汪澄川,赵志奇,蒋豪.疼痛的基础与临床[M].上海:复旦大学出版社,2001:405.

