rhIL-17A对人皮肤角质形成细胞和成纤维细胞活性和凋亡的影响
徐 霞, 赖 宽, 郭 庆, 曾凡钦△
(1中山大学孙逸仙纪念医院皮肤科,广东广州510120;2南方医科大学南方医院皮肤科,广东广州510515)
系统性硬皮病是一种以皮肤及内脏器官纤维化或硬化、最后发生萎缩为特点的疾病。系统性硬皮病目前尚无特效治疗方法,患者常死于肺纤维化、肺部感染、肾功能衰竭等。系统性硬皮病的发病机制尚不明确[1]。已有研究报道系统性硬皮病皮肤损害及内脏组织中有白细胞介素17(interleukin-17,IL-17)浸润[2],但 IL-17在系统性硬皮病的发病中具体作用仍不是很清楚。本研究检测了重组人白细胞介素17A(recombinant human interleukin-17A,rhIL-17A)对体外培养人角质形成细胞和成纤维细胞生物学特性的作用,旨在探讨IL-17在系统性硬皮病皮肤损害发病中的作用。
材料和方法
1 材料
角质形成细胞培养液(K-SFM)、DMEM培养基、胎牛血清及0.02%EDTA-0.25%胰蛋白酶购自Gibco;DispaseⅡ购自Sigma;鼠抗人广谱角蛋白单克隆抗体和异硫氰酸荧光素(FITC)标记的兔抗鼠IgG(H+L)、小鼠抗人波形蛋白单克隆抗体、ABC显色试剂盒和生物素化马抗小鼠Ⅱ抗购自博士德公司;CCK-8购自日本同仁化学研究所;rhIL-17A购自R&D;兔抗人NF-κB/p65单克隆抗体、兔抗人 IκBα单克隆抗体和辣根过氧化物酶标记Ⅱ抗购自Cell Signaling;IL-6和TGF-β1的ELISA试剂盒购自华美生物公司。
2 方法
2.1 人角质形成细胞的培养及鉴定
①人角质形成细胞的培养 取环切术后包皮,将所取标本用含1×105U/L氨苄青霉素和100 mg/L链霉素的PBS浸泡15 min。PBS漂洗3次后,用眼科剪去除多余的皮下组织,将皮肤剪成8 mm×3 mm×4 mm小块,再用PBS洗3次,移入1.6×103U/L dispaseⅡ,4℃消化过夜后剥离表皮。将分离的表皮置于0.02%EDTA-0.25%胰蛋白酶中,37℃消化10 min;用含10%FBS的DMEM培养基终止消化;反复吹打后过筛,收集滤液,1 000 r/min离心5 min,弃上清,PBS洗涤1次,K-SFM重悬,调整浓度为1×108cells/L,接种6孔板,置37℃、5%CO2培养箱中进行培养,3~4 d换液1次。
②人角质形成细胞的鉴定 胰酶消化第2代细胞接种于48孔板,于指数生长期进行免疫荧光检测。4%多聚甲醛固定细胞后,1%Triton处理5 min。3%牛血清白蛋白(bovine serum albumin,BSA)37℃封闭30 min,加鼠抗人角蛋白Ⅰ抗,4℃过夜,PBS洗3次,加异硫氰酸荧光素(FITC)标记的兔抗鼠IgG(H+L)Ⅱ抗孵育1 h,DAPI染核5 min,荧光显微镜下观察、计数。随机取5个互不重叠的高倍视野(×200),分别于绿色和蓝色荧光下,计算(胞浆)免疫荧光阳性细胞数和总的细胞数(细胞核数),并根据结果计算阳性细胞占总细胞数的比例,进行纯度评价。
2.2 人成纤维细胞的培养及鉴定
①人成纤维细胞的培养 取环切术后包皮,将所取标本用含1×105U/L氨苄青霉素和100 mg/L链霉素的PBS浸泡15 min。PBS漂洗3次后,剪去脂肪及表皮组织,将组织修剪成1 mm×2 mm×2 mm大小组织块均匀涂布瓶底,缓慢加入少量含10%FBS的DMEM培养液,置37℃、5%CO2培养箱中进行培养,第2 d向瓶内再加少许培养液。
②人成纤维细胞的鉴定 胰酶消化第3代细胞接种于48孔板,以小鼠抗人波形蛋白单克隆抗体为Ⅰ抗,生物素化马抗小鼠为Ⅱ抗,用链霉菌抗生物素蛋白-过氧化物酶连结(SP)法进行细胞免疫组化染色,同时设置用PBS作为Ⅰ抗的阴性对照。细胞胞质中出现棕色颗粒为阳性细胞。
2.3 CCK-8检测 将培养的人角质形成细胞以1 500 cells/well的密度接种至96孔板,24 h后用不含表皮生长因子的K-SFM培养液饥饿培养6 h,处理组加入 rhIL-17A(浓度为 50、100、200、400 μg/L),并设不加rhIL-17A的对照组,每组设3个复孔,继续培养4 d,每孔加入 CCK-8溶液10 μL,37℃孵育30 min,选择450 nm波长,酶联免疫检测仪测定各孔吸光度值。
将培养的人成纤维细胞以1 500 cells/well的密度接种至 96孔板培养 24 h,用含 0.5%FBS的DMEM培养液饥饿培养6 h,处理组加入含rhIL-17A(浓度为 50、100、200、400 μg/L)的 5%FBS-DMEM培养液,并设不加rhIL-17A的对照组,每组设3个复孔,继续培养4 d,每孔加入CCK-8溶液10 μL,37 ℃孵育30 min,选择 450 nm 波长,酶联免疫检测仪测定各孔吸光度值。
2.4 Western blotting检测成纤维细胞NF-κB/p65和IκBα表达量 待常规培养在12孔板中的成纤维细胞生长至60%融合时,随机分成4组,0 μg/L、4 μg/L、40 μg/L 和 400 μg/L 的 rhIL-17A 处理组,培养96 h后进行Western blotting检测。用细胞裂解液提取总蛋白,BCA法测定蛋白浓度。取50 μg总蛋白样品煮沸变性后,SDS-PAGE电泳,随后电转移至硝酸纤维素膜上,将膜放入含有脱脂奶粉的容器中封闭1 h,加入稀释的Ⅰ抗,室温下脱色摇床上4℃振荡过夜。T-BST洗涤后加入Ⅱ抗,室温孵育0.5 h,T-BST漂洗,加入显色底物,曝光X线片,显影,定影,通过ImageJ图像分析系统半定量分析。
2.5 流式细胞术检测细胞凋亡 将浓度为1×108cells/L的人角质形成细胞和浓度为2×108cells/L成纤维细胞分别接种于6孔板内,培养箱培养24 h后,吸尽上清,加入 400 μg/L rhIL-17A,并设不加rhIL-17A的阴性对照。作用4 d后,收集细胞,在PBS中吹匀为单细胞悬液,按Annexin V细胞凋亡检测试剂盒的说明处理细胞,进行 Annexin V-PI标记,上流式细胞仪检测细胞是否存在凋亡及所占比例。
2.6 ELISA法检测成纤维细胞 IL-6和TGF-β1的分泌量 将成纤维细胞以6×104cells/well的密度接种24孔板,24 h后处理组加rhIL-17A(5、50、500 μg/L),同时设置不加 rhIL-17A的对照组,培养4d后收集细胞培养上清,使用ELISA试剂盒检测培养上清液中IL-6和TGF-β1含量。
3 统计学处理
每组实验重复3次,应用统计软件包SPSS 16.0进行统计学分析,数据进行正态分布检验和方差齐性检验,所有数据以均数±标准差(±s)表示,多组数据间比较采用单因素方差分析。
结 果
1 角质形成细胞的原代培养、鉴定及纯度计算
原代培养24 h可见圆形、类椭圆形的细胞贴壁,并呈小集落向周围生长,培养初期出现的少量成纤维细胞逐渐被优势生长的角质形成细胞取代。达80%融合时进行传代培养,传代后细胞生长加快。细胞免疫荧光染色胞浆显示亮绿色荧光,见图1A,角质形成细胞纯度为(96.00+1.28)%。
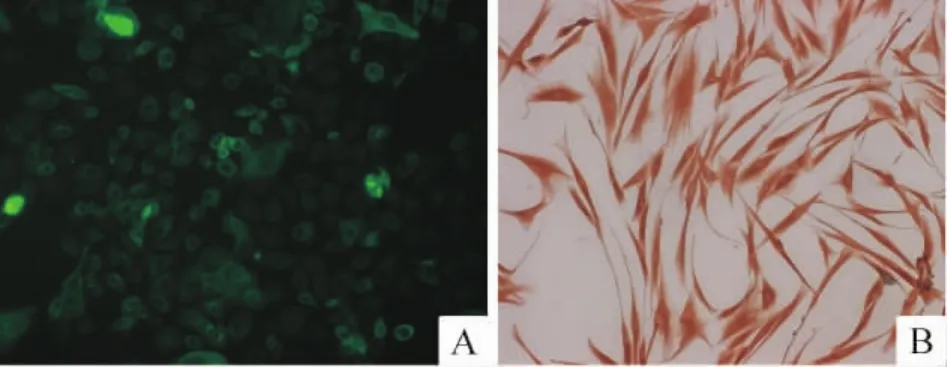
Figure 1.Identification of keratinocytes(A)and fibroblasts(B)(×200).A:keratin detected by immunofluorescence;B:vimentin detected by immunohistochemisty.图1 角质形成细胞和成纤维细胞的鉴定
2 rhIL-17A对体外培养人角质形成细胞活性及凋亡的影响
0、50 、200 、400 μg/L rhIL-17A 处理角质形成细胞后,450 nm波长下检测的吸光度值分别为1.068±0.350、1.025 ±0.175、1.112 ± 0.128、1.047 ±0.209和1.105±0.115,各组之间无显著差异(P>0.05)。400 μg/L rhIL-17A处理组细胞凋亡率为(8.50±0.48)%,与对照组细胞[(7.86±0.60)%]相比无显著差异(P>0.05)。rhIL-17A对体外培养的角质形成细胞的活性与凋亡无明显影响。
3 成纤维细胞的原代培养及鉴定
约第5 d可见培养的组织块周围有棱形、不规则三角形细胞萌出,细胞质向外伸出2-3个长短不同的突起,待细胞融合后,细胞排列紧密,呈放射状、编织状。约9 d细胞长满瓶底,去掉组织块消化细胞进行传代培养。细胞免疫组化染色,胞浆呈棕色染色,见图1B;对照组用PBS代替Ⅰ抗,细胞质未着色。
4 rhIL-17A对体外培养人成纤维细胞活性及凋亡的影响
为了检测rhIL-17A能否诱导成纤维细胞增殖,使用rhIL-17A刺激正常人成纤维细胞,CCK-8检测发现rhIL-17A可以刺激成纤维细胞的增殖,其对成纤维细胞的这种刺激作用随着其浓度的增大而增强。400 μg/L培养4 d后,成纤维细胞活性增至阴性对照的2.3倍,见图2。400 μg/L rhIL-17A处理组细胞凋亡率为(4.29±0.34)%,对照组细胞凋亡率为(3.51±0.43)%,无显著差异(P>0.05)。
5 rhIL-17A对体外培养人成纤维细胞NF-κB/p65和IκBα表达的影响
rhIL-17A作用于成纤维细胞96 h后,NF-κB/p65表达明显高于对照组(0 μg/L),而 IκBα 蛋白的表达较对照组明显减少,呈剂量依赖性,见图3。
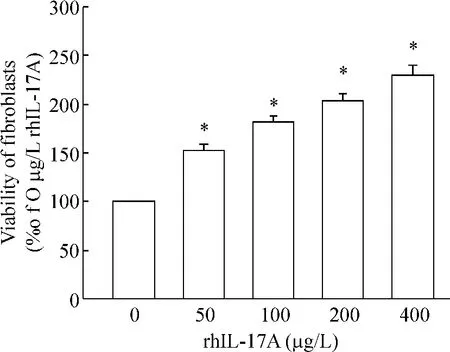
Figure 2.Effect of rhIL-17A on the vialbility of fibroblasts detected by CCK-8/assay.*P <0.05 vs 0 μg/L rhIL-17A.图2 rhIL-17A对成纤维细胞增殖的影响
6 rhIL-17A对体外培养人成纤维细胞分泌IL-6和TGF-β1的影响
ELISA检测发现rhIL-17A作用成纤维细胞后,随着rhIL-17A浓度的增高,IL-6和TGF-β1的分泌量均逐渐增加,见图4。2组与对照组比差别显著(P <0.05)。
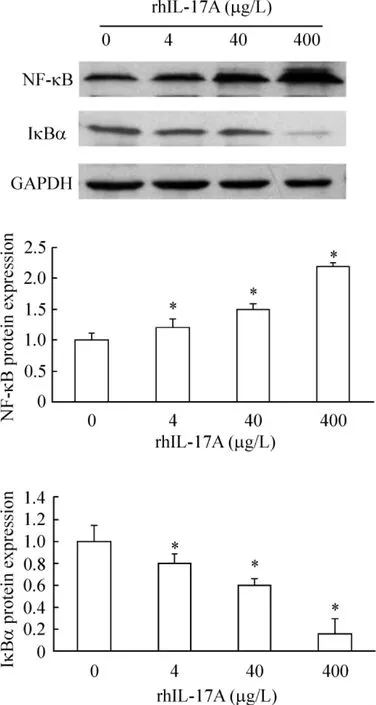
Figure 3.Effect of rhIL-17A on the expression of NF-κB/p65 and IκBα proteins.±s.n=3.*P<0.05 vs 0 μg/L rhIL-17A.图3 rhIL-17A对成纤维细胞NF-κB/p65和IκBα表达的影响
讨 论
尽管系统性硬皮病的发病机制仍不十分清楚,但是免疫学异常在其中起着重要作用已成共识。成纤维细胞持续活化及随之发生的胶原合成增加是病情进展的关键环节[3]。目前,硬皮病中成纤维细胞激活的机制仍不十分清楚。系统性硬皮病患者外周血中Th17细胞比例增高,此外皮肤损害及肺组织中检测到IL-17,均提示IL-17可能在系统性硬皮病的发病中起着重要作用[2]。IL-17A是由一种新型Th细胞亚群——Th17细胞分泌的主要细胞因子,可诱导细胞因子IL-6、IL-8、粒细胞集落刺激因子(granulocyte colony stimulating factor,G-CSF)、粒巨噬细胞集落刺激因子(granulocyte and macrophage colony stimulating factor,GM-CSF)、基质细胞源性因子1(stromal cell-derived factor 1,SDF-1)和金属蛋白酶的产生引起前炎症反应。大量的研究表明IL-17在许多自身免疫性疾病(如类风湿性关节炎、系统性红斑狼疮等)的发生发展中起着重要作用。IL-17受体普遍表达于角质形成细胞、成纤维细胞、内皮细胞等细胞表面[4,5]。
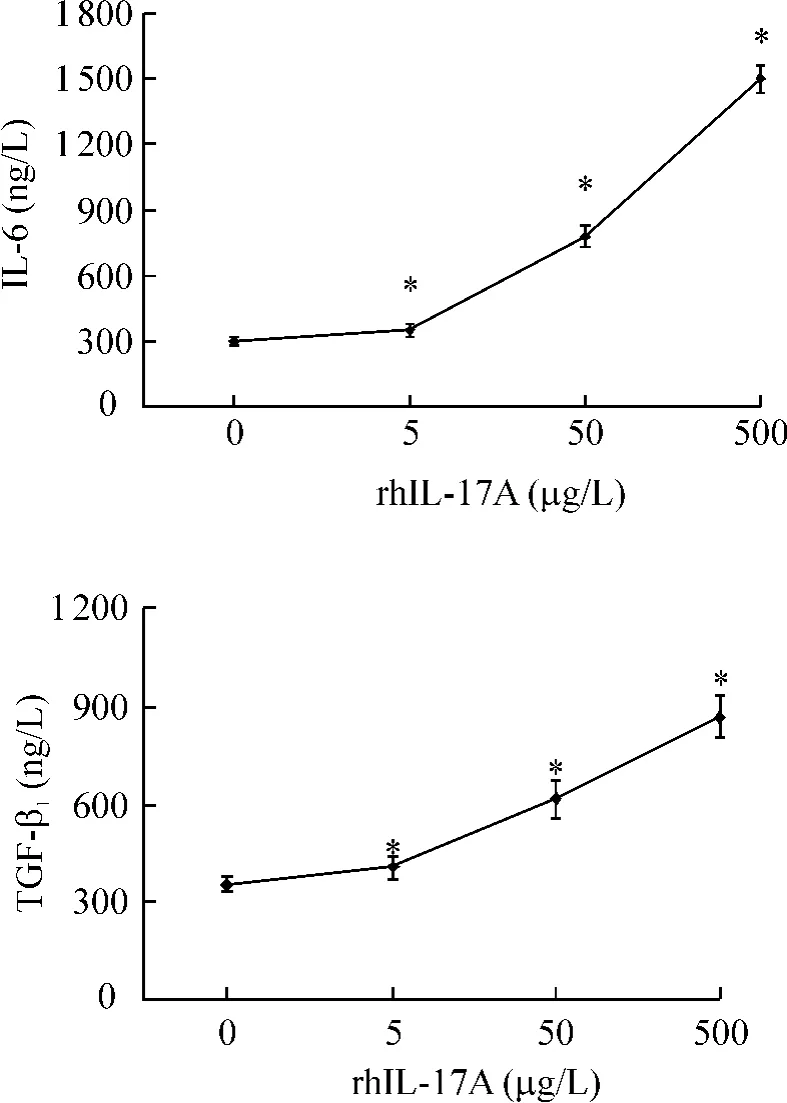
Figure 4.Secretion of interleukin-6 and TGF-β1by fibroblasts with the stimulation of rhIL-17A.was tested by ELISA.±s.n=3.*P<0.05 vs 0 μg/L rhIL-17A.图4 rhIL-17A刺激成纤维细胞分泌IL-6和TGF-β1
本实验结果显示,rhIL-17A对体外培养的角质形成细胞的增殖没有明显影响,与Nograles等[6]使用rhIL-17体外作用于全皮肤模型的研究结果相一致。此外,本实验发现rhIL-17A处理组和对照组角质形成细胞凋亡率未见明显差异,说明rhIL-17A对角质形成细胞的凋亡亦不存在明显影响。以上研究提示促炎症因子IL-17A对表皮的主要组成细胞角质形成细胞的增殖与凋亡无明显影响。
NF-κB是一种重要的核转录因子,典型的NF-κB由p53和p65亚基组成。在静息状态,NF-κB与抑制性蛋白IκBα结合以无活性的潜在状态存在于胞质中。当细胞受到炎症细胞因子、病毒感染、内毒素等刺激时,IκBα磷酸化后NF-κB得以释放发生核移位,进入核内与特异性免疫球蛋白轻链基因增强子cB序列特异性结合,促进轻链基因的表达,发挥转录和调控作用[7]。NF-κB参与调控多种细胞增殖、凋亡[8]。对肝纤维化的研究发现,NF-κB能促进各种细胞因子释放,促进炎症反应,激活肝星状细胞,是肝纤维化时的重要转录因子[9,10]。本实验结果显示rhIL-17A增强了成纤维细胞NF-κB/p65的表达,降低IκBα的表达,说明rhIL-17A可以激活成纤维细胞核转录因子NF-κB,提示IL-17A对成纤维细胞活性增强的这种促进作用可能是通过激活NF-κB实现。
IL-17已被证实能增加成纤维细胞表面细胞间黏附分子-1(intercellular cell adhesion molecule-1,ICAM-1)的表达[11]。激活的内皮细胞通过ICAM-1及激活白细胞、血小板导致微循环障碍,从而引起内皮细胞损伤[12]。本实验结果显示,rhIL-17A可以促进体外成纤维细胞的增殖,并且这种刺激作用呈现剂量依赖性。流式细胞术检测细胞凋亡,发现成纤维细胞生长状态良好,rhIL-17A处理组细胞未见明显凋亡,说明能引起前炎症反应的IL-17A不会促进成纤维细胞凋亡。此外,rhIL-17A作用于成纤维细胞可以促进成纤维细胞分泌IL-6和TGF-β1。Ogura等[13]亦研究发现 IL-17A 可以激发小鼠成纤维细胞产生过量的IL-6,导致F759小鼠发生自身免疫性关节炎。IL-6是IL-17A参与自身免疫性疾病发病过程的关键下游信号分子。Duncan等[14]发现IL-6可以刺激成纤维细胞增殖和胶原合成。使用抗IL-6抗体可以抑制系统性硬皮病患者成纤维细胞前胶原的产生[15]。Oi等[16]发现硬皮病小鼠模型硬化的皮肤中TGF-β1表达增加。TGF-β1是已知的致纤维化细胞因子,可以诱导成纤维细胞合成细胞外基质,此外TGF-β1还可以诱导结缔组织生长因子的产生,从而促进皮肤、肺、肾等组织纤维化的发生[17]。以上研究结果提示IL-17促进成纤维细胞的增殖及促进IL-6和TGF-β1的分泌,可能是导致成纤维细胞持续活化及随之发生胶原合成增加的原因之一,在硬皮病的发病中可能起着重要作用。
综上所述,本实验发现rhIL-17A对表皮中的角质形成细胞的活性无明显影响,却可以增强真皮中成纤维细胞的活性。IL-17A对成纤维细胞活性增强的这种促进作用,可能是通过激活NF-κB实现。IL-17A除了直接作用引起成纤维细胞活化,亦可能是通过诱导IL-6和TGF-β1的产生从而引起成纤维细胞增殖和胶原合成,对此尚有待使用抗体拮抗剂来阻断相应细胞因子的作用来进一步研究证实。此外,该研究结果是从正常细胞的研究中得出的,rhIL-17A对硬皮病中这2种细胞的影响还有待进一步研究。
[1] 赵 辨.临床皮肤病学[M].第3版.南京:江苏科学技术出版社,2001.672-677.
[2] Kurasawa K,Hirose K,Sano H,et al.Increased interleukin-17 production in patients with systemic sclerosis[J].Arthritis Rheum,2000,43(11):2455-2463.
[3] Varga J,Abraham D.Systemic sclerosis:a prototypic multisystem fibrotic disorder[J].J Clin Invest,2007,117(3):557-567.
[4] Kolls JK,Lindén A.Interleukin-17 family members and inflammation[J].Immunity,2004,21(4):467-476.
[5] Numasaki M,Fukushi J,Ono M,et al.Interleukin-17 promotes angiogenesis and tumor growth[J].Blood,2003,101(7):2620-2627.
[6] Nograles KE,Zaba LC,Guttman-Yassky E,et al.Th17 cytokines interleukin(IL)-17 and IL-22 modulate distinct inflammatory and keratinocyte-response pathways[J].Br J Dermatol,2008,159(5):1092-1102.
[7] Lee JI,Burckart GJ.Nuclear factor kappa B:important transcription factor and therapeutic target[J].J Clin Pharmacol,1998,38(11):981-993.
[8] 王乐禹,蒋 萱,余 磊,等.LPS诱导MC3T3-E1成骨细胞增殖并增加NF-κB p65蛋白的表达[J].中国病理生理杂志,2010,26(6):1217-1220.
[9] Robinson SM,Mann DA.Role of nuclear factor kappa B in liver health and disease[J].Clin Sci(Lond),2010,118(12):691-705.
[10] Muriel P.NF-κB in liver diseases:a target for drug therapy[J].J Appl Toxicol,2009,29(2):91-100.
[11] Yao Z,Painter SL,Fanslow WC,et al.Human IL-17:a novel cytokine derived from T cells[J].J Immunol,1995,155(12):5483-5486.
[12] Kahaleh MB.The vascular endothelium in scleroderma[J].Int Rev Immunol,1995,12(2-4):227-245.
[13] Ogura H,Murakami M,Okuyama Y,et al.Interleukin-17 promotes autoimmunity by triggering a positive-feedback loop via interleukin-6 induction[J].Immunity,2008,29(4):628-636.
[14] Duncan MR,Berman B.Stimulation of collagen and glycosaminoglycan production in cultured human adult dermal fibroblasts by recombinant human interleukin 6[J].J Invest Dermatol,1991,97(4):686-692.
[15] Kawaguchi Y,Hara M,Wright TM.Endogenous IL-1alpha from systemic sclerosis fibroblasts induces IL-6 and PDGF-A[J].J Clin Invest,1999,103(9):1253-1260.
[16] Oi M,Yamamoto T,Nishioka K.Increased expression of TGF-β1in the sclerotic skin in bleomycin-'susceptible'mouse strains[J].J Med Dent Sci,2004,51(1):7-17.
[17] Verrecchia F,Mauviel A.Transforming growth factor-β and fibrosis[J].World J Gastroenterol,2007,13(22):3056-3062.

