氨海水与5-羟色胺对栉孔扇贝解剖卵的体外促熟作用
邸炜鹏,王昭萍,于瑞海,周珊珊,顾玲玲,李 宁
(中国海洋大学海水养殖教育部重点实验室,山东青岛266003)
氨海水与5-羟色胺对栉孔扇贝解剖卵的体外促熟作用
邸炜鹏,王昭萍**,于瑞海,周珊珊,顾玲玲,李 宁
(中国海洋大学海水养殖教育部重点实验室,山东青岛266003)
研究氨海水与5-羟色胺(5-HT)对栉孔扇贝解剖获得卵母细胞的促熟作用。通过体外浸泡的方法处理栉孔扇贝卵母细胞使其成熟,并完成人工受精。结果表明一定浓度的氨海水可显著促使栉孔扇贝卵母细胞生发泡破裂,但经过氨处理的卵母细胞受精率却不高;5-羟色胺不能诱导栉孔扇贝卵母细胞生发泡破裂,但可有效地使已经发生生发泡破裂的卵母细胞进一步成熟。先用氨海水处理然后用5-羟色胺处理可以得到最佳诱导效果,受精率可达(40.02±2.73)%。
栉孔扇贝;体外成熟;氨海水;5-羟色胺
双壳贝类的繁育过程中,常采用解剖取卵、人工授精的方法,以避免精液过多的现象[1]。然而,贝类的卵子多是分批成熟分批产出的,解剖获得的卵子存在成熟度不够及发育不同步现象,对其进行体外促熟是必要的。
目前关于贝类解剖卵的体外促熟研究报道不多,仅见于太平洋牡蛎(Crassostrea gigas)[2]、马氏珠母贝(Pinctada martensii)[3]、紫扇贝(A rgopecten purpuratus)[4]、硬壳蛤(Mercenaria mercenaria)[5]、浪蛤(S pisula)[6]等几种贝类中。已有的研究结果表明海水浸泡、维生素、氨海水(Ammonia Seawater,AS)、5-羟色胺(5-HT)、组胺等对贝类的解剖卵都有一定的促熟作用。
栉孔扇贝(Chlamys f arreri)是我国北方重要的养殖贝类,因其解剖卵无法完成受精作用,卵子都是通过自然产出或诱导排放的途径获得,迄今未有其解剖取卵、体外促熟的报道。本研究采用氨海水和5-羟色胺(5-HT)对栉孔扇贝的解剖卵进行体外促熟研究,通过对生发泡破裂(Germinal Vesicle Breakdown,GVBD)情况和受精情况的分析来衡量2种试剂的促熟作用,探索扇贝解剖取卵、人工受精的可行性,最后通过氨和5-羟色胺的双因子处理建立了栉孔扇贝解剖获卵的体外促熟技术,该技术将在栉孔扇贝的繁殖和遗传操作中得到应用,并且对于建立相关类型贝类卵母细胞的体外促熟技术均有借鉴。
1 材料与方法
1.1 精卵的获得
实验用栉孔扇贝亲贝为青岛海区养殖的成熟2龄贝(壳长6.19 cm±0.5 cm,壳宽2.24 cm±0.2 cm,壳高6.65 cm±0.6 cm,体质量54.86 g±3.5 g)。
亲贝经过暂养稳定后,挑选发育良好的亲贝,解剖获得精卵[7]。将卵液用100目筛绢滤去较大组织块后,再用500目筛绢去除组织液和微小杂质;精液用300目筛绢过滤,选用上层,并检查精子活性。
1.2 卵母细胞的促熟
室温(20℃)下,在几支15 mL试管中加入等量卵液,再加入等量不同浓度的处理液,控制卵密度为500~1 000个/mL,摇匀计时。
氨海水单独处理时,处理浓度梯度设定为: 0.0025%、0.005%、0.01%、0.015%、0.020%和0.025%(以分析纯氨水25%~26%为100%)。处理时间梯度为:15、30、45和60 min。
5-羟色胺单独处理时,处理浓度梯度设定为: 0.001、0.002、0.003和0.004 mol/L。处理时间梯度为:15、30、45和60 min。
联合处理时,选取前面2组中较好的浓度加以混合,并根据情况特别添加了先用氨海水浸泡再用5-羟色胺浸泡的处理组(T组)。处理时间同上。
选用在正常海水中浸泡的卵母细胞作为对照,每次实验设3个平行组。
1.3 人工授精
取出处理完毕的卵液,用500目筛绢过滤,洗去处理液,加入5 mL小瓶中,再滴入1~2滴活力旺盛的精子,摇匀。受精过程中尽量多晃动。
1.4 观察记录GVBD发生率、受精率
受精2~3 h后,取样进行显微拍照,照片用于计算GVBD发生率、受精率。
GVBD发生率=发生GVBD的细胞数/细胞总数×100%;
受精率=正常卵裂的细胞数/细胞总数×100%;
相对GVBD发生率=处理组GVBD发生率-海水组GVBD发生率。
1.5 数据统计
最后的数据使用SPSS13.0统计软件进行双因子方差分析,以P<0.05作为差异显著水平。
2 结果
2.1 卵母细胞一系列形态变化
通过解剖获得的栉孔扇贝卵母细胞经过海水浸泡,生发泡依然未破裂(见图1A),有时也有例外(见2.3);处理后栉孔扇贝卵母细胞发生GVBD(见图1B);体外促熟的卵母细胞受精后,部分可以正常发育(见图1C);部分卵子促熟效果不明显,呈现不受精、发育过慢、发育畸形等情况(见图1D)。

图1 栉孔扇贝剥离卵的形态变化Fig.1 Morphology changes of oocyte stripped from scallop,Chlamys f arrer
2.2 氨海水对卵母细胞的促熟作用
氨海水可以显著地促使栉孔扇贝卵母细胞生发泡破裂(见图2),除氨0.0025%组之外,其它浓度都达到了100%的GVBD发生率,海水对照组仅为6%,差异极显著(P<0.01)。
卵母细胞经过氨海水处理后受精,如图3,除个别组与海水对照差异不显著外,都能极显著的提高受精率(P<0.01)。氨0.002 5%处理组体现出一定的时间依赖关系,随着时间从15 min增加到45 min受精率呈增长趋势,差异极显著(P<0.01),其它浓度处理没有时间依赖关系(P>0.05);相同的时间处理下,表现出一定的浓度依赖关系,15和30 min时,氨0.005%与0.01%处理组受精率都高于其它组,差异极显著(P< 0.01),45和60 min时,氨0.005%处理组受精率高于其它组,差异显著(P<0.05)。
氨海水最佳处理条件基本确定为:氨0.005%浓度,在处理时间15、30、45和60 min时受精率分别达到了(13.28±2.14)%、(15.88±2.15)%、(15.34± 1.41)%、(12.23±1.69)%,氨0.01%组在短时间处理时也不错,在15和30 min时受精卵分别达到了(13.82 ±2.65)%和(12.55±2.44)%。

图2 氨海水处理对GVBD发生率的影响Fig.2 GVBD rate of AS treatment
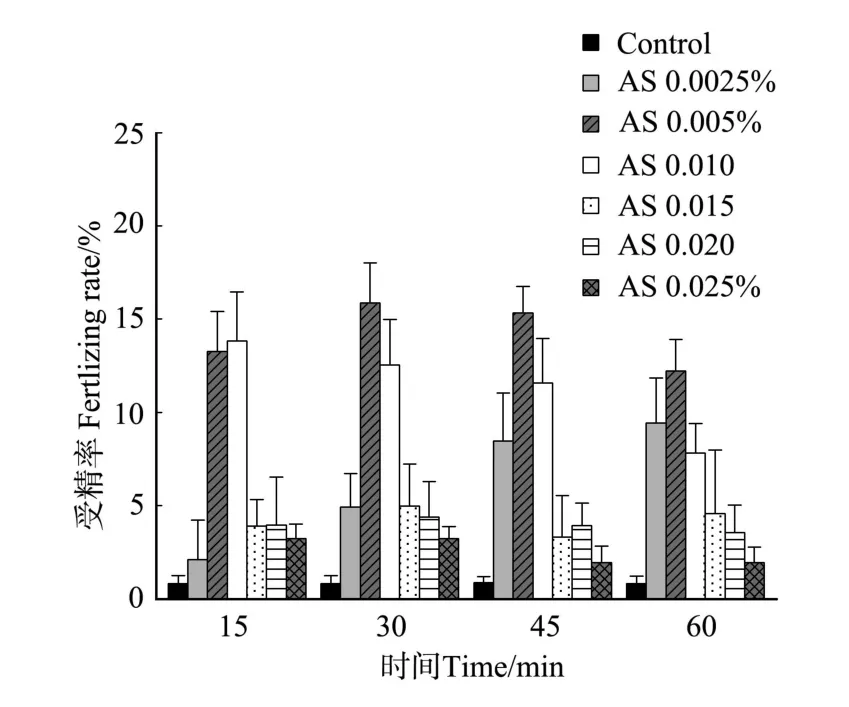
图3 氨海水处理对受精率的影响Fig.3 Fertilizing rate of AS treatment
2.3 5-HT对卵母细胞的促熟作用
栉孔扇贝解剖出的卵母细胞在海水中浸泡一段时间也有部分生发泡破裂,不同浓度和时间的5-羟色胺处理后,生发泡破裂率没有明显的提高,与海水对照组差异不显著(P>0.05)(见图4)。但经5-HT处理后,除0.004 mol/L组外,受精率都明显高于对照组(见图5),差异极显著(P<0.01)。0.002 mol/L处理组表现出一定的时间依赖性,受精率随着处理实践的延长而增高,处理45 min时受精率达到最大(24.74± 1.33)%;处理时间增加至60 min时,受精率有所降低,但差异不显著(P>0.05)。其它浓度处理组没有表现出明显的时间依赖性。相同时间处理下,表现出较强的浓度依赖性,除15 min外,其它处理时间下, 0.002 mol/L组受精率都明显高于其它组,差异极显著(P<0.01)。
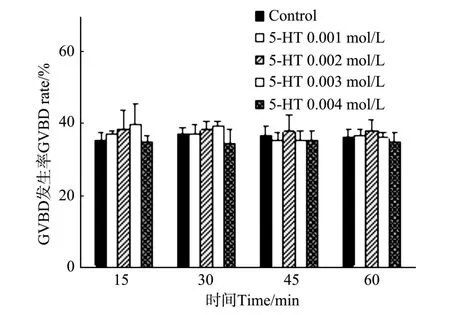
图4 5-HT对GVBD发生率的影响Fig.4 GVBD rate of 5-HT treatment
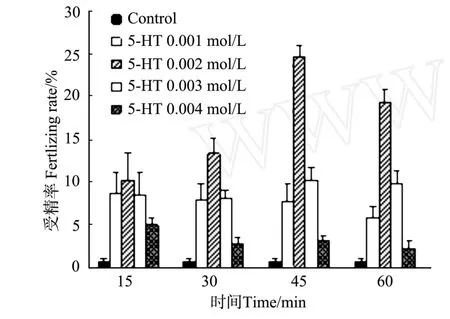
图5 5-HT对受精率的影响Fig.5 Fertilizing rate of 5-HT treatment
2.4 氨海水与5-HT联合促熟作用
使用氨海水最适浓度0.005%与不同浓度5-羟色胺混合处理时,受精率极低,只有一部分生发泡破裂。如图6所示,最高的相对GVBD发生率只有(8.48± 0.11)%,低于氨海水单独作用,说明氨水的作用受到5-羟色胺的抑制。
适当提高氨海水浓度,与5-羟色胺混合处理, GVBD发生率达到100%。考虑到2种试剂间的相互干扰,特别添加了T组,即先后用最适条件的氨海水和5-羟色胺处理。
在混合处理中,氨0.010%与5-HT 0.001 mol/L混合取得最好效果,处理时间在15~30 min间受精率变化不明显,为(24.09±1.13)%~(25.57±0.46)%之间,高于氨海水单独处理。

图6 联合处理相互抑制下的相对GVBD发生率Fig.6 Comparatively GVBD rate of mix treatment
如图7所示,除c组与d组浓度下45与60 min处理外,其它各组受精率都显著高于对照组(P<0.01)。时间依赖性上,T组在45 min受精率高于其它时间处理,差异显著(P<0.05),其它浓度没有时间依赖性;相同时间处理时,在15 min、30 min时T组与200+1组差异不显著(P>0.05),但高于其它浓度组(P< 0.01),在45 min时,T组受精率高于其它浓度组(P< 0.01)。

图7 联合处理受精率Fig.7 Fertilizing rate of mix treatment
而用最适浓度的氨海水和5-羟色胺相继处理的T组在处理45 min时表现出了整个实验最好的诱导效果,受精率达到(40.02±2.73)%,明显高于混合处理和单独处理(P<0.001)。
3 讨论
3.1 解剖卵体外促熟的可行性
双壳贝类精子入卵的时机有2种,1种是初级卵母细胞处于第一次减数分裂之前,如卵生型牡蛎、中国蛤蜊;另一种是初级卵母细胞生发泡已经消失,初级卵母细胞处于第1次减数分裂中期[1],如扇贝、菲律宾蛤仔。
对于第1种类型的贝类,解剖获得卵母细胞可以直接用于受精,但是,适当的体外促熟可以提高卵母细胞的同步性,提高受精率[1]。王昭萍等以太平洋牡蛎的剥离卵子为材料进行体外促熟,采用海水浸泡及维生素处理等方法促进成熟较差的卵子进一步成熟,获得了成功[2];任素莲等利用海水、氨海水中浸泡使太平洋牡蛎的剥离卵生成泡破裂,促进卵子的继续发育,卵子在氨海水中的发育速度要快于在纯海水中的发育速度[8];沈亦平等利用氨水和海水对解剖获取的马氏珠母贝卵子的促熟过程进行了比较研究[3]。
对于第2种贝类,由于解剖获得的卵母细胞处于前期,直接受精无法完成,所以多采用阴干等方法进行催产,体外促熟的研究比较少,氨海水体外促熟的方法在缢蛏、旗江珧[9]等贝类中有所应用,但是效果一般; Gloria等利用组胺对紫扇贝卵子进行体外促熟,避免了雌雄同体的自交[4]。
栉孔扇贝也属于第2种类型的贝类,目前还未见关于其解剖取卵及体外促熟的报道。本研究采用氨海水和5-羟色胺(5-HT)对栉孔扇贝的解剖卵进行处理,发现氨海水能有效地促使卵母细胞生发泡破裂, GVBD发生率可高达100%;5-羟色胺对生发泡破裂无明显作用,但可以显著的提高生发泡已经破裂的卵母细胞的受精率,氨海水与5-羟色胺的联合处理使得栉孔扇贝解剖卵受精率达40%,这为进一步的试验及应用提供了良好基础。
3.2 生发泡破裂与卵母细胞成熟的关系
卵母细胞的成熟过程对动物卵子的受精以及以后的发育过程是至关重要的[10]。解剖获得的栉孔扇贝的卵母细胞处于前期I阻滞状态,经过激活,会在第1次减数分裂的中期发生第2次阻滞,之后通过受精作用的激活完成整个减数分裂过程,并进一步发育。
在已有的研究中,生发泡破裂(GVBD)通常被认为是卵母细胞成熟的标志[11],意味着卵母细胞启动了减数分裂。然而本研究发现,生发泡破裂并不意味着卵母细胞的真正成熟。经解剖获得的栉孔扇贝卵母细胞有时会有部分生发泡已经破裂,但是这部分卵母细胞无法完成受精和分裂。同样,用一定浓度的氨海水(0.005%~0.025%)处理栉孔扇贝卵母细胞,可以显著的促使生发泡破裂,GVBD发生率达到100%,但是受精率依然不高,表明生发泡破裂之后只有少量卵母细胞能进一步完成成熟过程。
生发泡破裂可能只是是重新启动减数分裂的第一步,由生发泡破裂到第1次减数分裂中期这一过程却不一定能实现,依然需要激活。5-HT可以显著的提高生发泡已经破裂的卵母细胞的受精率,表明5-HT正是起到了这种激活作用。
由此可以看出,对栉孔扇贝来说,生发泡破裂是卵母细胞成熟的必要条件,而非充分条件,生发泡破裂之后需要进一步的激活才能使卵母细胞进入到成熟过程。
3.3 氨海水和5-HT的互补性及作用机理
本研究表明,氨海水能有效地促使卵母细胞生发泡破裂,而5-羟色胺可以显著的提高生发泡已经破裂的卵母细胞的受精率,充分表明氨海水和5-HT对扇贝解剖卵的促熟作用具有一定的互补性。
Loosanoff提出在海水中加入氨海水溶液,可促使双壳类(如Tapes Sedidecussata)卵母细胞生发泡的破裂,有利于卵的受精[12]。方永强进一步肯定了氨海水是菲律宾蛤卵母细胞达到生理成熟的必要因子,并提出氨海水是通过激发核与细胞器的物质和能量代谢来实现激活作用的[13]。在本研究中,氨海水在一定浓度下可以显著的促使栉孔扇贝卵母细胞生发泡破裂(见图2),但是这种初步的作用并没有得到可观的受精率,最高只有15%左右(见图3),可能是因为氨海水的促熟作用比较初步,无法对卵母细胞的重要调控因子(如成熟促进因子MPF、有丝分裂原激活的蛋白激酶MAPK、环磷酸腺苷cAMP等[14-16])起到关键的作用。
5-HT作为1种信号分子,可以与卵母细胞膜表面的G蛋白(GTP结合调节蛋白)偶联受体结合,导致细胞内产生第二信使,从而将胞外信号跨膜传递到胞内影响细胞的行为。G蛋白偶联受体所介导的细胞信号通路主要包括cAMP信号通路和磷脂酰肌醇信号通路。目前的研究发现,这2条通路都参与了双壳贝类卵母细胞的成熟过程[6,17-18]。王清等研究了cAMP信号通路在5-HT诱导硬壳蛤卵母细胞成熟过程中的作用[5]。本研究中,5-HT在所用的浓度范围内对栉孔扇贝卵母细胞的生发泡破裂没有作用(见图4),但是对已经发生生发泡破裂的卵母细胞可以进一步的激活,受精率虽然最高也只有25%左右(见图5),但是相对于只有37%的GVBD发生率,激活效率很高。大多数情况下,解剖出的卵母细胞生发泡破裂率很低,所以单独使用5-HT处理没有明显的促熟效果,这表明5-HT对栉孔扇贝卵母细胞信号通路的调控作用可能主要体现在生发泡破裂后到第一次减数分裂中期这个阶段。
氨海水和5-HT的混合处理情况较复杂,当使用氨海水浓度较低时,5-HT显著的抑制了氨海水的作用(见图6),提高氨海水浓度的混合处理,受精率比单独处理有所提高(25%),依然不够理想。先用氨海水处理再用5-HT处理,排除了2种试剂的相互干扰,达到了较好效果,受精率最高达到40%以上,但这与生产应用还有较大的距离。有关氨海水和5-HT对扇贝解剖卵的促熟条件优化和作用机理尚有待于进一步的研究。
[1] 王如才,王昭萍,张建中.海水贝类养殖学[M].1版.青岛:青岛海洋大学出版社,1998.
[2] 王昭萍,王如才,李洪刚,等.维生素及海水浸泡队牡蛎卵子的体外促熟作用[J].海洋湖沼通报,1997(2):70-75.
[3] 沈亦平,姜海波,刘汀,等.合浦珠母贝卵子成熟的细胞学观察[J].武汉大学学报:自然科学版,1993(5):109-114.
[4] Gloria M,Livia M,Miguel AP,et al.A method to eliminate selffertilization in a simultaneous hermaphrodite scallop.1.Effects on growth and survival of larvae and juveniles[J].Aquaculture, 2007,273:459-469.
[5] 王清,张涛,张立斌.cAMP信号通路在5-羟色胺诱导硬壳蛤卵母细胞成熟过程中的作用[J].高技术通讯,2008,18(1):91-96.
[6] Eckberg W R.Intracellular signal transduction and amplification mechanisms in the regulation of oocyte maturation[J].Biol Bull, 1988,174:95-108.
[7] Allen R D.Fertilization and artificial activation in the egg of the surf clamS pisulasolidissima[J].Biol Bull,1953,105:213-239.
[8] 任素莲,绳秀珍,王如才,等.太平洋牡蛎卵子体外发育的研究[J].海洋科学,2001,25(7):35-38.
[9] 余祥勇,王梅芳,何志江,等.旗江珧早期胚胎发育的初步研究[J].海洋科学,1999(4):62-65.
[10] Masui Y,Clarke H J.Oocyte maturation[J].Int Rev Cytol, 1979,57:185-282.
[11] Eppig J J.The relationship between cumulus cell-oocyte coupling,oocyte meiotic maturation,and cumulus expansion[J]. Dev Biol,1982,89:268-272.
[12] Loosanoff V,H C Davis.Advances in marine biology[M].London and New York:Academic press,1963(1):15-17.
[13] 方永强.菲律宾蛤生殖机制的研究Ⅱ.氨海水促使卵母细胞成熟的超微结构研究[J].台湾海峡,1982,1(2):99-105.
[14] Goudet G,Belin F,Bezard J,et al.Maturation-promoting factor (MPF)and mitogen activated protein kinases(MAPK)expression in relation to oocyte competence for in-vitro maturation in the male[J].Mol Hum Reprod,1998,4(6):563-570.
[15] Ye J,Flint A P,Luck M R,et al.Independent activation of MAP kinase and MPF during the initiation of meiotic maturation in pig oocytes[J].Reproduction,2003,125(5):645-656.
[16] Downs S M,Hudson E R,Hardie D G.A potential role for AMP-activated protein kinase in meiotic induction in mouse oocytes [J].Dev Biol,2002,245(1):200-212.
[17] Guerrier P,Leclerc-David C,Moreau M.Evidence for the involvement of internal calcium stores during serotonin-induced meiosis reinitiation in oocytes of bivalve mollusc Ruditapes phillippinarum[J].Dev Biol,1993,159:474-484.
[18] Bloom T L,Szuts E Z,Eckberg W R.Inositol trisphosphate,inositol phospholipid metabolism,and germinal vesicle breakdown in surf clam oocytes[J].Dev Biol,1988,129:532-540.
Abstract: To test the effect of ammonia seawater and 5-HT on the maturation of oocyte stripped from scallop,Chlamys f arreri(Jones et Preston),Oocytes were treated with ammonia seawater and 5-HT in vitro,and then fertilized artificially.Results showed that ammonia seawater can induce Germinal Vesicle Breakdown(GVBD)of scallop oocytes remarkably,but the fertilizing rate was low.5-HT can not induce GVBD of oocytes,but can induce the maturation of the oocytes already GVBD.Oocytes first induced by ammonia seawater then induced by 5-HT showed the best effects,and the fertilizing rate was(40.02± 2.73)%.
Key words: Chlamys f arrer(Jones et Preston);maturation improvement;ammonia seawater;5-HT
责任编辑 于 卫
Effect of Ammonia Seawater and 5-HT on Maturation of Oocyte Stripped from Scallop,Chlamys farreri(Jones et Preston)
DI Wei-Peng,WANG Zhao-Ping,YU Rui-Hai,ZHOU Shan-Shan,GU Ling-Ling,LI Ning
(The Key Laboratory of Mariculture,Ministry of Education,Ocean University of China,Qingdao 266003,China)
S961.2+2
A
1672-5174(2011)04-046-05
国家自然科学基金项目(30771622);国家高技术研究发展计划项目(2006AA10A401)资助
2010-01-22;
2010-03-23
邸炜鹏(1984-),男,硕士生,主要从事贝类遗传育种研究。E-mail:diweipeng05110@163.com
E-mail:zpwang@ouc.edu.cn

