大鼠骨骼肌纤维化形成过程中IGF21、TGF2 β1的表达
罗 丽,张 健,董 宇,孙中文,李小宁,陆阿明,刘承宜
大鼠骨骼肌纤维化形成过程中IGF21、TGF2 β1的表达
罗 丽1,张 健2,董 宇3,孙中文4,李小宁4,陆阿明1,刘承宜5
目的:从胰岛素样生长因子21(insulin2like growth factor21,IGF21)和转化生长因子2 β1 (transforming growth factor2 β1,TGF2 β1)的动态变化规律理解骨骼肌纤维化的发生机制。方法:健康雄性Sprague2Dawley大鼠随机分为对照组和模型组。模型组进一步分为损伤后第1、2、3、7、14、21和28天组。模型组采用局部钝物打击造成急性骨骼肌钝挫伤。免疫组织化学法同步观察大鼠骨骼肌纤维化形成过程中IGF21、TGF2 β1的表达,并采用有序样品聚类分析方法对表达强度变化进行分期。结果:1)模型组IGF21在损伤区域的表达显著上调,除了表达于再生肌纤维外,在肉芽组织和增生的结缔组织中也可见阳性表达,在塑型期尤为明显。模型组IGF21表达强度呈倒“V”字形变化,可分为3期:损伤后第1~7天为第1期,损伤后第14~21天为第2期,损伤后第28天为第3期,其中第2期最高。2)模型组TGF2 β1表达显著上调,主要表达于新生肌细胞和细胞间质,表达强度呈现“V”字形变化,也分为3期:损伤后第1~2天为第1期,损伤后第3~14天为第2期,损伤后第21~28天为第3期,其中第2期最低。结论:IGF21、TGF2 β1在骨骼肌损伤修复过程中均高水平表达。在损伤期和修复期,二者可能共同参与骨骼肌再生和细胞外基质再生,并且可能存在协同作用。在组织塑型期,二者均高水平表达于细胞间质(特别是增生的结缔组织),二者可能共同参与了骨骼肌纤维化的形成。
骨骼肌纤维化;胰岛素样生长因子21;转化生长因子2 β1;鼠;动物实验
骨骼肌纤维化是骨骼肌慢性疾病和外伤的病理性标志之一,大量的纤维化会阻碍肌纤维的再生及其收缩功能、力学性能的恢复[20,10,11]。骨骼肌损伤发生后,多个细胞通路被激活以修复损伤组织,对参与骨骼肌损伤修复过程中的生长因子及其受体、激酶以及其他介质的深入研究将为有效治疗这一病变提供有力的依据。
胰岛素样生长因子21(insulin2like growth factor21,IGF2 1)和转化生长因子2 β1(transforming growth factor2 β1,TGF2 β1)是骨骼肌再生与修复过程中的两个重要的生长因子。以往的研究认为,IGF21在促进骨骼肌再生方面起关键作用[12,19],TGF2 β1则主要被看作是肌肉再生的负性调节因子,是纤维化的始动因子[12,19],有关应用外源性IGF21或IGF21转基因靶向表达等方法促进骨骼肌损伤愈合,预防纤维化的研究报道很多[9,24,29],然而,其最终疗效并不满意,可发生肌肉过度增生[29],并不同程度地伴有骨骼肌纤维化和瘢痕形成[31]。抑制TGF2 β1激活的信号通路的药物(苏拉明[11]、结蛋白[26]、r2干扰素[17]等)提供了新颖的抗纤维化策略,但这些药物都在一定程度上存在副作用[28]; Denton CP等[14]应用TGF2 β1抗体治疗系统性硬化的随机、安慰剂对照I/II期临床试验表明,TGF2 β1多克隆抗体(CAT2192)没有疗效,且增加了病死率。
最近的研究发现,IGF21参与某些纤维化疾病(如肺纤维化[13,16]、肝纤维化[8])的发生发展,而TGF2 β1作为机体不可或缺的多功能细胞生长因子,在调节机体免疫功能方面起重要作用[36]。研究证实,纤维化是一类免疫介导的疾病,固有免疫和适应性免疫均参与其中[36]。目前,IGF21与TGF2 β1在骨骼肌纤维化的形成过程中的作用尚未完全阐明,二者的作用是相互独立的、拮抗的还是相互协同的?本研究通过建立骨骼肌纤维化动物模型,对骨骼肌纤维化形成过程中IGF21、TGF2 β1的动态变化规律进行同步研究,分析二者的表达分布特征、表达面积百分比、表达强度特征,为深入理解骨骼肌纤维化的发生机制,从而防治骨骼肌纤维化以及其他纤维化疾病提供理论和实验依据。
1 材料和方法
1.1 实验动物分组
健康雄性Sprague2Dawley(SD)大鼠(180~220 g)54只,由中国科学院上海实验动物中心提供。将54只大鼠随机分为对照组(6只)和模型组(48只)。模型组根据取材时间点的不同,进一步分为:损伤后第1、2、3、7、14、21、28天组,每组各6只。
1.2 实验方法
1.2.1 建立动物模型
罗丽等[7]的研究表明,大鼠骨骼肌钝挫伤自然愈合过程中,可出现典型的骨骼肌纤维化。本研究沿用其方法,建立骨骼肌纤维化动物模型。
大鼠分笼饲养2天后,参照Kami等[21]的方法对大鼠实施骨骼肌钝挫伤,即2.5%戊巴比妥钠(0.2/100 mL/g)腹腔注射麻醉后,将大鼠后肢置于伸膝、踝背屈90°位置,用自制打击装置从81 cm高处自由垂直落下打击动物左小腿内侧面距跟骨1.5 cm处,重力为3.234 N,动能为2.62 J,打击面积约0.785 cm2。解剖证实后下肢肌群造模成功率达100%。
1.2.2 标本取材及处理
先称取动物体重,用2.5%戊巴比妥钠(0.2/100 mL/g)腹腔注射麻醉动物后,速取损伤区域腓肠肌,用冰生理盐水洗去残留血液,中性福尔马林固定,用于苏木素2伊红(hemotoxylin and erosin,HE)染色、胶原纤维范吉森(Van Gieson,V.G.)染色光镜观察和免疫组织化学实验。
1.2.3 V.G.染色
V.G.染色法是用来显示区分胶原纤维和肌纤维的优良染色方法。特点是利用酸性品红与苦味酸分别对胶原纤维、肌纤维具有较强亲和力的原理,将其双重染色,结果胶原纤维在酸性品红的作用下染成红色至粉红色,肌肉在苦味酸的作用下染成黄色[30]。
1.2.4 免疫组织化学实验
小鼠抗大鼠IGF21、TGF2 β1多克隆抗体(Santacruz公司产品)、鼠两步法检测试剂盒(包括内源性过氧化物酶阻断剂、辣根酶标记羊抗小鼠多聚体),DAB显色试剂盒均购自北京中杉金桥生物技术有限公司。采用常规2步免疫组化法,按试剂盒说明书操作。以PBS代替一抗作为阴性对照,工作浓度均为1∶50。
使用Image Proplus 6.0显微图像分析系统对免疫组化染色的切片进行定量分析[27]。具体操作为低倍镜(100 ×)下每张切片随机选5个视野测量,测定视野内阳性面积百分比、阳性信号积分光密度(Integrated optical density, IOD)。阳性面积百分比指阳性表达区域面积占该视野观察区域面积的百分比。积分光密度则反映光密度与面积的综合变化,表示整个视野内所有选定对象的反应强度的总和。
1.2.5 统计学分析
采用SPSS 17.0软件,方差分析(analysis of variance)法分析模型组与对照组IGF21、TGF2 β1阳性表达面积、阳性表达强度的差异。此外,采用有序样品聚类分析方法对模型组IGF21、TGF2 β1阳性表达强度依时间发生的变化规律进行分析。
2 结果
2.1 骨骼肌纤维化模型的确立
HE染色结果可见:对照组:骨骼肌纤维排列整齐,无变性、出血、坏死、炎性细胞浸润、胶原增生等改变。模型组:在损伤后第7天,损伤区域出现成纤维细胞;在损伤后21天,损伤区域肌纤维排列紊乱,可见胶原纤维增生(图1);在损伤后第28天,胶原增生更加显著。V.G.染色法进一步清晰地显示,损伤区域存在大量胶原纤维增生(图2)。以上结果表明模型的建立是成功的。
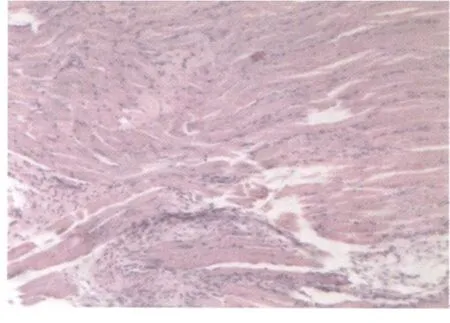
图1 模型组损伤后第21天HE染色光镜下表现图10×10Fig.1 Section of gastrocnemius muscle at the 21thday after contusion in the model group,stained with H&E
2.2 IGF2I的表达
2.2.1 IGF21表达的分布特征
对照组未见或偶见棕黄色染色阳性颗粒(图3)。模型组IGF21染色均为阳性。模型组损伤后第1天,损伤区域IGF21阳性细胞呈弥漫性分布,棕黄色着色颗粒见于细胞浆,染色浅淡(图4);损伤后第2天,模型组损伤区域出现片状分布、染色深的IGF21阳性细胞(图5);损伤后第3、7天的IGF21的表达分布与第2天相似(图6、图7);损伤后第14天,损伤区域再生肌细胞IGF21阳性染色强度增强,出现大面积、片状分布的棕褐色阳性细胞,且在肉芽组织,特别是新生的毛细血管处可见染色深的阳性颗粒(图8);损伤后第21天与第14天相似(图9);损伤后第28天,损伤区域再生的肌纤维呈现弥漫性阳性染色,此外,在增生的结缔组织中可见呈条索状分布的棕黄色颗粒(图10)。

图2 模型组损伤后第28天V.G.染色光镜下表现图10×10Fig.2 Section of gastrocnemius muscle at the 28thday after contusion in the model group,stained with V.G.
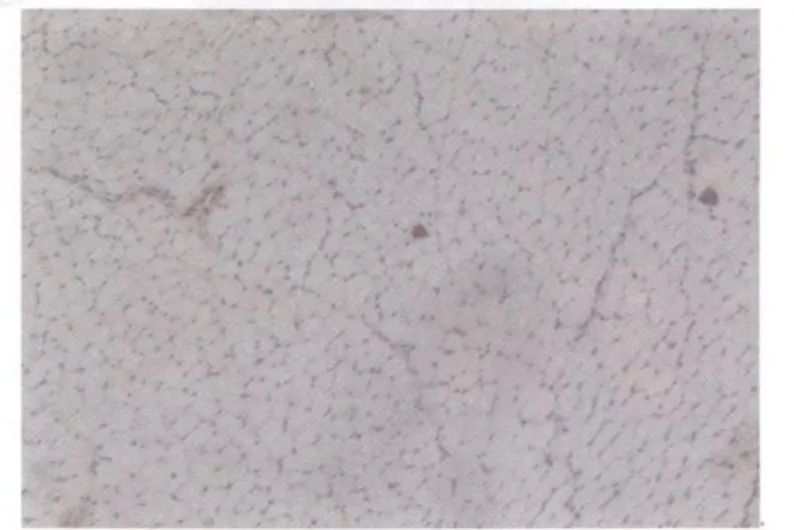
图3 对照组IGF21表达图10×10Fig 3. The expression of IGF21 in the control group

图4 模型组损伤后第1天IGF21表达图10×10Fig 4. The expression of IGF21 at the 1stday after contusion in the control group

图5 模型组损伤后第2天IGF21表达图10×10Fig.5 The expression of IGF21 at the 2ndday after contusion in the model group

图7 模型组损伤后第7天IGF21表达图10×10Fig.7 The expression of IGF21 at the 7thday after contusion in the model group

图9 模型组损伤后第21天IGF21表达图10×10Fig.9 The expression of IGF21 at the 21thday after contusion in the model group
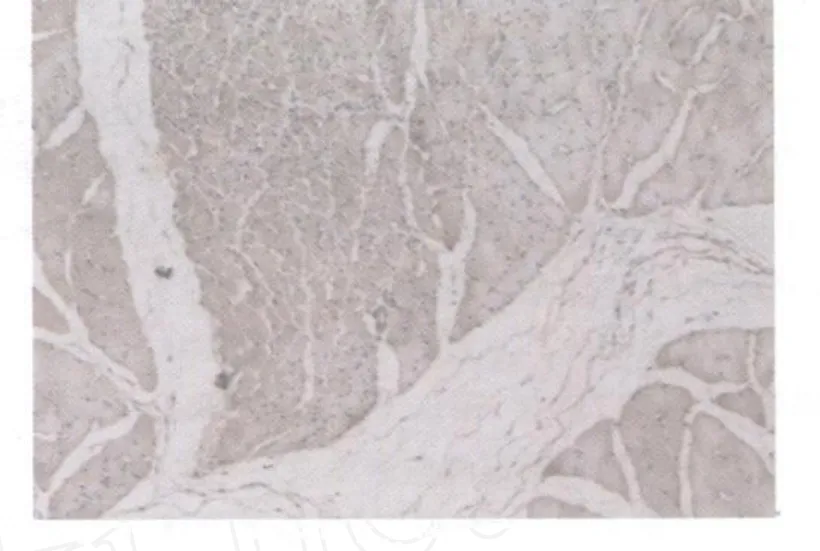
图10 模型组损伤后第28天IGF21表达图10×10Fig.10 The expression of IGF21 at the 28thday after contusion in the model group
2.2.2 IGF21阳性面积百分比变化和阳性表达强度特征
损伤后模型组IGF21阳性面积百分比持续上升,与对照组相比差异显著(P<0.01),峰值点在损伤后第28天(图11);损伤后模型组IGF21阳性表达强度上调,在损伤后第2、3、7、14、21、28天均显著高于对照组(P<0.01),呈倒“V”字形变化,峰值点在损伤后第21天(图12)。

图11 对照组和模型组IGF21阳性面积的变化图Fig.11 The change of IGF21 positive areas in thecontrol group and the model group
2.3 TGF2 β1的表达
2.3.1 TGF2 β1表达的分布特征
对照组和模型组TGF2 β1染色均为阳性。对照组棕褐色阳性颗粒主要分布于胞浆、肌膜。阳性细胞主要分布在肌束膜周围,以连接部位着色最强(图13)。模型组损伤后第1天,损伤区域肌细胞大量变性、坏死,阳性表达很少,而间质阳性染色较强,尤以炎性细胞浸润比较集中的区域为著(图14);损伤后第2天与第1天相似(图15);损伤后第3天,损伤区域棕褐色阳性颗粒主要集中在细胞间质,肌细胞几乎没有阳性表达(图16);损伤后第7天,损伤区域新生肌细胞和间质均可见大量弥散性分布的棕黄色至棕褐色阳性颗粒(图17);损伤后第14天,损伤区域再生肌组织可见呈片状分布的阳性细胞,着色深浅不一,细胞间质可见棕褐色、条索状分布的阳性表达(图18);损伤后第21天与第14天相似(图19);损伤后第28天,损伤区域肌再生肌纤维仍可见呈片状分布的阳性细胞,增生的结缔组织可见较多棕褐色颗粒,染色较深(图20)。
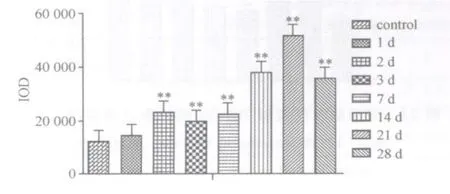
图12 对照组和模型组IGF21表达阳性强度变化图Fig.12 The expression intensity of IGF21 in the control group and the model group

图13 对照组TGF2 β1表达图10×10Fig 13. The expression of TGF2 β1 in the control group

图14 模型组损伤后第1天TGF2 β1表达图10×10Fig 14. The expression of TGF2 β1 at the 1stday after contusion in the model group

图15 模型组损伤后第2天TGF2 β1表达图10×10Fig 15. The expression of TGF2 β1 at the 2ndday after contusion in the model group
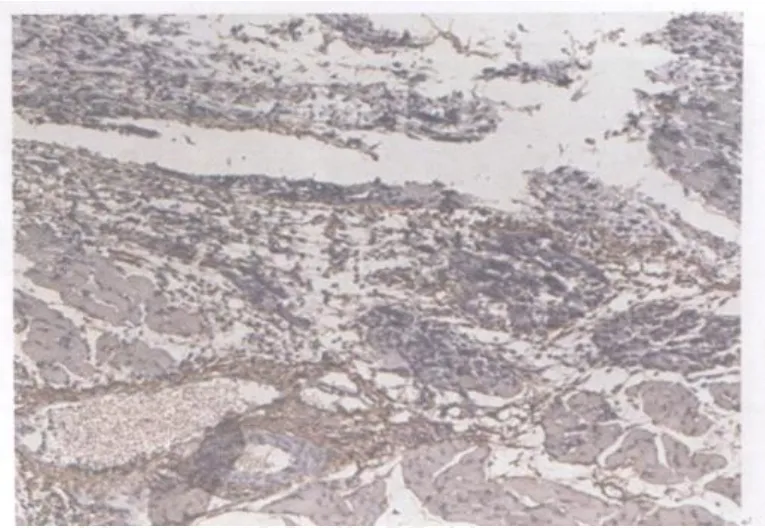
图16 模型组损伤后第3天TGF2 β1表达图10×10Fig 16. The expression of TGF2 β1 at the 3rdday after contusion in the model group
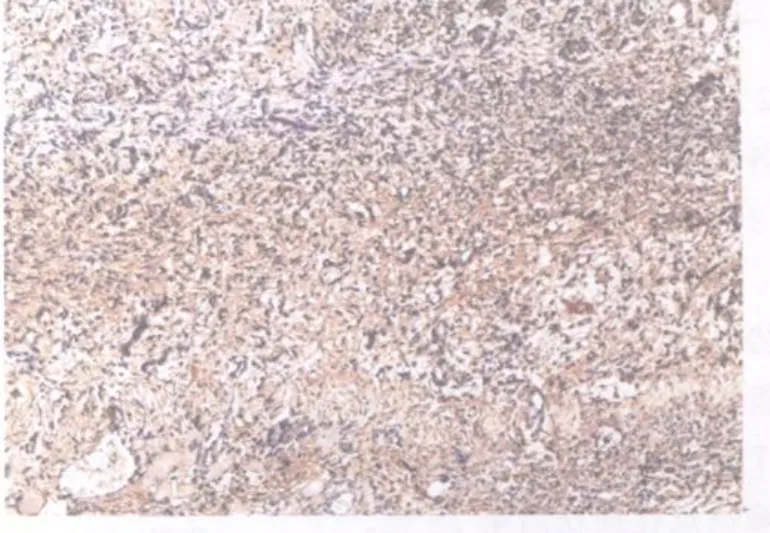
图17 模型组损伤后第7天TGF2 β1表达图10×10Fig 17. The expression of TGF2 β1 at the 7thday after contusion in the model group
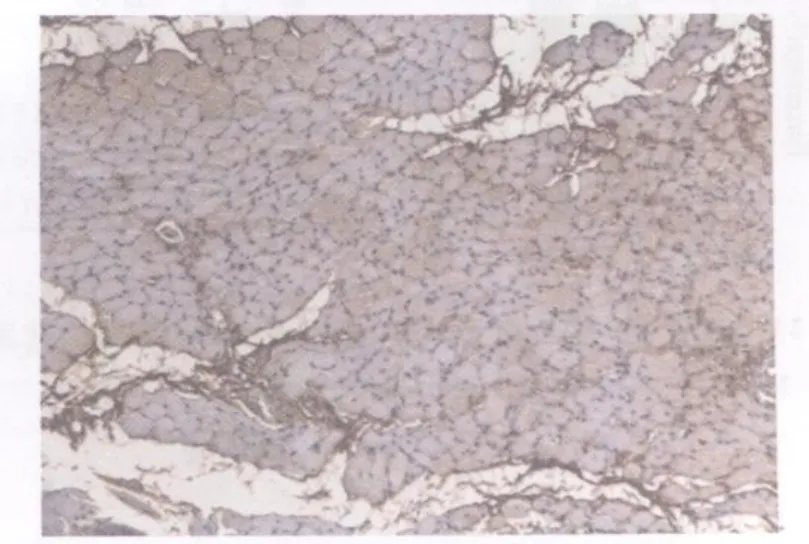
图18 模型组损伤后第14天TGF2 β1表达图10×10Fig 18.The expression of TGF2 β1 at the 14thday after contusion in the model group
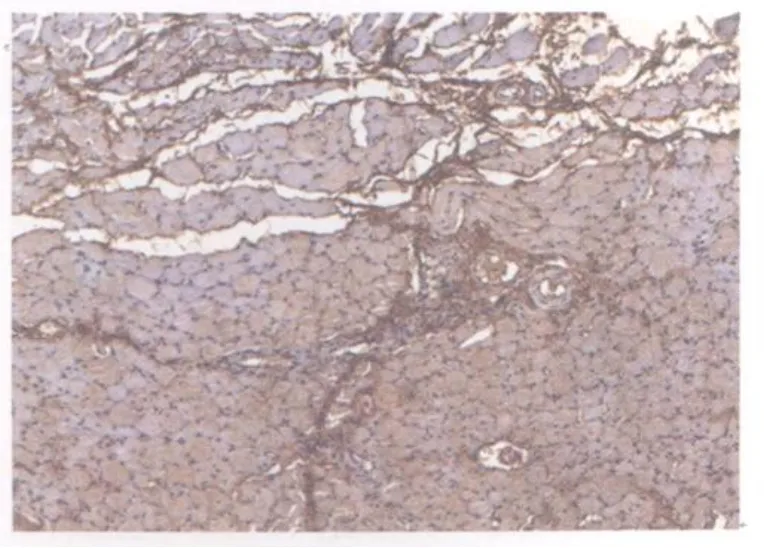
图19 模型组损伤后第21天TGF2 β1表达图10×10Fig 19.The expression of TGF2 β1 at the 21thday after contusion in the model group

图20 模型组损伤后第28天TGF2 β1表达图10×10Fig 20.The expression of TGF2 β1 at the 28thday after contusion in the model group
2.3.2 TGF2 β1阳性面积百分比、阳性强度的变化
各模型组阳性面积百分比均显著高于对照组(损伤后第1、2、14、21、28天,P<0.01;损伤后第3、7天,P< 0.05)。各模型组阳性强度变化趋势与阳性面积百分比变化趋势基本一致,呈现“V”字形变化,在损伤后各时间点均显著高于对照组(损伤后2、21、28天,P<0.01,损伤后第3、7、14天,P<0.05)(图21、图22)。TGF2 β1表达强度的峰值点在损伤后第28天。
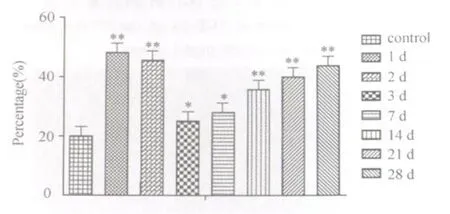
图21 对照组和模型组TGF2 β1阳性面积百分比的变化图Fig.21 The change of TGF2 β1 positive areas in the control group and the model group
2.4 模型组IGF21、TGF2 β1阳性表达强度变化的有序样品聚类分析
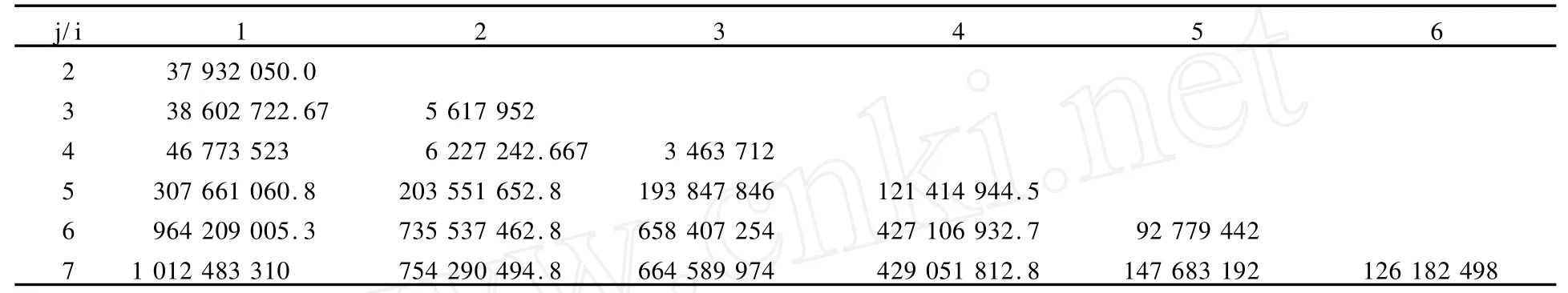
有序样品聚类分析,也称为最优分割法,在分类时不打乱样品序号的次序,即同一类样品的序号必须是相互连接的,并比较所有可能的分类结果,在某种损失函数意义下,求得最优解(即要求分类后产生的总的组内离差平方和最小),使得组内相似性大,而组间相似性小[2]。用有序样品聚类分析法对依时间次序排列的样本进行分类,可以精确地划分指标变化的不同时期。根据IGF21、TGF2 β1阳性表达强度(IOD)测定结果,用有序样品聚类分析法研究了它们的阶段变化情况。
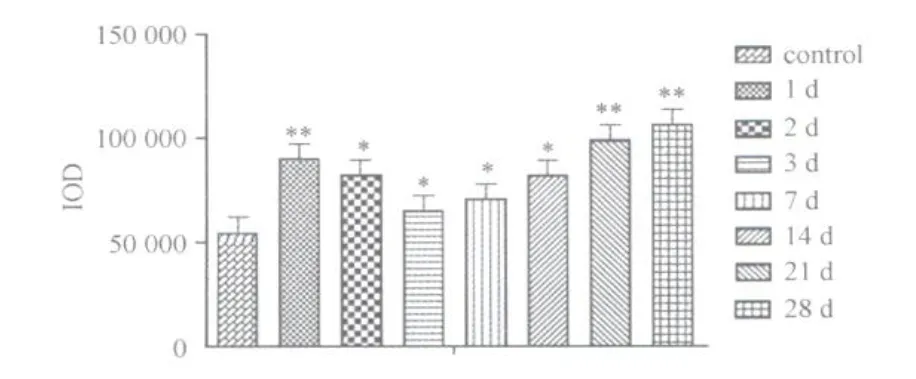
图22 对照组和模型组TGF2 β1阳性表达强度的变化图Fig.22 The expression intensity of TGF2 β1 in the control group and the model group
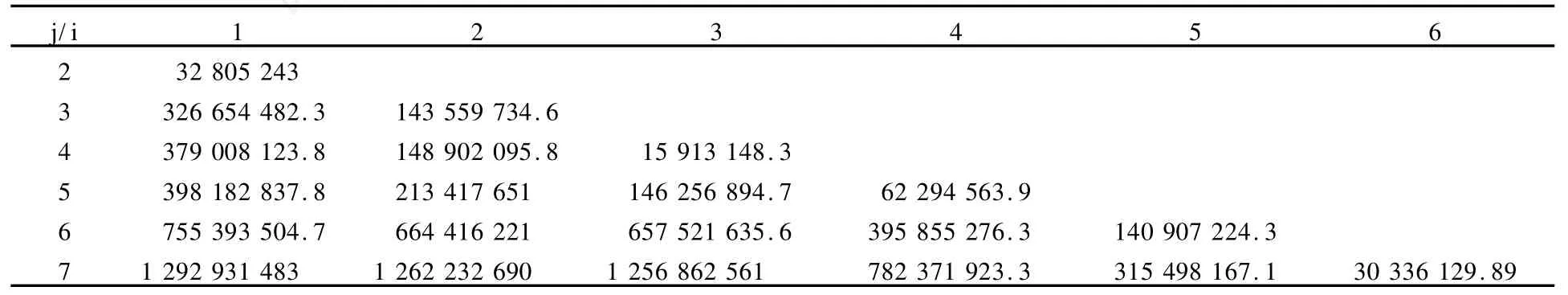
模型组IGF21、TGF2 β1阳性表达强度IOD测定结果见表1、表2。有序样品聚类分析的具体计算步骤如下: 1)计算样本的类直径,结果见表3、表4;2)由类直径表和分类损失函数的递推公式计算最小分类损失函数,结果见表5、表6。3)根据最小分类损失函数对分类数的变化情况确定分为三类,并确定出各类的边界样品号,可得最后分类结果为:IGF21:{1,2,3,4}{5,6}{7};TGF2 β1{1, 2}{3,4,5}{6,7}。于是得到了模型组IGF21变化的3个分期:损伤后第1~7天为第1期,损伤后第14~21天为第2期,损伤后第28天为第3期(第8~13天以及第22~27天有待进一步划定)。模型组TGF2 β1变化也分为3个时期:损伤后第1~2天为第1期,损伤后第3~14天为第2期,损伤后第21~28天为第3期(第15~20天有待进一步划定)。
分析中用到的概念与公式[2]:
样本的类直径:设一维有序样品依次为X(1),X(2),∧,X(n)。
设某一类G包含的样品有{X(i),X(i+1),∧,X(j)}(j>i),记为G=(i,i+1,∧,j)。该类的均值为规定直径为D(i,j)
分类损失函数:用b(n,k)表示将n个有序样品分为k类的某一种分法:G1={i1,i1+1,∧,i2-1},G2={i2,i2+ 1,∧,i3-1},…,Gk={ik,ik+1,∧,n},其中分点为1=i1 当n,k固定时,记P(n,k)是使上式达到最小的分类法。 最小分类损失函数的递推公式: 表1 模型组IGF21表达阳性强度(IOD)变化一览表Table 1 The change of IGF21 expression intensity(IOD)in the model group 表2 模型组TGF2 β1表达阳性强度(IOD)变化一览表Table 2 The TGF-β1 expression intensity(IOD)in the model group 表3 IGF21(IOD)类直径D(i,j)一览表Table 3 The class diameterD(i,j)of IGF21(IOD) 表4 TGF2 β1(IOD)类直径D(i,j)一览表Table 4 The class diameterD(i,j)of TGF2 β1(IOD) 表5 IGF21(IOD)最小分类损失函数L[P(l,k)]一览表Table 5 The minimum classification loss functionL[P(l,k)]of IGF21(IOD) 表6 TGF2 β1(IOD)最小分类损失函数L[P(l,k)]一览表Table 6 The minimum classification loss functionL[P(l,k)]of TGF2 β1 本研究采用急性钝挫伤的方式建立了骨骼肌纤维化动物模型,HE和V.G.染色结果证实,模型的建立是成功的。 骨骼肌的再生与修复是包括骨骼肌细胞再生与细胞外间质再生的非常复杂的过程,其间多种细胞信号通路被激活[12,19,33,35]。传统上,将骨骼肌损伤与修复的过程分为损伤期、修复期、组织塑型期3个阶段[20]。损伤期发生在损伤后的最初几天,主要表现有肌肉坏死、退化,中性粒细胞浸润,巨噬细胞游弋到损伤处吞噬坏死组织;修复期通常发生在受损后的7~10天,其高峰通常发生在受伤后2周左右,在受伤后3~4周下降,在这一阶段,主要发生肌组织和细胞外基质的再生;组织塑型期通常在受伤后第2~3周开始,主要的病理变化是:再生骨骼肌成熟,瘢痕组织机化。一旦疤痕形成,肌组织的完全修复将不可能发生。 关于骨骼肌纤维化发生的过程中IGF21、TGF2 β1动态变化规律的研究很少,这在很大程度上制约着对骨骼肌纤维化的深入理解。本研究选取骨骼肌纤维化形成过程中的关键时间点(损伤期选取损伤后第1、2、3天;修复期选取损伤后第7、14天;组织塑型期选取第21、28天),对IGF21、TGF2 β1的表达分布特征、表达阳性面积百分比、表达强度特征进行同步研究,并采用有序样品聚类分析的方法,对骨骼肌纤维化形成过程中IGF21、TGF2 β1表达强度的变化规律进行研究,为骨骼肌纤维化的预防和治疗提供理论和实验依据。 本研究结果表明,骨骼肌损伤发生后,IGF21在损伤区域的表达分布持续增加,IGF21阳性面积百分比的峰值点在损伤后第28天;有序样品聚类分析的结果表明,模型组IGF21表达强度的变化呈现倒“V”形,分为3个时期:损伤后第1~7天为第1期,损伤后第14~21天为第2期,损伤后第28天为第3期,其中第2期最高。模型组损伤后IGF21表达均显著高于对照组,其中在第2期表达最高。近年来的研究证实,骨骼肌损伤修复过程中IGF21表达上调,但关于损伤后IGF21的变化规律国内外均少有报道。李云霞等[4]采用逆转录2聚合酶链反应(RT2PCR)方法,研究了SD大鼠骨骼肌钝挫伤后组织修复过程中(损伤后第1、2、3、4、6、9、14天)局部IGF21 mRNA的表达情况。结果发现,IGF2I mRNA含量在伤后2、3、4、6、9、14天升高。李宏云等[3]采用打击装置造成大鼠右侧腓肠肌中段钝挫伤模型,采用Western blot方法对IGF21多肽表达进行测定。结果表明,在损伤后第4、7、14、28天,IGF21多肽表达均明显升高(P<0.05)。以上研究均说明,IGF21表达的启动是损伤修复过程中长期持续的过程,但在这些研究中,时间点的选择相对较少,也未对损伤后各期的变化趋势进行深入分析。 在本研究中,模型组IGF21表达强度的变化呈现倒“V”形,并可区分为不同水平的3个阶段,这是否意味着IGF21在损伤修复的不同阶段可能起着不同的作用?罗丽等[6]对大鼠急性骨骼肌钝挫伤后肌卫星细胞增殖规律的研究表明,肌卫星细胞增殖在损伤后第1天出现,在损伤后第3天达到高峰,损伤后第7天已下降至略高于损伤后第2天的水平,损伤后第14天,损伤肌组织中肌卫星细胞PCNA阳性核偶见,损伤后第21、28天,PCNA表达为阴性。因此,我们推测,在损伤后第1~7天,IGF21的主要作用是促进肌卫星细胞增生、分化,在损伤后第14~21天,肌卫星细胞增生、分化已经完成,此期主要发生新生肌纤维体积增大,在这一阶段,IGF21的主要作用是通过促进肌纤维增加蛋白和DNA合成[12,35],从而促进新生肌纤维进一步成熟。但是,在骨骼肌损伤修复的后期(塑型期),肌卫星细胞的增生、分化已经完成,适度的IGF21可促进新生骨骼肌纤维的成熟,但如果IGF21表达失控,或在此阶段过量使用IGF21,除了诱发肌肉肥大,还可能诱导胶原纤维的过度增生。有证据表明,IGF21作为一种生长因子,参与肺纤维化[13,16]、肝纤维化[8]的形成,在肌腱损伤的修复[15]以及腰椎退变[5]等的发生过程中,能促进胶原合成。笔者认为,IGF21虽然是促进骨骼肌再生的主要生长因子,但其在调节细胞外基质胶原再生方面的作用亦不容忽视,可能对成纤维细胞的增殖也起促进作用。在本研究中, IGF21的阳性面积百分比呈现持续增加,在损伤后第28天达到高峰,并且大量地分布于增生的结缔组织;此外, IGF21表达强度在第3期也处于相当高的水平,因此,笔者认为,骨骼肌纤维化的形成与组织塑型期IGF21的过度表达有密切关系。 TGF2 β1在体内能调节多种组织的生物学过程,其最终效应受到细胞间微环境的控制。在骨骼肌发育的过程中,TGF2 β1能调节成肌发生,阻止成肌细胞过早分化,帮助发育肌肉的正常形成[22]。本研究结果显示,TGF2 β1在正常青年大鼠肌组织中也有表达,棕褐色阳性颗粒主要分布于胞浆、肌膜。阳性细胞主要分布在肌束膜周围,以连接部位着色最强。这表明TGF2 β1在维持正常肌组织的代谢方面起作用(可能与肌内膜、肌束膜处I型、III型胶原纤维的表达有关)。 模型组损伤后各时间点TGF2 β1表达均显著高于对照组,呈现“V”字形变化,TGF2 β1表达强度的峰值点在损伤后第28天。有序样品聚类分析结果表明,模型组TGF2 β1变化也分为3个时期:损伤后第1~2天为第1期,损伤后第3~14天为第2期,损伤后第21~28天为第3期,其中第2期最低。在损伤后第1~2天,损伤区域肌细胞大量变性、坏死,TGF2 β1阳性表达主要出现在炎性细胞浸润比较集中的区域(图14、图15)。研究表明,无论是离心收缩、毒素注射还是挤压伤动物模型,均发现在骨骼肌损伤后的48 h内,TGF2 β1的转录和翻译水平上升[34]。骨骼肌损伤后的炎症反应是修复不可或缺的重要阶段,其中主要包括巨噬细胞、TGF2 β1和COX22信号通路的参与[32]。Shen W等[32]的研究表明,清除巨噬细胞将导致骨骼肌再生下降,而TGF2 β1促进巨噬细胞浸润,这一效应是通过COX22信号通路介导的。新型凋亡分子TNF2like weak in2 ducer of apoptosis(TWEAK)是一个新近发现的促炎性细胞因子,转化生长因子激活激酶21(TGF2 βactivated kinase 1, TAK1)是TGF2 β1的下游因子,Kumar M等[23]的研究表明,TAK1是TWEAK诱导的促炎性信号通路和基因表达的重要成分。因此,笔者认为,在损伤修复的早期阶段, TGF2 β1是参与炎症反应的重要因子,其适度表达有助于肌肉再生。 损伤后第3~14天,模型组TGF2 β1的表达强度低于损伤后第1~2天,但仍显著高于对照组(P<0.05)。以往的研究认为,TGF2 β1是强大的负性肌肉再生调节因子[12,19],能诱导成肌细胞分化为成纤维细胞[25],是骨骼肌纤维化的始动因子。但TGF2 β1在修复期再生肌细胞中持续表达上调,除了与细胞外间质的再生有关以外,是否与骨骼肌细胞的分化有关?Bhatnagar S等[10]的研究支持我们的观点。Bhatnagar S等[10]发现,TGF2 β1的下游因子TAK1在增生的C2C12成肌细胞中表达,其水平在成肌细胞分化为肌管的过程中下降。TAK1负性基因突变或敲除能抑制C2C12成肌细胞的增生和分化。敲除TAK1也抑制MyoD诱导的小鼠胚胎纤维母细胞向肌管的转化。抑制TAK1能下调肌细胞分化相关的P38有丝分裂原激活的蛋白激酶(mitogen2activated protein kinase,AMPK)和蛋白激酶Akt。TAK1也参与IGF21诱导的成肌分化。总之,Bhatnagar S等[10]的结果提示,TAK1是骨骼肌细胞分化的重要的上游调节因子,是分化的成肌细胞表达成肌调节因子必需的。因此,笔者认为,在损伤后第3~14天, TGF2 β1的表达上升可能与其参与成肌分化有关。 在本研究中,笔者观察到,在损伤区域新生肌细胞和间质均可见大量棕黄色至棕褐色TGF2 β1阳性颗粒(图17、18、19、20),并且间质的阳性表达逐渐由弥散性分布转为条索状分布。骨骼肌损伤的康复除了包括骨骼肌细胞的再生以外,还包括细胞外间质的再生与修复。推测, TGF2 β1在损伤后细胞外间质的修复方面发挥关键作用,并主要与I型胶原的增生有关(I型胶原呈致密的长束状[18])。但在损伤后第21~28天,细胞外间质的修复已基本完成,若此时发生TGF2 β1过度表达,将导致细胞间质胶原纤维增生,引发纤维化和疤痕形成。在本研究中,损伤后第21~28天TGF2 β1的表达分布百分比处于高水平,并且在增生的结缔组织大量表达,表达强度则在第3期持续增加,并在损伤后第28天达到高峰,这表明,在组织塑型期,可能存在TGF2 β1的过度表达。 根据以上分析,本研究结果部分地解释了外源性IGF2 1或IGF21转基因靶向治疗、抑制TGF2 β1激活的信号通路等疗法的副作用的发生原因,为深入认识IGF21、TGF2 β1在骨骼肌损伤修复过程中的作用与机制提供了新的思路。 IGF21、TGF2 β1在骨骼肌纤维化形成过程中均高水平表达,二者共同参与骨骼肌损伤的修复过程,但在损伤过程的不同时相,二者可能分别起着不同的作用:在损伤期和修复期,二者可能共同参与骨骼肌再生和细胞外基质再生,并且可能存在协同作用;在组织塑型期,IGF21、TGF2 β1均高水平表达于细胞间质(特别是增生的结缔组织),二者可能共同参与了骨骼肌纤维化的形成。 [1]董宇,陈世益,李云霞,等.丹参注射液对大鼠骨骼肌急性钝挫伤后生物力学指标的影响[J].复旦学报(医学版),2009,36(1): 53256. [2]高惠璇.应用多元统计分析[M].北京:北京大学出版社,2005: 2522259. [3]李宏云,陈世益,张健,等,黄芪皂甙与丹参酮ⅡA对大鼠骨骼急性钝挫伤后生长因子表达的影响[J].复旦学报(医学版),2011, 38(1):47250. [4]李云霞,陈世益,马昕,等.骨骼肌损伤修复过程中组织胰岛素样生长因子的表达[J].中国运动医学杂志,2001,20(2):1712173. [5]刘瑞,赵建民,杨勇,等.腰椎退变黄韧带中BMP22、TGF2 β、IGF2 I的表达及意义[J].内蒙古医学院学报,2009,31(5):4482451. [6]罗丽,张林,董宇.低功率激光照射对急性骨骼肌钝挫伤大鼠肌卫星细胞增殖活性的影响[J].体育科学,2007,27(7):55258. [7]罗丽,张林,孙中文,等.低功率激光照射促进大鼠急性骨骼肌钝挫伤肌肉再生[J].苏州大学学报(医学版),2008,28(6):8892 892. [8]阮水良,刘德许,王波,等.血吸虫性肝纤维化患者胰岛素样生长因子21与肝功能间的关系[J].检验医学,2010,25(1):17220. [9]ADAMS G R,MCCUE S A.Localized infusion of IGF2I results in skeletal muscle hypertrophy in rats[J].J Appl Physiol,1998, 84(5):171621722. [10]BHATNAGAR S,KUMAR A,MAKONCHU K D Y,et al. Transforming growth factor2beta2activated kinase 1 is an es2 sential regulator of myogenic differentiation[J].J Biol Chem, 2010,285(9):640126411. [11]CHAN Y S,LI Y,FOSTER W,et al.Antifibrotic effects of suramin in injured skeletal muscle after laceration[J].J Appl Physiol,2003,95(2):7712780. [12]CHARG∗S B,RUDNICKI M A.Cellular and molecular regu2 lation of muscle regeneration[J].Physiol Rev,2004,84(1): 2092238. [13]CHOI J E,LEE S S,SUNDE D A,et al.Insulin2like growthfactor2I receptor blockade improves outcome in mouse model of lung injury[J].Am J Respir Crit Care Med,2009,179(3):2122 219. [14]DENTON C P,MERKEL P A,FURST D E,et al.Recombi2 nant human anti2transforming growth factor beta1 antibody therapy in systemic sclerosis:a multicenter,randomized,place2 bo2controlled phase I/II trial of CAT2192[J].Arthritis Rheum, 2007,56(1):3232333. [15]DOESSING S,HOLM L,HEINEMEIER K M,et al.GH and IGF1 levels are positively associated with musculotendinous collagen expression:experiments in acromegalic and GH defi2 ciency patients[J].Eur J Endocrinol,2010,163(6):8532862. [16]FEGHALI2BOSTWICK C A.IGF2I:mediator of fibrosis or car2 cinogenesis?[J].Am J Physiol Lung Cell Mol Physiol,2005, 288(5):L8032804. [17]FOSTER W,LI Y,USAS A,et al.Gamma interferon as an an2 tifibrosis agent in skeletal muscle[J].J Orthop Res,2003,21 (5):7982804. [18]HIROSE T,NAKAZATO K,SONG H,et al.TGF2beta1 and TNF2alpha are involved in the transcription of type I collagen alpha2 gene in soleus muscle atrophied by mechanical unloading [J].J Appl Physiol,2008,104(1):1702177. [19]HUARD J,LI Y,FU F H.Muscle injuries and repair:current trends in research[J].J Bone Joint Surg Am,2002,842A(5): 8222832. [20]K M Chan,Freddie Fu,et al.骨科运动医学的最新观点与争论[M].刘亚波等译.北京:北京医科大学出版社,2002:3712374. [21]KAMI K,MASUHARA M,KASHIBA H,et al.Changes of vinculin and extracellular matrix components following blunt trauma to rat skeletal muscle[J].Med Sci Sports Exe,1993,25 (7):8322834. [22]KOLLIAS H D,MCDERMOTT J C.Transforming growth fac2 tor2beta and myostatin signaling in skeletal muscle[J].J Appl Physiol,2008,104(3):5792587. [23]KUMAR M,MAKONCHU K D Y,LI H,et al.TNF2like weak inducer of apoptosis(TWEAK)activates proinflammatory sig2 naling pathways and gene expression through the activation of TGF2beta2activated kinase 1[J].J Immunol,2009,182(4): 243922448. [24]LAURA PELOSI,CRISTINA GIACINTI,CHIARA NAR2 DIS,et al.Local expression of IGF21 accelerates muscle regen2 eration by rapidly modulating inflammatory cytokines and che2 mokines[J].FASEB J,2007,21:139321402. [25]LI Y,FOSTER W,DEASY B M,et al.Transforming growth factor2beta1 induces the differentiation of myogenic cells into fi2 brotic cells in injured skeletal muscle:a key event in muscle fi2 brogenesis[J].Am J Pathol,2004,164(3):100721019. [26]LI Y,LIJ,ZHU J,et al.Decorin gene transfer promotes muscle cell differentiation and muscle regeneration[J].MolTher, 2007,15(9):161621622. [27]PATEL S,CHUNG S H,WHITE G,et al.The“atheroprotec2 tive”mediators apolipoproteinA2I and Foxp3 are over2abundant in unstable carotid plaques[J].Int J Cardiol,2010,145(2):1832 187. [28]QUINTERO A J,WRIGHT V J,FU F H,et al.Stem cells for the treatment of skeletal muscle injury[J].Clin Sports Med, 2009,28(1):1211. [29]RABINOVSKY E D,GELIR E,GELIR S,et al.Targeted ex2 pression of IGF21 transgene to skeletal muscle accelerates mus2 cle and motor neuron regeneration[J].FASEB J,2003,17(1): 53255. [30]RAO V P,BRANZOLI S E,RICCI D,et al.Recombinant ade2 noviral gene transfer does not affect cardiac allograft vasculopa2 thy[J].J Heart Lung Transplant,2007,26(12):128121285. [31]SATO K,LI Y,FOSTER W,et al.Improvement of muscle healing through enhancement of muscle regeneration and pre2 vention of fibrosis[J].Muscle Nerve,2003,28(3):3652372. [32]SHEN W,LI Y,ZHU J,et al.Interaction between macropha2 ges,TGF2beta1,and the COX22 pathway during the inflamma2 tory phase of skeletal muscle healing after injury[J].J Cell Physiol,2008,214(2):4052412. [33]SHI X,GARRY D J.Muscle stem cells in development,regen2 eration,and disease[J].Genes Dev,2006,20(13):16692216708. [34]SMITH C A,STAUBER F,WATERS C,et al.Transforming growth factor2beta following skeletal muscle strain injury in rats[J].J Appl Physiol,2007,102(2):7552761. [35]TEN BROEK R W,GREFTE S,VON DEN HOFF J W.Regu2 latory factors and cell populations involved in skeletal muscle regeneration[J].J Cell Physiol,2010,224(1):7216. [36]WICK G,BACKOVIC A,RABENSTEINER E,et al.The im2 munology of fibrosis:innate and adaptive responses[J].Trends Immunol,2010,31(3):1102119. The Expression of IGF21 and TGF2 β1 LUO Li1,ZHANG Jian2,DONG Yu3,SUN Zhong2wen4, G804.7 A 2011207225; 2011210220 国家自然科学基金(60878061),苏州市体育局局管课题(TY220102101)资助。 罗丽(19752),女,安徽人,博士,副教授,硕士研究生导师,主要研究方向为运动医学,E2mail:luoli@suda.edu. cn。 11苏州大学体育学院,江苏苏州215021;21苏州大学 数学科学学院,江苏苏州215006;31复旦大学附属华山医院运动医学科,上海200040;41苏州市卫生职业技术学院,江苏苏州215104;51华南师范大学体育科学学院和民族体质与健康研究中心,广东广州510006 11School of Physical Education and Sports Science,Soo2 chow University,Suzhou 215021,China;21School of Methematics,SoochowUniversity,Suzhou 215006, China;31Department of Orthopaedics and Sports Medi2 cine,Huashan Hospital,Fudan University,Shanghai 200040,China;41Suzhou Health College of Vocational Technology,Suzhou 215104,China;51College of Sports Science and Research Center of Nationalistic Constitu2 tion and Health,South China Normal University,Guang2 zhou 510006,China. 图8 模型组损伤后第14天IGF21表达图10×10 Fig.8 The expression of IGF21 at the 14thday after contusion in the model group Abstract:Objective:To investigate IGF21 and TGF2 β1 simultaneously dynamic changes during the formation of the skeletal muscle fibrosis,aims to in2depth understanding of the mechanism of skeletal muscle fibrosis,and a theoretical and experimental basis for the prevention of fibrot2 ic diseases.Methods:54 male SD rats(180~220 g)were randomly divided into control group (n=6)and model group(n=48).Model group,according to the different sampling time points,were further divided into:1,2,3,7,14,21,28 days after injury group(n=6).Acute skeletal muscle contusions were made using a blunt object in the rats of model group.Immuno2 histochemistry technique was used to investigate the expression of IGF21 and TGF2 β1 during the formation of skeletal muscle fibrosis.Sequential Sample Cluster Analysis was used to divide the changes into different phases.Results:1)The expression IGF21 in the injured region in model group increased continually.Besides in the regenerative muscle fibers,IGF21 could be seen in granular tissue and connective tissue,especially during the fibrotic period.The expres2 sion intensity of IGF21 in the model group showed a reverse“V”shape,and could be divided into three phases:phase 1:from the 1st to 7th day after injury;phase 2:from the 14th day to the 21st day after injury;phase 3:the 28th day after injury.2)The expression of TGF2 β1 in the injured region in model group increased significantly,TGF2 β1 expression could be seen both in the newborn muscle cells and the intracellular substance.The expression intensity of TGF2 β1 could showed“V”shape change and also be divided into three phases:phase 1:from the 1st to the 2nd day after injury for,phase 2:from the third to the 3rd to 14th day after in2 jury;phase 3:from 21st to 28th day after injury.Conclusion:Both IGF21 and TGF2 β1 in2 creased during the process of skeletal muscle fibrosis,they could play different roles in the dif2 ferent phases during the repair process of skeletal muscle injury.Both IGF21 and TGF2 β1 were expressed in extracellular substance(especially in the fibrotic tissue),which indicated that theywere both involved in the formation of skeletal muscle fibrosis. Key words:skeletal muscle f ibrosis;insulin2like growth f actor21;transf orming growth f ac2 tor2 β1
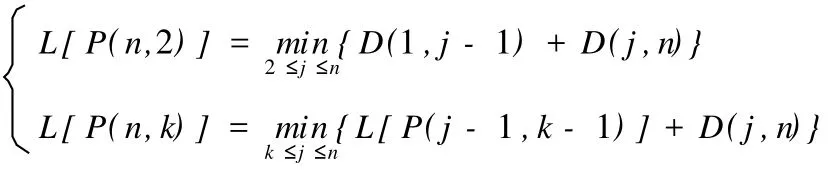




3 讨论
4 结论
in the Formation of Rat Skeletal Muscle Fibrosis
LI Xiao2ning4,LU A2ming1,LIU Cheng2yi5

