铁氰化钴/铜复合膜修饰电极的制备及其对肼的电催化
王飞,于浩,金君,宋诗稳,廉园园,刘珍叶,齐广才
铁氰化钴/铜复合膜修饰电极的制备及其对肼的电催化
王飞,于浩,金君,宋诗稳,廉园园,刘珍叶,齐广才*
(延安大学化学与化工学院,陕西延安716000)
采用循环伏安法制备了铁氰化钴/铜(Cu/CoHCF)复合膜化学修饰电极,研究了该修饰电极的电化学性质及电催化活性。结果表明,复合物不是铁氰化钴(CoHCF)与铁氰化铜(CuHCF)的简单混合物,而是钴、铜共沉积形成的多核铁氰化物。该电极对肼具有良好的电催化活性。在优化条件下,安培法检测肼的线性范围为4.6×10-6~4.4×10-2mol·L-1,检测限(3Sb,n=11)为8.0×10-7mol·L-1,灵敏度为143.1"A·(mmol·L-1)-1。该法已用于模拟水样中肼含量测定。关键词:化学修饰电极;铁氰化钴/铜复合膜;肼;电催化
多核金属铁氰化物(polynuclear metal hexacyanoferrates,MHCF)是一类重要的微溶混合价态金属化合物。作为电子递质,因其具有良好的电化学可逆性和高度的稳定性而引起人们的广泛关注,并在电化学传感器、电致变色、离子选择性电极、固体电解质电池等[1-5]众多领域得到广泛应用。特别是利用此类物质制备修饰电极以提高其电催化活性和选择性已有不少报道。关于单一过渡金属铁氰化物如PB[6-7]、CuHCF[8-9]、NiHCF[10-11]、CoHCF[12-13]等化学修饰电极的制备及应用已有不少报道。
最近,通过制备混合金属铁氰化物修饰电极以进一步提高其稳定性与电催化活性的研究引起了人们的重视。刘海燕等[14]采用电化学方法制备了Ag/NiHCF混合金属铁氰化物膜,研究结果表明,Ag/NiHCF混合物修饰电极不仅稳定性显著增加,且对肼有显著的催化作用。Kulesza[15-16]等采用电化学方法分别制备了Ni/PdHCF,Co/NiHCF混合金属铁氰化物膜并研究了其电化学性质。Lin[17]等制备了Cu/CoHCF混合金属铁氰化物修饰玻碳电极并研究了其对H2O2的电催化活性。
本文以复合陶瓷碳电极为基础电极,采用电化学方法制备了Cu/CoHCF复合金属铁氰化物修饰电极,研究了该修饰电极的电化学性质及对肼的电催化活性。结果表明,该修饰电极具有良好的稳定性和电催化活性。
1 实验部分
1.1仪器与试剂
LK98BII微机电化学分析系统(天津市兰力科化学电子高技术有限公司)。三电极系统,以Pt丝电极为对电极,饱和甘汞电极(SCE)为参比工作电极,修饰电极为工作电极。文中所有电位值均是相对于饱和甘汞电极的电位。
甲基三甲氧基硅烷(MTMOS,杭州硅宝化工);高纯石墨粉(国药集团化学试剂有限公司,光谱纯);硫酸肼(西安化学试剂厂,AR),其他试剂均为分析纯,实验用水为去离子水。
1.2 修饰电极的制备
复合陶瓷碳电极(composite ceramic carbon electrode,CCE)参考Lev[18]等人的工作制备。将处理好的CCE电极置于0.10 mol·L-1KCl+2.0 mmol· L-1K3[Fe(CN)6]+1.0 mmol·L-1CuSO4+1.0 mmol·L-1Co(NO3)2+2.0 mmol·L-1EDTA(pH=2)溶液中,采用循环伏安法在1.1~0.0 V电位范围内以50 mV·s-1的扫速循环扫描20圈。取出电极后用二次蒸馏水充分冲洗,室温晾干,记为Cu/CoHCF/ CCE。按相同的方法制备CoHCF和CuHCF修饰电极,并分别记为CoHCF/CCE和CuHCF/CCE。
1.3 实验方法
循环伏安实验:在不同浓度N2H4的0.10 mol· L-1KCl溶液中以不同的扫速记录一定电位范围内的循环伏安图。
i-t曲线法:在0.10 mol·L-1KCl溶液中,控制电位为0.72 V,转速200 r/min,待电流基线稳定后,每隔一定时间加入一定浓度N2H4,记录i-t曲线。
2 结果与讨论
2.1 Cu/CoHCF/CCE复合膜的电沉积
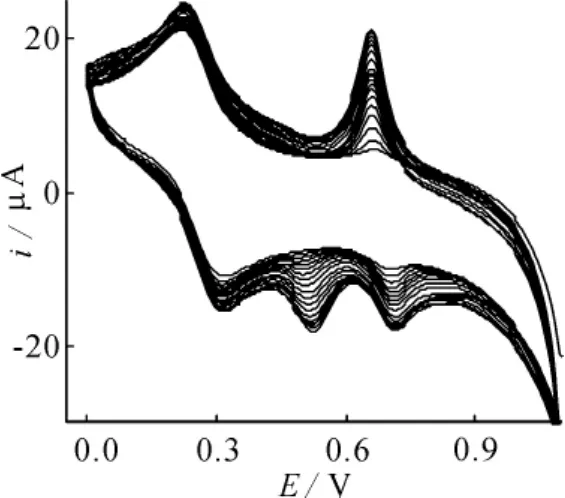
图1电化学沉积Cu/CoHCF/CCE时的循环伏安图(v=50 mV·s-1)
图1 为电化学沉积Cu/CoHCF复合膜时的循环伏安图。由图可见,当控制电位范围为0.0~1.1V (vs·SCE)时,从第二圈开始,循环伏安图上0.65 V,0.57 V和0.73 V处分别出现了一个氧化峰和两个还原峰。随着电位扫描圈数的增加,上述氧化还原峰峰电流不断增加。沉积后电极表面生成一层均匀致密的粉红色薄膜。以上实验结果表明,随着扫描圈数的增加,Cu/CoHCF逐渐沉积于电极表面。循环伏安图上位于0.21 V与0.31 V处的氧化还原峰是溶液中Fe(CN)64-/Fe(CN)6
3-电对的氧化还原峰。
图2分别为在相同条件下制备的Cu/CoHCF/ CCE、CoHCF/CCE和CuHCF/CCE在0.10 mol·L-1KCl溶液中的循环伏安图。由图可见,三种修饰电极的循环伏安图明显不同。结合文献[14],本文中复合膜的形成机理可解释为:当沉积液中Cu2+和Co2+共存时,Cu2+进入了铁氰化钴的晶格结构中,发生了共沉淀,从而生成了铜/钴混合金属铁氰化物。
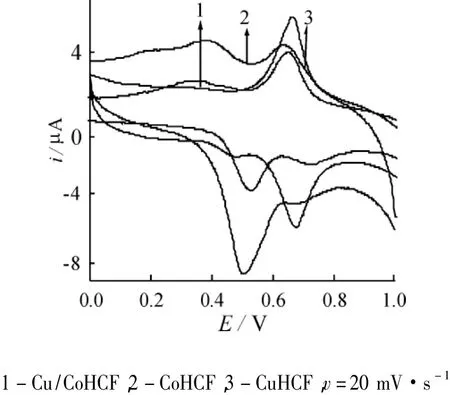
图2 不同修饰电极在0.10 mol·L-1KCl循环伏安图
2.2 Cu/CoHCF/CCE的电化学行为
2.2.1 扫速的影响
图3为Cu/CoHCF/CCE在0.10 mol·L-1KCl溶液中于不同扫速时的循环伏安图。由图可见,在10~120 mV·s-1的范围内,氧化还原峰峰电流均随扫速的增加而增加,峰电位随扫速的增加略有移动,且阴、阳极峰电流与电位扫描速率成正比,表明此电极过程为一表面吸附控制过程。
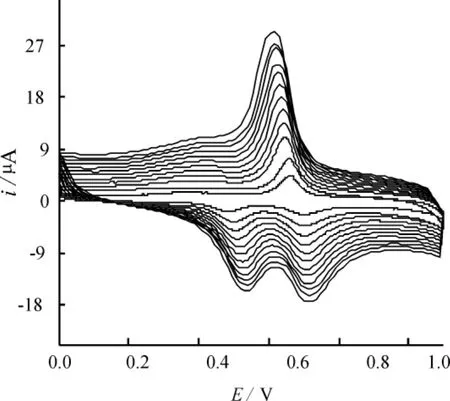
图3 Cu/CoHCF/CCE在不同扫速下的循环伏安图(v:10~120 mV·s-1)
2.2.2 支持电解质阳离子的影响
考察了碱金属阳离子Li+、Na+和K+对Cu/Co-HCF/CCE修饰电极电化学行为的影响。结果发现:该修饰电极在含Li+,Na+,K+离子的电解质溶液中均给出了相应的电化学响应,其中在K+离子的电解质溶液中循环伏安图上的氧化还原峰电流最大,阴、阳极峰电位差最小,且峰形最对称。因此,本文选择的支持电解质为KCl溶液。考察了KCl浓度的影响,结果表明,随着K+浓度的增大,氧化还原峰式量电位均朝正电位方向移动,且式量电位与K+浓度的对数呈线性关系,斜率为54.0 mV,该值与一电子一质子转移反应理论斜率58.5 mV接近,说明电极反应中伴随着一个电子和一个K+的传递。
2.3 Cu/CoHCF/CCE的电催化行为
采用循环伏安法研究了Cu/CoHCF/CCE对肼的电催化行为(图4)。图中曲线b和c分别为裸电极加入1.0×10-3mol·L-1N2H4前后的循环伏安图,曲线a和d分别为修饰电极加入1.0×10-3mol ·L-1N2H4前后的循环伏安图。通过对比可以看出,修饰电极对N2H4的电氧化具有显著的催化活性。循环伏安法测定N2H4的线性范围为9.9× 10-4~6.5×10-3mol·L-1,相关系数为0.9982。
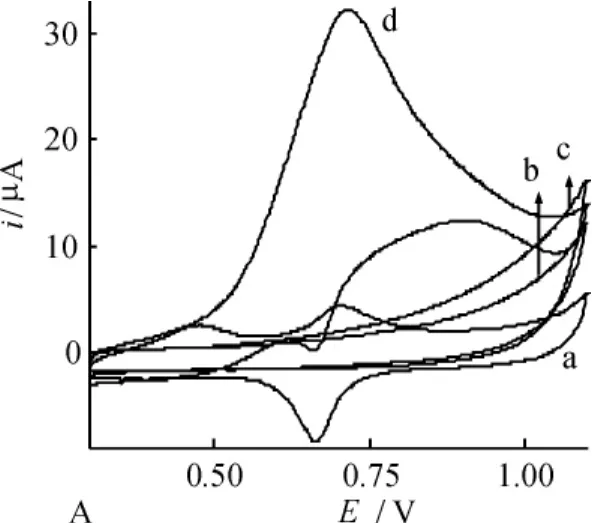
图4 裸CCE与Cu/CoHCF/CCE在加入N2H4前后的循环伏安图(20 mv·s-1)
3 安培法检测N2H4
3.1 工作电位的选择、线性范围及检出限
图5为0.10 mol·L-1KCl溶液中5.0×10-5mol·L-1N2H4在Cu/CoHCF/CCE修饰电极上的流体动力学伏安图。由图可见,当工作电位从0.0~0.78 V变化时,修饰电极对N2H4的电流响应先增大后基本不变,在0.72 V处电流响应达到最大,故选择0.72 V作为安培法检测N2H4的工作电位。控制工作电位为0.72 V,向不断搅拌(搅拌速度为200 rpm)的0.10 mol·L-1KCl溶液中加入N2H4并记录i~t曲线。图6为向不断搅拌的10.0 mL 0.10 mol ·L-1KCl溶液中每隔25 s加入20.0,50.0和100.0 μL 1.0×10-3mol·L-1;20.0,50.0和100.0 μL 1.0 ×10-2mol·L-1;20.0,50.0和100.0 μL 0.10 mol ·L-1N2H4时的动力学计时安培图。由图可见,i~t曲线上出现了良好的电流响应,随着N2H4的加入,电流随之以台阶状逐渐增加,符合稳态电流的特征,响应时间小于5 s。当N2H4的浓度在4.6×10-6~4.4×10-2mol·L-1范围内呈现出良好的线性关系,相关系数r=0.990,检出限为(3sb,n=11)8.0×10-7mol·L-1,灵敏度为143.1 μA·(mmol·L-1)-1。
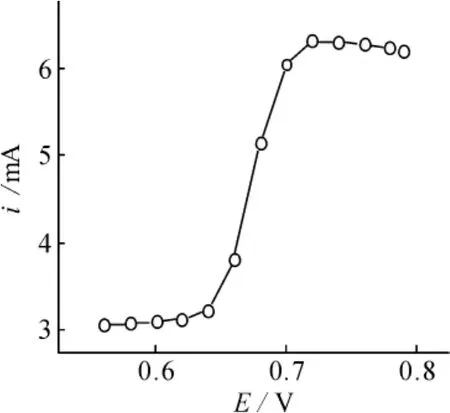
图5 N2H4在修饰电极上的动力学伏安图
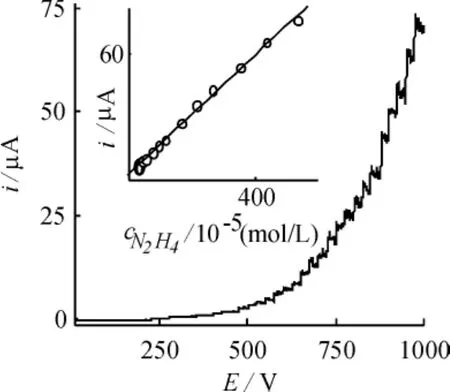
图6 修饰电极对N2H4的安培响应内插图:校正曲线
3.2 修饰电极的稳定性及重现性
在最佳实验条件下,用该电极连续平行测定10次1.0×10-3mol·L-1N2H4溶液,其相对偏差为3.2%。电极于室温下干态放置30天后再一次进行测试,其对N2H4溶液的响应电流几乎不变,表明该电极具有良好的稳定性和重现性。
3.3 干扰实验
在选定的实验条件下,对1.0×10-4mol·L-1的N2H4溶液进行了干扰试验。保持相对测量误差在±5%范围内,结果表明,200倍葡萄糖、维生素B、草酸、乳酸对N2H4测定均不产生干扰。其它常见的无机离子如锌、铜、镁、钙等也均对样品的测定无影响。
3.4 样品分析
取已知的适量肼加入到0.10 mol·L-1KCl溶液中,在优化实验条件下,按照实验方法进行测定,进行加标回收实验,分析结果见表1。
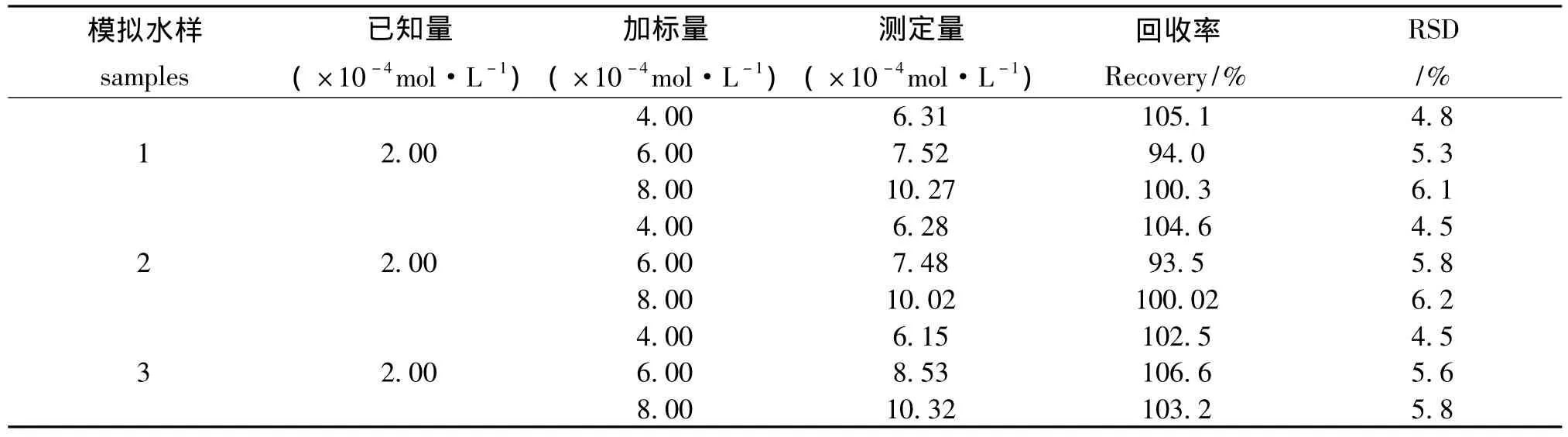
表1 加标回收实验
[1]Karyakin A.A,Karyakina E.E,Gorton L.On the mechanism of H2O2reduction at Prussian Blue modified electrodes[J].Electrochem Commun,1999,1(2):78-82.
[2]Wu X Q,Guo X M,Wang R,et al.Cholesterol biosensor based on platinium electrode modified by Prussian Blue[J].Anal Chem,2001,29(11):1273-1275.
[3]Ogura K,Nakayama M,Nakaoka K.Electrochemical quartz crystal microbalance and in situ infrared spectroscopic studies on the redox reaction of Prussian Blue[J].J Electroand chem,1999,474(2):101-106.
[4]Li F.B,Dong S J.The electrocatalytic oxidation of ascorbic acid on Prussian Blue file modified electrode[J].Electrochim Acta,1987,32(10):1511-1513.
[5]Xu J.J,Wang C,Chen H.Y.Electrochemical characteristics of nickel hexacyanoferrate monolayer anchoring to Bi-(2-aminoethyl)-aminodithiocarboxyl acid self-assembled film modified electode[J].Anal Sci,2000,16(2):231-233.
[6]Zhang Y,Luo H Q,Li N B.Hydrogen peroxide sensor based on Prussian blue electrodeposited on(3-mercaptopropyl)-trimethoxysilane polymer“modified”gold electrode[J].Bioprocess Biosyst Eng,2011,34:215-221.
[7]Razmi H,R.Mohammad-Rezaei,Heidari H.Self-Assembled Prussian Blue Nanoparticles Based Electrochemical Sensor for High Sensitive Determination of H2O2 in Acidic Media[J].Electroanalysis,2009,21(21):2355-2362.
[8]Ojani R,Raoof J B,Norouzi B.Cu(II)Hexacyanoferrate (III)Modified Carbon Paste Electrode;Application for Electrocatalytic Detection of Nitrite[J].Electroanalysis,2008,20(18):1996-2002.
[9]Wang J,Sancheznchez,Arribas A.Biocatalytically Induced Formation of Cupric Ferrocyanide Nanoparticles and their Application for Electrochemical and Optical Biosensing of Glucose[J].Small,2006,2(1):129-134.
[10]Krylov A V,Lisdat F.Nickel Hexacyanoferrate-Based Sensor Electrode for the Detection of Nitric Oxide at Low Potentials[J].Electroanalysis,2007,19(1):23-29.
[11]Prabakar S.J.R,Narayanan S.S.Catalytic Oxidation of Dopamine at a Nickel Hexacyanoferrate Surface Modified Graphite Wax Composite Electrode Coated with Nafion[J].Electroanalysis,2009,21(13):1481-1489.
[12]Xun Z Y,Cai C X,Lu T H.Effects of a Surfactant on the Electrocatalytic Activity of Cobalt Hexacyanoferrate Modified Glassy Carbon Electrode Towards the Oxidation of Dopamine[J].Electroanalysis,2004,16(8):674-683.
[13]Shi L H,Wu T,wang M J,et al.Molecule-Based Cobalt Hexacyanoferrate Nanoparticle:Synthesis,Characterization,and Its Electrochemical Properties[J].Chin J Chem,2005,23,149-154.
[14]刘海燕,王艳玲,张国荣.铁氰化镍/银复合无机膜修饰电极对肼的催化氧化作用[J].分析科学学报,2003,19(4):330-332.
[15]Kulesza P J,MalikM A,Skorek J,et al.Hybrid metal cyanometallates electrochemical charging and spectrochemical identity of heteronuclear nickel/cobalt hexacyanoferrate[J].J Electrochem Soc,1999,146(10):3757-3761.
[16]Kulesza P J,Jedral T,Galus Z.A new development in polynuclear inorganic films:Silver(I)/“crosslinked”nickel (Ⅱ)-hexacyanoferrate(Ⅲ,Ⅱ)microstructures[J].Electrochim.Acta,1989,34(6):851-853.
[17]Cui X P,Lin X Q.Hybrid copper-cobalt hexacyanoferrate films modified glassy carbon electrode as an electrochemical sensor for hydrogen peroxide[J].Anal Lett,2002,35 (4):663-675.
[18]Tsionsky M,Gun J,Glezer V,Lev O.Sol-gel-derived ceramic-carbon composite electrodes:introduction and scope of applications[J].Anal.Chem,1994,66(10): 1747-1753.
[责任编辑 李晓霞]
Preparation and Application of A Composite Copper/Cobalt Hexacyanoferrate Film Modified Electrode WANG FEI,YU HAO,JIN JUN,SONG Shi-wen,LIAN Yuan-yuan,
LIU Zhen-ye,QI Guang-cai*
(College of Chemistry and Chemical Engineering,Yan an University,Yan an 716000)
A Cu/CoHCF composite film chemically modified electrode was fabricated by using cyclic voltammetry.The electrochemical behavior and electrocatalytic activity of the resulting modified electrode were also investigated carefully.The experimental results showed that composite film is not the simple mixture of CoHCF and CuHCF,but a composite hexacyanoferrate film derived from the co-deposition of copper and cobalt ions.Additionally,this modified electrode exhibited high electrocatalytic activity towards the oxidation of hydrazine.Under the optimal conditions,the oxidation peak current showed a linear relationship with the concentration of hydrazine in the range of 4.6×10-6~4.4×10-2mol·L-1with a sensitivity of 143.1 μA·(mmol·L-1)-1and detection limit(3Sb,n =11)of 8.0×10-7mol·L-1,respectively.The proposed method was applied in the determination of hydrazine in stimulant water solution.
chemically modified electrode;Cu/CoHCF composite film;hydrazine;electrocatalysis
book=12,ebook=1
O657.1
A
1004-602X(2011)04-0046-05
2011-09-16
陕西省自然科学基金项目(2010JQ2005)和延安大学专项科研基金(YD-2007-7)
王飞(1984—),男,陕西铜川人,延安大学在读硕士研究生。*通讯作者

