我国部分地区传染性羊痒病基因型的分布情况调查
肖 妍,董志珍,栾慎顺,陈本龙
(天津出入境检验检疫局,天津 300461)
羊痒病(scrapie)是传染性海绵状脑病(TSE)的原型,是由羊痒病朊病毒引起成年绵羊和山羊的一种慢性进行性的、致死性神经系统疾病,能引起绵羊和山羊中枢神经系统发生退化变性,病羊具有中枢神经系统变性、空泡化、星形胶质细胞增生等特点,瘙痒是痒病的一个显著特征,此外, 共济失调、麻痹、衰弱、震颤、姿势不稳、痴呆、知觉过敏、行为异常等神经症状也是其主要的临床症状,死亡率达100%[1-3]。
羊痒病可通过病羊的肉骨粉等传染给牛,而使牛感染为疯牛病。人食用了被疯牛病病原污染的食品,可感染上传染性海绵状脑病—新变异型克雅氏病(即nvCJD)。因此,羊痒病的诊断是根除和控制疯牛病、克雅氏病的关键。而到目前为止,在检测疯牛病和羊痒病等方面开发出的免疫组织化学方法、免疫转印方法、组织印记法、ELISA方法、western-blot等方法均为死后诊断和确诊法,不利于本病的控制和根除[4-5]。
引起羊痒病的病原是一种无核酸的蛋白质侵染颗粒朊蛋白(Prion protein, PrP),是由宿主神经细胞表面正常的一种唾液酸糖蛋白(PrPc)在三级结构发生改变后形成的异常蛋白(PrPsc),由于英国“疯牛病”的发生使得此蛋白备受研究人员的关注[6-7]。
研究表明, 羊痒病的发生与绵羊朊蛋白编码基因PRNP遗传多样性密切相关,主要表现在绵羊PRNP第136、154和171位密码子组成的PRNP基因型与绵羊对痒病的抗病性相关[8-10]。患有TSE的病羊其基因组中的三个等位基因发生了突变,即136位点上的A突变成了V、154位点上的R基因突变成了H基因,171位点上的Q基因突变成了R或H,研究表明野生基因型ARR/ARR或ARR/ARQ是抗性基因型,具有此基因型的羊基本上不会感染TSE,而ARQ/ARQ、VRQ/ARQ、AHQ/VRH等其它基因型羊则为敏感型,易患TSE[11-13]。也有研究称含有杂合子VRQ/ARR基因型的羊感染了羊痒病,但是当有ARR等位基因和非VRQ等位基因伴随时,羊很少有感染羊痒病的报道。本研究旨在利用已建立的利用荧光定量PCR扩增反应进行单核苷酸多态性(SNP)快速分析的方法对羊痒病抗性基因进行筛选,对我国部分地区的羊痒病基因型分布情况进行调查,从而从品种选育水平上杜绝羊痒病的发生。
1 材料与方法
1.1 材料与试剂
各型绵羊PRNP基因标准品由意大利Institut zooprofi lattic sperimen DELLA SARDEGNA 惠赠 ;基因扩增预混液Taqman Universal PCR MasterMix购于Applied Biosystems试剂公司;基因组DNA提取试剂盒购于TIANGEN试剂公司。
1.2 绵羊基因组DNA的提取
按照TIANGEN血液基因组 DNA提取试剂盒说明提取。
1.3 荧光定量PCR检测
选 取 20 μL PCR 反 应 体 系 :2×mastermix:10μL;DNA:2 μL;上游引物(10 μM):2 μL;下游引物(10 μM):2 μL;FAM标记的探针(10 μM):0.5μL;VIC 标记的探针(10 μM):0.5 μL;双蒸水补齐至 20 μL。
样品放入Roche LightCycler 480荧光定量PCR扩增仪进行检测,其实时荧光定量PCR扩增程序如下 :50 ℃ 2 min ;95 ℃ 10 min ;95 ℃ 15 s,60 ℃ 1 min,共35~40个循环,每个循环延伸末期采集数据。
反应结束后立即进行终点读板分型,选择标记探针的两种检测信号FAM和VIC,程序如下:61 ℃预热1 s,60 ℃连续读板,同时收集5个信号。
机器将根据记录的数据将两种荧光信号进行比较计算,自动分型。
2 结果与分析
2.1 实时荧光定量PCR 的扩增
采用终点读板基因分型模式(Endpoint Genotyping)检测483~533 nm通道(FAM)和523~568 nm通道(VIC)的数据,经过计算比较二者的比值,得到基因分型散点图(见图1)。各标准品均按其基因型表现为纯合子(136AA、136VV、154RR、154HH、171RR、171HH、171QQ)及杂合子(136VA、154RH、171RH、171RQ和171HQ),说明引物及探针设计的特异性完全能够用于SNP快速分析。

2.2 样本检测结果
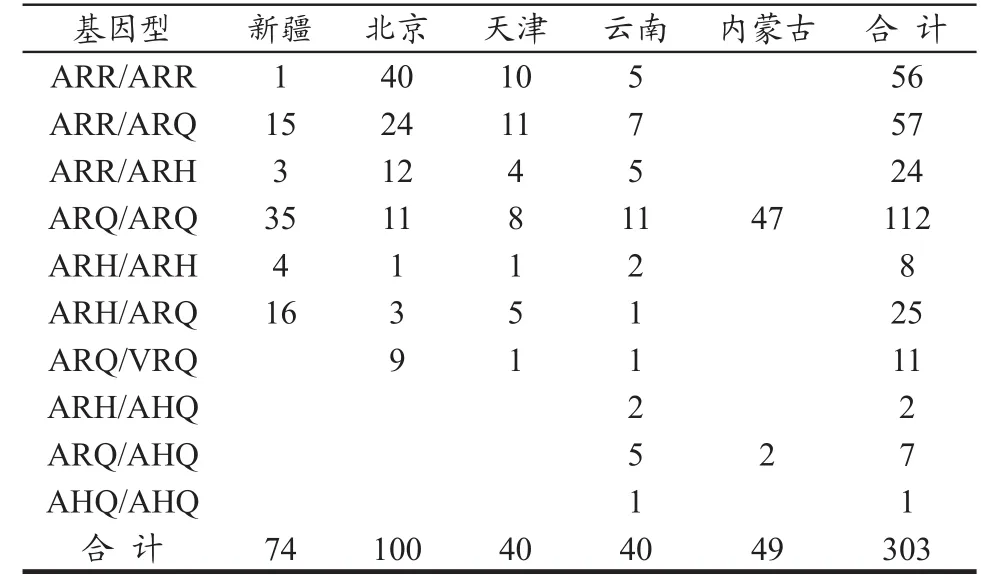
表 1 样本检测结果
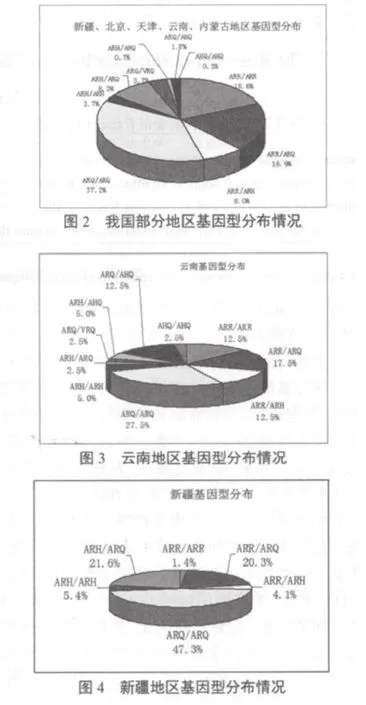
基因型分布情况见图2~7。
3 讨论
绵羊的基因型与发生羊痒病有着重要的关系,如表1所列[14]。
不同PrP基因型对羊痒病的敏感性不同,因此筛选出对TSE有抗性的羊群是控制和根除本病的关键,目前的科学研究表明野生基因型ARR/ARR或ARR/ARQ是抗性基因型,具有此基因型的羊基本上不会感染TSE,而ARQ/ARQ、VRQ/ARQ、AHQ/VRH等其它基因型羊则为敏感型,易患TSE,因此可根据朊蛋白的基因型而采取相应的措施和计划来控制羊痒病、疯牛病等。
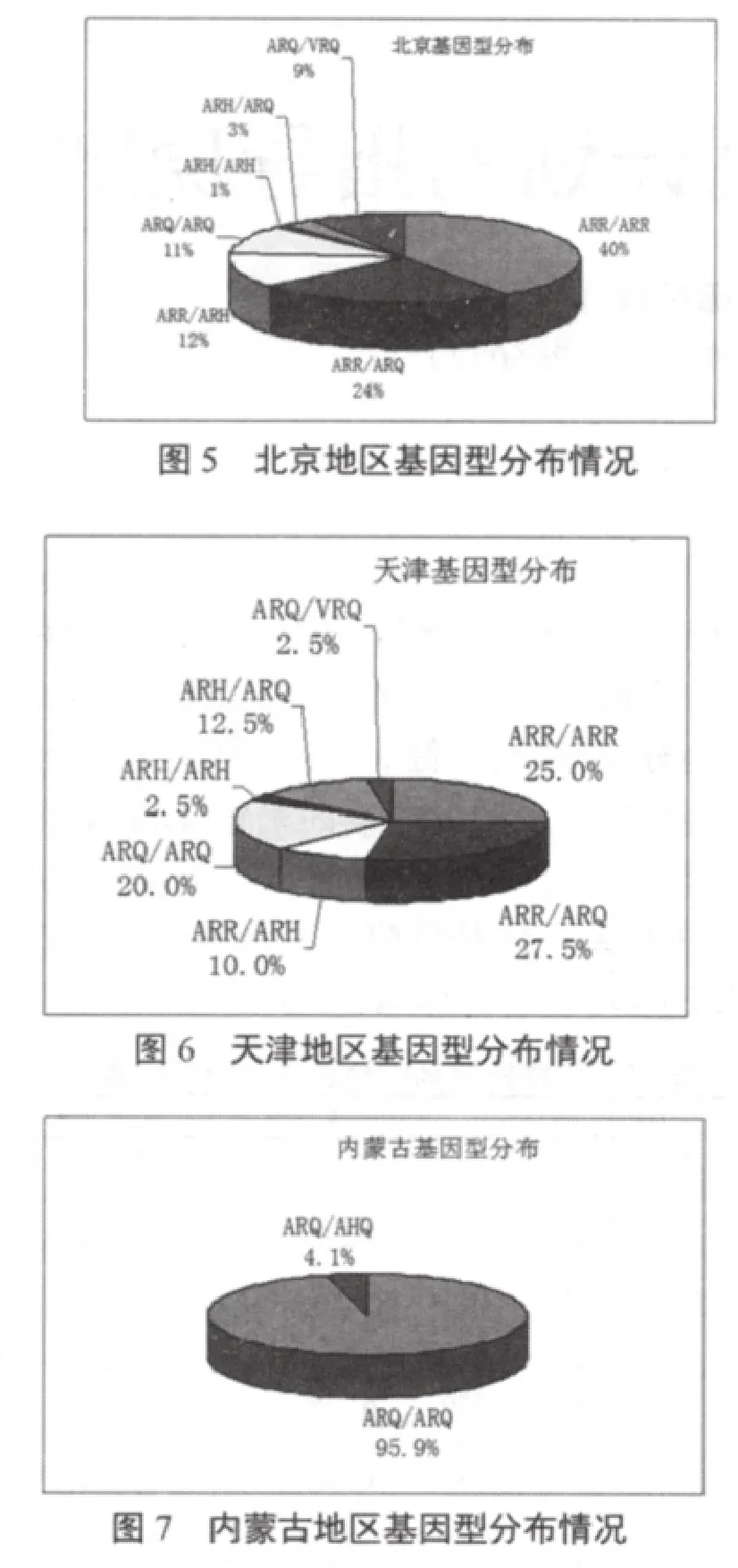
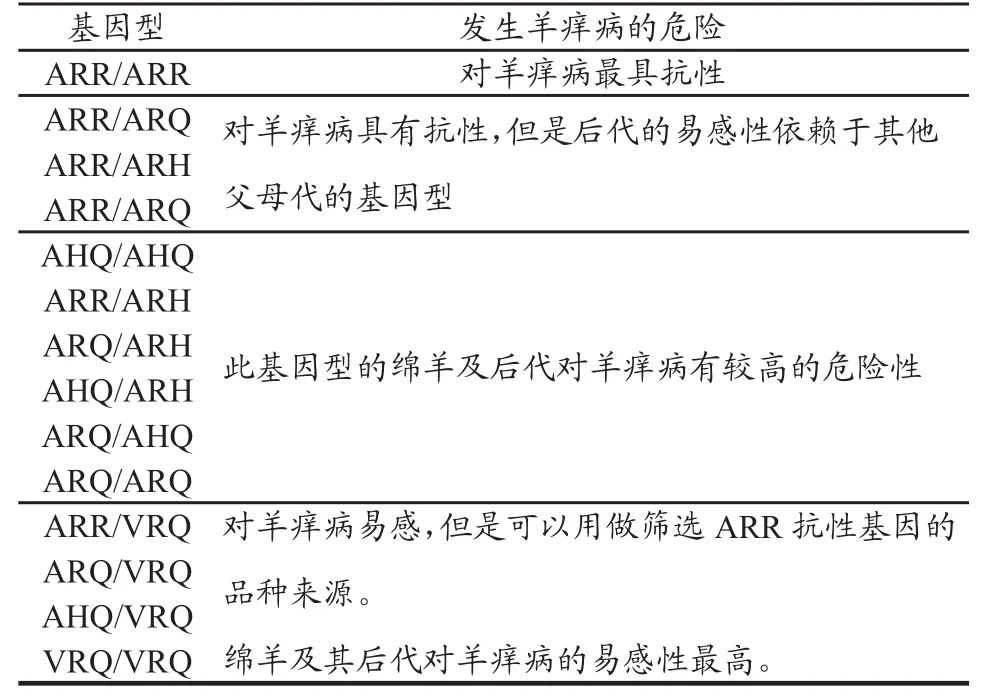
表 2 绵羊PrP基因型与羊痒病发生的危险性
经过我们对北京、天津、新疆、云南4个地区的254份无角多赛特绵羊血液样本进行基因分型试验,结果表明,ARR/ARR或ARR/ARQ抗性基因型所占比例为44%;基因型ARR/ARH 所占比例为9%,此基因型对羊痒病有抗性,但育种时要选育;对于羊痒病有高易感性的基因型ARQ/VRQ所占比例为4%,其中新疆所检74份样品中未检出,北京100份样品中检出9份,比例为9%,天津和云南所检40份样品中各检出1份,比例为2.5%。
对于羊痒病有较高易感性的基因型ARQ/ARQ,ARH/ARQ,ARH/ARH,ARH/AHQ,ARQ/AHQ,AHQ/AHQ所占比例分别为27%,10%,3%,1%,2%和0.4%,由此可见,我国以上四个地区的无角多赛特绵羊PrP基因型的分析可知,我国饲养的绵羊抗性基因型的比列占到了53%,一半以上的绵羊具有羊痒病抗性,可以用于育种和基因筛选;对于羊痒病有高易感性的基因型ARQ/VRQ所占比例为4%,对于此基因型的绵羊不能用于育种,应将羔羊宰杀或阎割;对于羊痒病有较高易感性的基因型占到了43%,对于此类型的绵羊对羊痒病有较小的抗性,可以卖掉或在某一阶段用于育种。
[1] Prusiner S B. The Prion Diseases[J]. Sci Am,1995,272(1):48-56.
[2] Aguzzi A,Heppner F. Pathogenesis of prion diseases: a progress report[J]. Cell Death Differ,2000,7(10): 889-902.
[3] Combrisson H,Robasine G,Brugere H,et al. Urodynamic parameters in scrapie-affected ewes and their modifi cations in the course of the disease[J]. Neurourology Urodyn,1998,17(5):555-563.
[4] Stanley B P . Prion Diseases and the BSE crisis[J]. Science,1997,78(10):245-251.
[5] Somerville R,Hamilton S,Fernie K.Transmissible spongiform encephalopathy strain,PrP genotype and brain region all affect the degree of glycosylation of PrPSc[J]. J Gen Virol,2005,86(1):241-246.
[6] Kazuhiko A,Noriyuki N,Suehiro S ,et al. Biological and Biochemical Characteristics of Prion Strains Conserved in Persistently Infected Cell Cultures[J]. J Virol,2005,79(11):7104-7122.
[7] Thierry B,Carole C,Anne-Gaёlle B. Molecular Analysis of the Protease-Resistant Prion Protein in Scrapie and Bovine Spongiform Encephalopathy Transmitted to Ovine Transgenic and Wild-Type Mice [J]. J Virol,2004,78(12):6243-6251.
[8] Vaccaria G,Contea M L,Morellia G,et al. Primer extension assay for prion protein genotype determination in sheep[J]. Mol Cell Probe,2004,18(1):33-37.
[9] Westaway D,Zuliani V,Cooper C,et al. Homozygosity for prion protein alleles encoding glutamine-171 renders sheep susceptible to natural scrapie [J]. Genes Dev,1994,8(8):959-969.
[10] Tranulis M A. Infl uence of the prion protein gene,Prnp, on scrapie susceptibility in sheep [J]. Apmis, 2002,110(1): 33-43.
[11] Buschmann A,Lühken G,Schultz J,et al. Neuronal accumulation of abnormal prion protein in sheep carrying a scrapie-resistant genotype (PrPARR/ARR)[J]. J Gen Virol,2004,85(9):2727-2733.
[12] Hamir A N, Kunkle R A, Richt J A, et al. Experimental transmission of sheep scrapie by intracerebral and oral routes to genetically susceptible Suffolk sheep in the United States[J]. J Vet Diagn Invest,2005,17(1):3-9.
[13] Baylis M, McIntyre K M. Transmissible spongiform encephalopathies:scrapie control under new strain[J]. Nature,2004,432(7019):810–811.
[14] Truls M,Ingrid O,Pitter H,et al.Polymorphisms at condons 141 and 154 in the ovine prion protein gene are associated with scrapie Nor98 cases. [J]. J Gen Virol,2005,86(5):231-235.
——防控专家访谈录

