精神分裂症患者外周多巴胺D2受体及转运体mRNA的表达
张会芳,袁国桢,刘新民
(1.皖南医学院 心理学教研室,安徽 芜湖 241002;2.无锡市精神卫生中心,江苏 无锡 214151)
精神分裂症是以思维、情感、行为之间不协调,精神活动和现实脱离为主要特征的一种常见精神病。精神分裂症是一种全球性疾病,发病率高且难以治愈,带给人们很大的经济负担。尽管该病的病因尚未阐明,但多巴胺系统的异常调控在精神分裂症的发病机制上一直处于主导地位[1],因此与多巴胺生物合成、代谢或应答有关的基因就成为了该病的候选基因。本研究以DRD2和DAT为目的基因,探讨外周血淋巴细胞DRD2和DAT的mRNA表达与精神分裂症的关联性。
1 对象与方法
1.1 研究对象 精神分裂症组(以下称患者组):共25例。入组标准:①符合美国精神障碍诊断与统计手册第4版(DSM-Ⅳ)中精神分裂症的诊断标准;②均为首发患者,既往未用过抗精神病药物、抗抑郁剂及情感稳定剂,且未做过电休克治疗;③女性处于非妊娠、非哺乳期及非月经期;④无重大躯体疾病、内分泌疾病、自身免疫性疾病;⑤近3月内未经输血治疗;⑥无物质依赖及滥用史;⑦自愿参加本研究,并由本人或法定监护人签署知情同意书。正常对照组28例。入组标准:①无精神疾病史、精神障碍家族史;②无重大躯体疾病、内分泌疾病、自身免疫性疾病;③无物质依赖及滥用史;④女性处于非妊娠、非哺乳期及非月经期;⑤自愿参加本研究并签署知情同意书;⑥与精神分裂症患者同一地区的无血缘关系的群体。
1.2 试剂与仪器 ①SV Total RNA Isolation System试剂盒(Promega公司,美国);②SV RNA RED BLOOD CELL Lysis Solution(Promega公司,美国);③Reverse Transcription System试剂盒(Promega公司,美国);④ABI7500型PCR仪(ABI公司,美国)。
1.3 方法
1.3.1 标本采集 所有研究对象空腹抽取肘静脉血1次2 ml,其中患者组采血须在治疗前。全部血液标本采集后3 h内进行总RNA的抽提。
1.3.2 阳性和阴性症状量表(PANSS)评定 在取血当天通过询问病史、精神检查,完成精神分裂症患者的PANSS评定。
1.3.3 总 RNA抽提 总 RNA抽提采用 SV Total RNA Isolation System试剂盒(美国Promega公司),紫外分光光度法测RNA的含量及纯度,普通琼脂糖凝胶电泳180 mV,35 min测其完整性。
1.3.4 逆转录反应 每样本取400 ng的总RNA,利用AMV逆转录酶(美国Promega公司)进行逆转录反应,合成的cDNA第1链于-70℃保存。
1.3.5 引物序列 DRD2引物:上游引物为5'-ACTGGCGAGCAGACG GGAGGACCC-3',下游引物为 5'-TGCGCGCGTGAGCTGCCGGTTCGG-3'。DAT引物:上游引物为5'-CAGCCTATGGAAGGGAGTAAA-3',下游引物为 5'-CAGGAAAGTAGCCAGGACAAT-3'。GAPDH:上游引物为 5'-GAAGATGGTGATGGGATTT-3',下游引物为5'-CAAGCTTCCCGTTCTCAGCC-3'。所有引物序列运用引物设计软件Primer Premier 5.00 设计,然后用 Oligo 6.69 软件验证,并在美国国立生物技术信息中心(NCBI)的基因库中比对后得出可行性序列。所有引物序列均由上海生物工程公司合成。
1.3.6 聚合酶链反应(PCR) ①25 μL PCR反应体系。Mix:12.5 μl;模板:4 μl;上游引物(10 μmol/L):1.75 μl;下游引物(10 μmol/L):1.75 μl;水:加水定容至25 μl。上述反应体系配置好后,混匀离心,然后放置于ABI 7500 PCR仪中。②PCR循环步骤及条件,见表1。
1.4 数据处理 运用SPSS 11.5统计软件包对数据进行统计学处理。患者组和对照组间各指标进行成组t检验,检验前先进行方差齐性检验;检测因素之间采用Spearman相关分析。所有检验均为双侧检验,数据均以±s表示,P<0.05认为差异具有统计学意义。
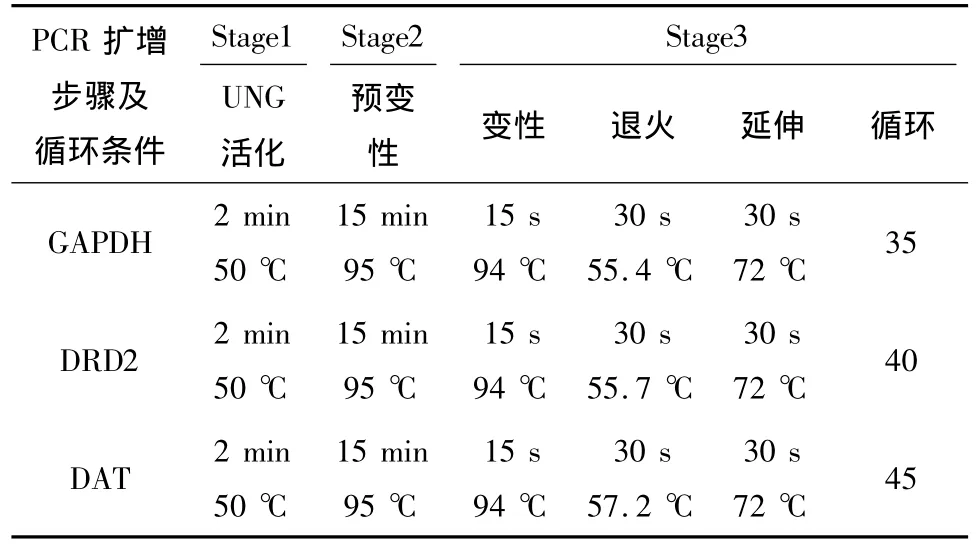
表1 PCR扩增循环步骤及条件
2 结果
2.1 比较CT值法(△△CT) 选取RNA样品模板进行100倍梯度稀释,DRD2、DAT与GAPDH分别进行RT-PCR反应,得出荧光曲线,通过RNA浓度梯度的log值对目的基因与内参基因的比较值(△CT)作图比较两基因扩增效率。RNA样品稀释100倍,对于每一个稀释样本,都用DRD2、DAT和GAPDH特异引物进行扩增。计算出DRD2、DAT和GAPDH的平均阈值(CT值)及△CT值,通过RNA浓度梯度的log值对△CT值作图,所得直线斜率分别为 0.0287、0.0312,绝对值均接近于 0,说明目标基因DRD2、DAT和内标基因的扩增效率相同,可以通过△△CT方法进行相对定量。
2.2 患者组与对照组DRD2与DAT基因表达水平的比较 本研究结果显示,患者组与对照组间DRD2基因表达水平有显著差异(P<0.05),而两组间DAT基因表达水平差异没有显著性(P<0.05),见表2。

表2 两组样本DRD2与DAT基因表达水平比较
2.3 患者组 DRD2、DAT基因表达水平与 PANSS量表评分的相关分析 本研究发现患者组DRD2与PANSS量表阳性症状分间存在正相关(P<0.05),其他指标之间未发现有相关性存在,见表3。
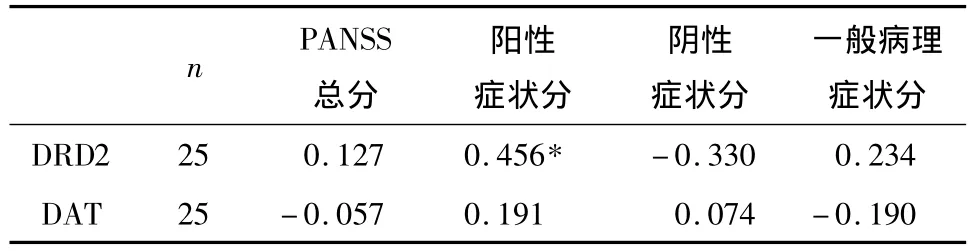
表3 患者组DRD2、DAT基因表达水平与PANSS量表评分的相关分析
3 讨论
在中枢组织中,多巴胺受体多集中在特定区域,局部密度高,而外周组织中的多巴胺受体则多分布弥散,局部数量远低于中枢,故用放射配体结合实验研究外周组织中多巴胺受体亚型定量是比较困难的。对于精神分裂症的外周组织的研究,以往的实验多采用ELISA、放免法(RLA)或生物测定法等对精神分裂症的生化指标进行检测。相同类型的实验结果多不一致,使得此类研究一直难有定论[2]。随着分子生物学技术的发展,国内外逐渐开始采用逆转录-聚合酶链式反应(RT-PCR)技术从转录层面来研究相关基因的mRNA表达情况和精神分裂症之间的关系。RT-PCR技术具有很高的灵敏性,通过使用特异性引物可获得较高的特异性。因此,本实验应用RT-PCR技术来分析精神分裂症患者与健康对照组外周血淋巴细胞DRD2及DAT的mRNA表达情况,测定外周组织DRD2、DAT表达和精神分裂症的关系。
3.1 DRD2基因表达与精神分裂症 本研究用定量RT-PCR研究发现:和健康人相比,精神分裂症患者外周血淋巴细胞DRD2表达增强。本研究血样是从首次发作的患者抽取的,这排除了药物对基因表达水平的影响。这一研究结果与Zvara等研究结果一致[3],该研究用RT-PCR和微阵列技术研究发现外周血淋巴细胞DRD2基因表达增强。
精神分裂症的主要假说是多巴胺系统功能紊乱,特别是多巴胺D2族受体占据增加[4],Roberts等用RT-PCR技术研究发现,精神分裂症患者DRD2基因的两种亚型在一些脑区域表达增强[5],Tallerico等用竞争性定量RT-PCR技术发现,服药或近期未服药的精神分裂症患者,死后前额皮层区域长型DRD2 mRNA表达水平增强[6]。精神分裂症患者尸检结果发现纹状体DRD2密度增高[7]。这说明外周血DRD2基因表达水平增强与脑部相应区域DRD2 mRNA表达结果一致,外周DRD2基因mRNA的表达情况可在某种程度上反映脑部DRD2 mRNA的表达情况,可作为精神分裂症的诊断和疗效评价的一个外周标记。
3.2 DAT基因表达与精神分裂症 有关多巴胺转运体的研究结果不一,中枢DAT研究显示精神分裂症多巴胺能系统功能改变不影响多巴胺转运体密度的变化[8],Laruelle等用SPECT研究发现精神分裂症纹状体转运体密度没有变化[9]。尸检研究也没发现精神分裂症纹状体转运体密度有变化。但Tatsch等用SPECT研究显示精神分裂症纹状体转运体密度比对照组低[10]。Laakso A等报道慢性精神分裂症患者的DAT表达减少[11,12],有研究报道初发精神分裂症患者多巴胺转运蛋白没有变化[13]。Hirai等报道尸体解剖发现精神分裂症患者的多巴胺转运蛋白密度没有变化[14]。有关外周血淋巴细胞中多巴胺转运体的研究不多,本研究发现精神分裂症患者外周血淋巴细胞DAT mRNA表达较正常对照组增强。
3.3 DRD2、DAT基因表达与临床症状的关系 本研究发现,精神分裂症患者DRD2 mRNA表达与PANSS量表阳性症状分呈正相关,与总分、阴性症状、精神病理学症状分无相关性存在。这说明DRD2 mRNA表达越强,精神分裂症患者症状越严重,阳性症状,包括幻觉、思维散漫、猜疑和妄想越严重,而对阴性症状和精神病理学症状无影响。有研究发现中枢DRD2增强与阳性症状关系密切[15],因此本结果与其研究结果一致。由于经典药物的疗效主要是通过DRD2介导,因此有学者认为阳性症状与DRD2的功能异常有关[15]。但没有发现 DAT mRNA表达与PANSS量表阳性症状、阴性症状、精神病理学症状及PANSS总分有相关性。
[1]TOST H,ALAM T,MEYER-LINDENBERG A.Dopamine and psychosis:Theory,pathomechanisms and intermediate phenotypes[J].Neurosci Biobehav Rev,2010,34:689 -700.
[2]BOWDEN NA,WEIDENHOFER J,SCOTT RJ,et al.Preliminary investigation of gene expression profiles in peripheral blood leukocytes in schizophrenia[J].Schizophrenia Research,2006,82:175-183.
[3]ZVARA A,SZEKERES G,JANKA Z,et al.Over-expression of dopamine D2 receptor and inwardly rectifying potassium channel genes in drug-naive schizophrenic peripheral blood lymphocytes as potential diagnostic markers[J].Disease Markers,2005,21:61 -69.
[4]ABI-DARGHAM A,RODENHISER J,PRINTZ D,et al.Increased baseline occupancy of D2 receptors by dopamine in schizophrenia[J].Proc Natl Acad Sci USA,2000,97:8104 -8109.
[5]ROBERTS D,BALDERSON D,PICKERING-BROWN SM,et al.The abundance of mRNA for dopamine D2 receptor isoforms in brain tissue from controls and schizophrenics[J].Brain Res Mol Brain Res,1994,25:173 -175.
[6]TALLERICO T,NOVAK G,LIU IS,et al.Schizophrenia:elevated mRNA for dopamine D2(Longer)receptors in frontal cortex[J].Brain Res Mol Brain Res,2001,87:160 -165.
[7]TAKAHASHI H,HIGUCHI M,SUHARA T,et al.The Role of Extrastriatal Dopamine D2 Receptors in Schizophrenia[J].Society of Biological Psychiatry,2006,59:919 -928.
[8]LAVALAYE J,LINSZEN DH,BOOIJ J,et al.Dopamine transporter density in young patients with schizophrenia assessed with[123]FP-CIT SPECT[J].Schizophrenia Research,2001,47:59 -67.
[9]LARUELLE M,ABI-DARGHAM A,GIL R,et al.SPECT measurements of transporters in schizophrenia(abstr)[J].Nucl Med,1996,37:33.
[10]TATSCH K,SCHERER J,LINKE R,et al.Decrease of dopamine transporter binding in neuroleptic free schizophrenic patients assessed with IPT-SPECT(abstr)[J].Nucl Med,1999,40:31.
[11]LAAKSO A,BERGMAN J,HAAPARANTA M,et al.Decreased striatal dopa2 mine transporter binding in vivo in chronic schizophrenia[J].Schizophr Res,2001,52:115 -120.
[12]BODEAU PS,LAURENT C,CAMPION D,et al.No evidence for linkage or association between the dopamine transporter gene and schizophrenia in a French population[J].Psychiatry Res,1995,59:1-6.
[13]LARUELLE M,ABI-DARGHAM A,GIL R,et al.SPECT measurements of dopamine transporters in schizophrenia[J].Nucl Med,1996,37:33.
[14]HIRAI M,KITAMURA N,HASHIMOTO T,et al.3HGBR-12935 binding sites in human striatal membranes:binding characteristics and changes in parkinsonians and schizophrenia[J].Pharmacol,1988,47:237 -243.
[15]GLENTHOJ BY,MACKEPRANG T,SVARER C,et al.Frontal dopamine D(2/3)receptor binding in drug-naive first-episode schizophrenic patients correlates with positive psychotic symptoms and gender[J].Biol Psychiatry,2006,60:621 -629.

