肿瘤靶向超顺磁氧化铁纳米粒的小鼠急性毒性与抗吞噬性评价
高文慧,范彩霞,陈志良(1.南方医科大学南方医院药学部,广州市510515;.广东省粤北人民医院药学部,韶关市5106)
超顺磁氧化铁纳米粒(Superparamagnetic oxide iron nanoparticles,SPIO-NPs)是一种新型的磁共振造影剂,由于其所特有的小粒子、超顺磁性和低毒性等特点,在磁靶向给药和热疗等方面也具有突出的优势。当SPIO-NPs的粒径小于100 nm时,能逃避肝、脾的吞噬,达到全身分布,此时的纳米粒能进入淋巴系统,被淋巴结内的巨噬细胞吞噬;如果发生肿瘤部位的淋巴结转移,吞噬了SPIO-NPs的淋巴结正常组织的T2信号值将下降,而肿瘤组织的T2信号值不变,从而准确判断肿瘤是否转移以及转移肿瘤的位置和大小。在以上SPIO-NPs的包被材料上嫁接肿瘤细胞表面某些特异性受体的配体后,SPIO-NPs就能特异性结合肿瘤组织,使其T2信号值下降,与周围正常组织分清界限,确定肿瘤边缘及大小[1]。本课题组(肿瘤靶向新型磁共振造影剂的研制与体内、外评价课题组)现已合成了超小粒径的SPIO-NPs,并包被以羧甲基壳聚糖,以提高其溶液的稳定性和亲水性,再在羧甲基壳聚糖上嫁接以叶酸,由于大部分肿瘤表面具有叶酸受体,嫁接了叶酸的SPIO-NPs在体内能靶向结合有叶酸受体的肿瘤组织,从而达到靶向造影肿瘤组织的目的[2]。本实验旨在评价叶酸-羧甲基壳聚糖-SPIO-NPs(Folic acid-O-carboxymethyl chitosans superparamagnetic oxide iron nanoparticles,FA-OCMCS-SPIO-NPs)和羧甲基壳聚糖-SPIO-NPs(O-carboxymethyl chitosans superparamagnetic oxide iron nanoparticles,OCMCS-SPIO-NPs)的急性毒性,以及以葡聚糖-SPIO-NPs(dextran-superparamagnetic oxide iron nanoparticles,dextran-SPIO-NPs)为不能逃避肝、脾吞噬的阳性对照,评价2种造影剂的抗吞噬性,为将来动物体内的更深入研究打好基础。
1 仪器与材料
1.1 仪器
HERMLE2360高速低温离心机(美国Thermo Scientific公司);超滤离心管(10 kD,德国Sartorius公司);CLZ型恒温磁力搅拌器(河南巩义予华仪器厂);SK5200HL型超声粉碎仪(上海科导超声仪器有限公司);Sephacrys-300HR凝胶(美国Pharmacia公司);透析袋(截留相对分子量8000~15000,上海源聚生物科技有限公司)。
1.2 试药
FA-OCMCS-SPIO-NPs、OCMCS-SPIO-NPs和dextran-SPIO-NPs均由南方医院药学部科研组自制,含量以铁浓度表示,分别为18.46、18.67、20.32 mg(Fe)·mL-1,经测定,3种纳米粒的强均粒径分别为41.4、38.2、125 nm。
FeCl3·6H2O、FeSO4·7H2O、氨水、无水乙醇、二甲苯、盐酸、甲醛和亚铁氰化钾(广州化学试剂有限公司);0.5%伊红溶液(凯基生物科技发展有限公司);葡聚糖(分子量40000)、碳二亚胺(美国Sigma公司);羧甲基壳聚糖(分子量10000~20000,脱乙酰化度≥93%,羧基取代度≥87%,青岛海普生物技术有限公司)。
1.3 动物
SPF级KM小鼠,体重(20±2)g,购自南方医科大学实验动物中心,合格证号:SCXK(粤)2006-0015。
2 方法
2.1 3种纳米粒的制备
2.1.1 OCMCS-SPIO-NPs的制备。取摩尔比2∶1的FeCl3·6H2O和FeSO4·7H2O,将二者溶解并混合,充氮搅拌下加适量氨水至pH约为11,升温反应1 h后磁性分离,并水洗4次,加入30 g·L-1碳二亚胺的磷酸盐缓冲溶液,超声分散,转入3%的羧甲基壳聚糖溶液中,超声反应1 h,产物离心30 min,取上清液过葡聚糖凝胶柱,收集首峰,蒸馏水透析24 h,超滤浓缩备用[3]。
2.1.2 FA-OCMCS-SPIO-NPs的制备。取蒸馏水透析过的OCMCS-SPIO-NPs,加一半体积的无水乙醇,高速离心,沉淀用无水乙醇、二甲亚砜各洗3遍,无水二甲亚砜超声分散备用。参考文献[4]方法合成叶酸活性酯,充氮加热下,将叶酸活性酯加入OCMCS-SPIO-NPs的无水二甲亚砜溶液中,反应4 h,产物蒸馏水透析24 h,超滤浓缩备用[2]。
2.1.3 dextran-SPIO-NPs的制备。将葡聚糖与摩尔比为2∶1的FeCl3·6H2O和FeSO4·7H2O充分混合,充氮搅拌下以碱性共沉淀法制备[5]。
2.2 急性毒性评价
取小鼠70只,分为空白组、FA-OCMCS-SPIO-NPs组和OCMCS-SPIO-NPs组,空白组10只,其它2组每组30只,♂♀各半。将2个给药组内的小鼠再平均分成高、中、低3个剂量组,每组10只,♂♀各半。有研究[6]发现,尾静脉给予昆明小鼠266.75 mg(Fe)·kg-1的SPIO-NPs后,出现短时少动现象,而最大给药剂量(438.5 mg(Fe)·kg-1)下,小鼠仍未出现死亡。本实验中SPIO-NPs经包被后理论上毒性会下降,故以278 mg(Fe)·kg-1为最低给药浓度,以1∶0.8为组间距设计3个浓度梯度组(即278、347.5、434.5 mg(Fe)·kg-1),尾静脉一次性给药后,观察14 d内小鼠的死亡、饮食和体重变化情况。空白组尾静脉注射0.5 mL生理盐水,14 d后处死,观察心、肝、脾、肺、肾并拍照。2个给药组存活小鼠14 d后处死,从高、中、低3个剂量组中各取几只小鼠解剖,观察心、肝、脾、肺、肾并拍照。
2.3 抗吞噬性评价
在1.68~2.52 mg(Fe)·kg-1的给药剂量下,超小SPIO-NPs(粒径小于100 nm)在人体内的t1/2(24~36 h)远高于动物(2~3 h),故动物实验多采用高剂量给药(11.2~56 mg(Fe)·kg-1)[1]。为了考察小鼠肝、脾对造影剂的吞噬作用,本实验中选取了较高的给药剂量(约56 mg(Fe)·kg-1)进行考察。
取♂小鼠20只,分成4组,每组5只,分别从尾静脉注射FA-OCMCS-SPIO-NPs(54.4mg(Fe)·kg-1)、OCMCS-SPIONPs(56.2 mg(Fe)·kg-1)、dextran-SPIO-NPs(57.6 mg(Fe)·kg-1)和生理盐水(0.2 mL)。24 h后,全部脱颈椎处死,取肝和脾于4%福尔马林溶液中固定24 h,石蜡包埋并做普鲁士蓝染色切片。以注射生理盐水的小鼠为阴性对照组,注射dextran-SPIO-NPs的小鼠为阳性对照组,依据肝、脾吞噬的SPIO纳米粒经普鲁士蓝染色后呈蓝色来评价2种造影剂抗肝、脾吞噬的能力。如果合成的2种纳米粒能逃避肝、脾的吞噬,则其与dextran-SPIO-NPs组相比,表现为染色后的切片上没有或者只有零星少许蓝色。
3 结果
3.1 急性毒性评价
FA-OCMCS-SPIO-NPs及OCMCS-SPIO-NPs的各给药剂量组相关情况如表1和表2所示。

表1 FA-OCMCS-SPIO-NPs各给药剂量组实验结果Tab 1Tests results of FA-OCMCS-SPIO-NPs groups of different doses

表2 OCMCS-SPIO-NPs各给药剂量组实验结果Tab 2Test results of OCMCS-SPIO-NPs groups of different doses
由于FA-OCMCS-SPIO-NPs组和OCMCS-SPIO-NPs组的小鼠均未出现死亡,依据新药临床前研究指导原则[7],2种纳米粒的LD50>434.5 mg(Fe)·kg-1,所有小鼠均未出现明显的毒性反应。14 d后处死小鼠,解剖并观察各组小鼠的心、肝、脾、肺、肾,与空白组相比均未发现明显的组织损伤,详见图1、图2。

图1 给予OCMCS-SPIO-NPs 14 d后各给药剂量组小鼠各组织照片Fig 1Pictures of each tissue in each group after mice are injected with OCMCS-SPIO-NPs with different doses for 14 days
3.2 抗吞噬性评价
各组小鼠肝、脾普鲁士蓝染色切片照片见图3、图4。

图2 给予FA-OCMCS-SPIO-NPs 14 d后各给药剂量组小鼠各组织照片Fig 2Pictures of each tissue in each group after mice are injected with FA-OCMCS-SPIO-NPs with different doses for 14 days
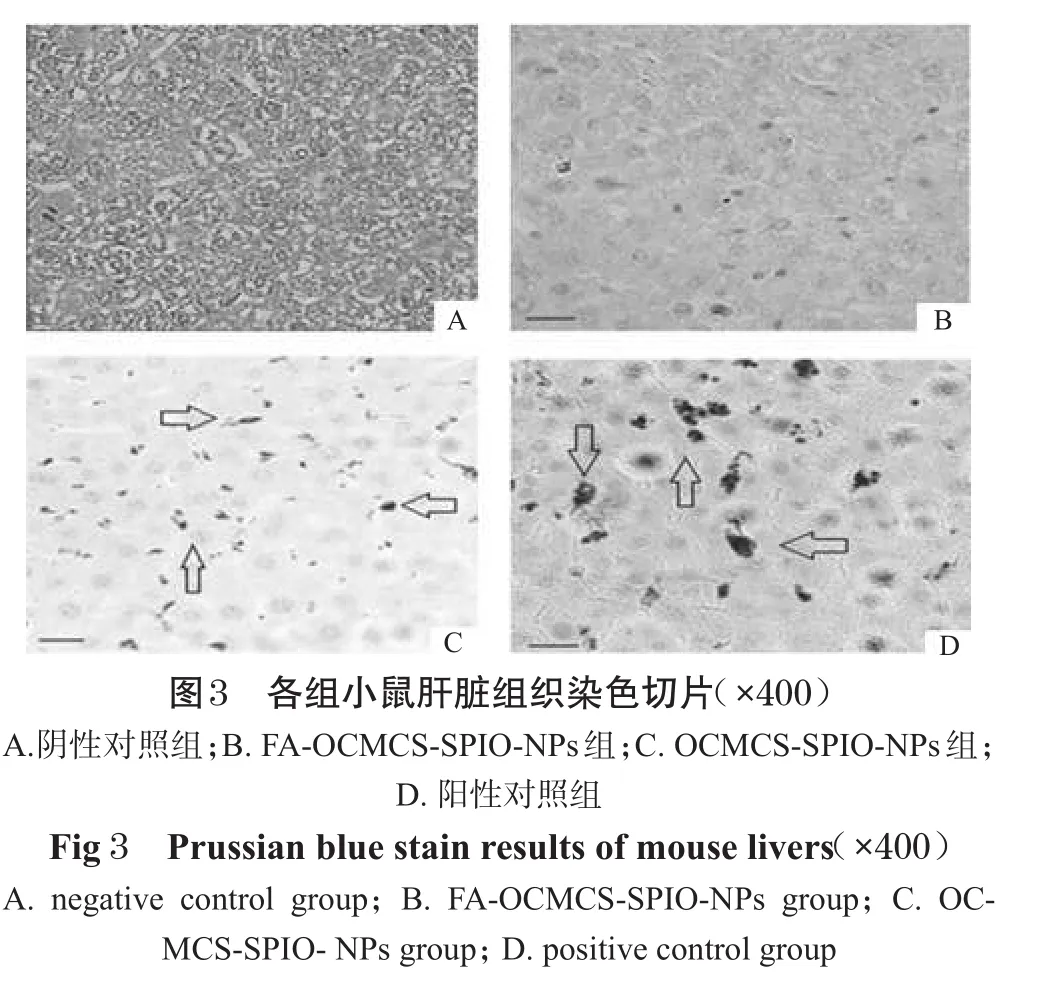

图3、图4中各组织切片照片上箭头所指的点是被染成蓝色的SPIO-NPs。从这些切片图上可以清晰地看到粒径大于100 nm的dextran-SPIO-NPs(图3D、图4D)无法逃避肝、脾中巨噬细胞的吞噬,而粒径小于50 nm的FA-OCMCS-SPIO-NPs能完全逃避吞噬,OCMCS-SPIO-NPs则大部分逃避了吞噬。
4 讨论
2种新型磁共振造影剂的急性毒性结果显示,在最大给药剂量下,小鼠均无明显的毒性反应,表明其具有良好的安全性。FA-OCMCS-SPIO-NPs高剂量组中,小鼠表现出轻微的食欲减退,可能是由于嫁接叶酸以后纳米粒的粒径有所变大,毒性有所增加,也有可能是残留溶剂二甲亚砜的影响。本实验中SPIO-NPs包被以亲水性材料羧甲基壳聚糖后,静脉给药剂量达434.5 mg(Fe)·kg-1时也没有明显的毒性反应,这可能是因为包被材料后,纳米粒对体内细胞结构的破坏性减小,降低了超顺磁氧化铁的毒性。
粒径小于100 nm的超顺磁氧化铁理论上可以逃避肝、脾的吞噬,达到全身分布的目的,这样就可能对全身除肝、脾部位的肿瘤、血管及肿瘤淋巴结转移进行造影,打破了传统的超顺磁氧化铁只针对肝脏造影的现状,具有重要的研究意义。通过实验可知,2种磁共振造影剂均能逃避巨噬细胞丰富的肝、脾组织的吞噬。虽然肝、脾对OCMCS-SPIO-NPs有轻微的吞噬,但与dextran-SPIO-NPs相比,吞噬量很少,这与笔者之前体外评价巨噬细胞对FA-OCMCS-SPIO-NPs和OCMCSSPIO-NPs的吞噬结果相吻合[2,8],这为今后考察二者的造影效果奠定了一定的基础。同时,二者又可以作为肿瘤靶向治疗的药物载体[9],故对其研究具有巨大的应用前景。
[1]Corot C,Robert P,Jean-Marc I,et al.Recent advances in iron oxide nanocrystal technology for medical imaging[J].Advanced Drug Delivery Reviews,2006,58(14):1471.
[2]Fan C,Gao W,Chen Z,et al.Tumor selectivity of stealth multi-functionalized superparamagnetic iron oxide nanoparticles[J].Int J Pharm,2011,404(1-2):180.
[3]范彩霞,高文慧,陈志良,等.超小的羧甲基壳聚糖超顺磁氧化铁纳米粒制备及处方优化[J].中国现代应用药学,2010,27(9):825.
[4]Mansouri S,Cuie Y,Winnik F,et al.Characterization of folate-chitosan-DNA nanoparticles for gene therapy[J].Biomaterials,2006,27(9):2060.
[5]Molday RS,MacKenzie D.Immunospecific ferromagnetic iron-dextran reagents for the labeling and magnetic separation of cells[J].J Immunol Methods,1982,52(3):353.
[6]王国斌,夏泽锋,陶凯雄,等.医用纳米级Fe3O4磁流体的急性毒理学实验研究[J].华中科技大学学报(医学版),2004,33(4):452.
[7]中华人民共和国卫生部药政局.新药(西药)临床前研究指导原则汇编(药学、药理学、毒理学)[S].1993:199.
[8]范彩霞,高文慧,陈志良,等.体外评价羧甲基壳聚糖超顺磁氧化铁纳米粒的细胞毒性和巨噬细胞摄取[J].华西药学杂志,2010,25(3):290.
[9]Sun C,Lee JS,Zhang M.Magnetic nanoparticle in MR imaging and drug delivery[J].Advanced Drug Delivery Reviews,2008,60(11):1252.

