硫化氢预处理延迟相对大鼠心肌缺血再灌注时谷胱甘肽S转移酶表达的影响
冉 珂,唐正国,丁丽萍,李双凤,常业恬
(1.中南大学湘雅二医院麻醉科,湖南长沙410011;2.长沙市第三医院麻醉科,湖南长沙410015)
硫化氢(H2S)是继一氧化氮(NO)和一氧化碳(CO)之后发现的第3个内源性气体信号分子,参与机体许多生理和病理过程的调节。有研究表明,H2S预处理延迟相对大鼠心肌缺血再灌注损伤有保护作用[1],但是其保护机制目前尚未完全阐明。谷胱甘肽S转移酶(GST)在体内具有抗氧化的作用,能催化细胞内的谷胱甘肽与多种亲电子底物结合,使体内代谢生成的氧化物失活,使细胞免受其细胞毒性作用。H2S预处理延迟相对心肌缺血再灌注损伤的保护作用是否与GST有关目前未见报道。因此,本研究拟探讨H2S预处理延迟相对大鼠心肌缺血再灌注时谷胱甘肽S转移酶表达的影响。
1 材料与方法
1.1 动物 健康成年Sprague-Dawley雄性大鼠40只,体重300~350 g,由湖南斯莱景达实验动物有限公司提供。
1.2 仪器设备 DH150呼吸机系浙江大学医学仪器厂生产;H-7500透射电子显微镜系日本日立公司产品;MD100-2电子分析天平系上海天平仪器厂生产;CH30光学显微镜系日本OLYMPUS公司产品;光学显微镜和摄影系统系德国CCD系统;全自动生化分析仪系美国BECKMAN公司产品;内切式匀浆机系中山大学中山医学院仪器厂产品;5415R型高速低温台式离心机系德国Eppendorf公司产品;721分光光度仪系上海第三分析仪器厂产品;恒温水浴箱系上海仪器厂产品;-70℃冰箱系日本松下公司产品;压力换能器系美国惠普公司产品;450 nm酶标仪为日本BIO-RAD Model 550型;电转印装置系美国Pharmcia Nova Blot公司产品;恒温震荡器为北京医疗设备厂生产;计算机图像分析系统系美国UVP uplang公司产品。
1.3 试剂 硫氢化钠(NaHS)、5-羟葵酸(5-HD)、伊文思蓝、氯化硝基四氮唑蓝、戊巴比妥钠均为美国Sigma公司产品,丙烯酰胺、无水乙醇、异丙醇、氯仿、二甲苯等均为国产试剂。
1.4 方法
1.4.1 缺血再灌注模型的制备 参考文献[2-3]方法制备兔缺血再灌注模型。
1.4.2 动物分组 将40只健康成年Sprague-Dawley雄性大鼠随机分成4组:假手术组(S组)、缺血再灌注组(IR组)、硫化氢组(H组)和硫化氢预处理延迟相+线粒体KATP通道阻断剂5-HD组(D组),每组10只。S组仅开胸并分离冠状动脉左前降支,但不阻断血流150 min;IR组行冠状动脉左前降支阻断30 min,再灌注120 min;H组静脉注射NaHS 0.05 mg/kg,给药后24 h同IR组处理,D组缺血前15min静脉注射5-HD 5 mg/kg,其它同H组处理。
1.5 心肌梗死面积测量 实验结束立刻重新阻断左冠前降支并从尾静脉注入1%伊文思蓝2 ml,充分染色后取出心脏。分离左心室(包括室间隔),滤纸吸干后将心脏放在-20℃冰箱10 min后取出,切片,每片厚约1~2 mm,血供正常心肌呈蓝染,缺血区心肌呈紫红或苍白,缺血心肌与正常心肌比值即为缺血危险区,将心肌置于37℃ 10%TTC中水浴15 min,氧化还原反应后存活心肌呈蓝色,梗死心肌呈苍白色,危险区心肌呈红色。4%甲醛固定24 h后,每个心脏切片进行数码照相,取左心室称重。左心室(left ventricle,LV)、缺血区(area at risk,AAR,非蓝色区)和心肌梗死区(infarct size,IS,灰色区)面积用Image-Pro Plus 5.0软件计算。梗死心肌重量计算:梗死心肌重量=(A1×W1)+(A2×W2)+(A3×W3)+(A4×W4)+(A5×W5)(A:梗死心肌面积占左心室面积的百分比;W:心脏切片的重量;1~5:心脏切片编号)。心肌缺血区重量按类似的方法计算;心肌缺血区范围用心肌缺血区重量占左心室重量百分比(AAR/LV×100)表示;心肌梗死范围用心肌梗死区重量占心肌缺血区重量百分比(IS/AAR×100)表示。
1.6 心肌组织病理学检查 再灌注结束后,分别取各组心尖区心肌组织1 mm×1 mm×1 mm在透射电镜下行超微结构检查。
1.7 心肌GST的测定 采用免疫印迹分析,在再灌注120 min结束即刻,取左心室前壁心肌组织提取蛋白,并于 -70℃储存备用。取100 μg心肌蛋白于12.5%聚丙烯酰胺凝胶进行电泳,分离的心肌蛋白随后通过电转印装置转印至PVDF膜,在封闭液中室温作用3 h。再加入GST抗体,4℃孵育过夜,用TTBS缓冲液冲洗15 min×4次后,加入二抗羊抗鼠IgG,室温摇动孵育1 h,再用TTBS缓冲液充分冲洗,最后进行增强化学发光反应。结果用GIS-700D型凝胶图像系统进行扫描分析,记录平均光密度值表示心肌GST的表达。
1.8 统计学处理 采用SPSS 13.0软件分析。所有数据采用均数±标准差(±s)表示,多组均数间比较采用LSD法,以P<0.05为差异有统计学意义。
2 结果
2.1 各组心肌超微结构变化 S组心肌细胞结构正常,排列整齐,线粒体形态正常;IR组心肌细胞水肿,心肌纤维排列模糊、紊乱,线粒体严重肿胀、空泡化;H组线粒体基质颗粒部分消失、嵴排列欠整体、少部分断裂,肌丝结构基本完整、排列欠清晰。与IR组相比,H组线粒体损伤程度明显减轻;D组与IR组的电镜图像差异不大(图1)。

图1 电镜下各组心肌细胞形态学改变Fig.1 Each group's pathological changes of cardiac cells under the electron microscopy
2.2 各组心肌梗死面积变化 除S组外,其余3组心肌缺血面积无明显差异(P>0.05);心梗面积与IR组比,H组明显降低(P<0.05),D组无明显差异(P>0.05),见表1和图2。
2.3 各组大鼠心肌GST的表达 与S组(34.8±4.2)比较,IR 组(94.2±5.4)、H 组(188.7±7.1)和 D组(92.5±6.8)表达均上升(P<0.05);与IR组比较,H组表达上升(P<0.05),D组表达无明显差异(P>0.05),见图3。
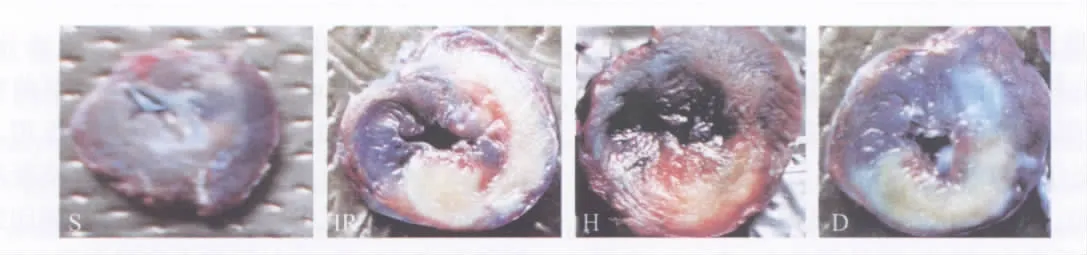
图2 大鼠左室心肌Evan's Blue与TTC染色后切片Fig.2 The slice of myocardium of the rat ventriculus sinister under staining of Evan's Blueand TTC
表1 各组心肌缺血面积及心梗面积的比较Table 1 The changes of infarct area and area at risk in each group(n=7,±s,%)
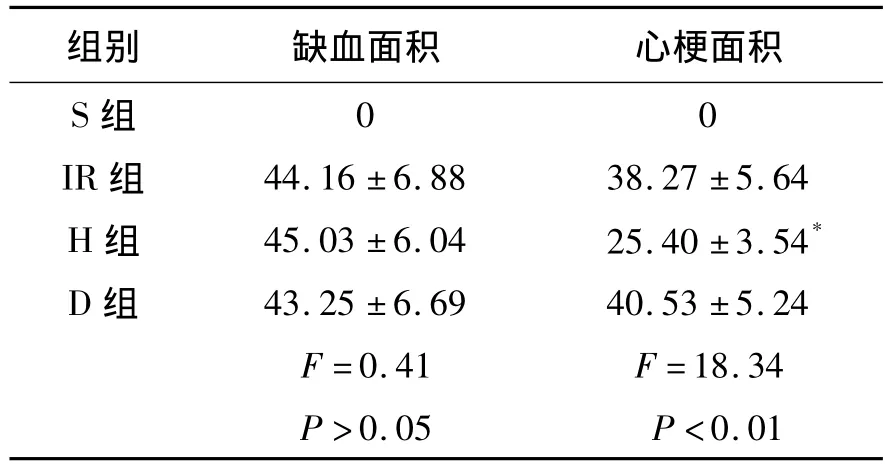
表1 各组心肌缺血面积及心梗面积的比较Table 1 The changes of infarct area and area at risk in each group(n=7,±s,%)
与IR组比,*P<0.05.
组别 缺血面积 心梗面积S组00 IR组 44.16±6.88 38.27±5.64 H组 45.03±6.04 25.40±3.54*D组 43.25±6.69 40.53±5.24 F=0.41 F=18.34 P>0.05 P <0.01
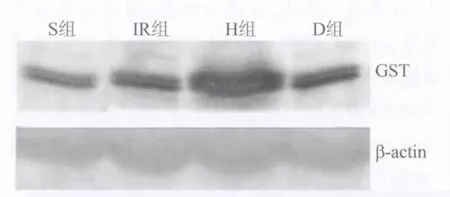
图3 各组大鼠心肌GST蛋白表达Fig.3 Western blot products of GST expression of each group
3 讨论
H2S在体内可能有两种存在形式:1/3以气体H2S形式,2/3可能以NaHS形式存在。NaHS在体内可解离成钠离子和硫氢根离子,后者与体内氢离子结合生成H2S,H2S与NaHS在体内形成一种动态平衡。NaHS溶液与内源性H2S体内的存在方式相似,是一种较理想的外源性硫化氢供体。Elrod等[4]在研究NaHS 5~50 μg/kg预处理延迟相早期相对心肌的保护机制中发现,以50μg/kg的NaHS保护作用最强,因此本实验采用IR前24 h给予NaHS 50 μg/kg预处理的方案。
心肌梗塞面积测量是国际公认的评价心肌缺血损伤的金指标,TTC染色法是公认的检测早期心肌细胞不可逆损伤的最可靠而灵敏的方法[5-6]。在本研究中,IR组和H组的缺血面积无显著性差异,表明LAD阻断效果肯定,各组LAD阻断部位基本一致。与IR组比,H组心梗面积明显降低,提示硫化氢预处理延迟相能显著减轻心肌损伤程度。
GST属于可溶性同工酶超基因家族,包括GSTA、GSTM、GSTT和GSTP等,同工酶能催化谷胱甘肽与多种亲电子底物结合。外源性异物在体内代谢生成高度活化的氧化物,产生细胞毒性,而GST可以催化这些代谢产物使之失活,使细胞免受其细胞毒性作用,因此GST在体内具有抗氧化作用。H2S是一种高反应性气体分子,很容易与气体化合物反应,特别是活性氧簇(ROS)、活性氮簇(RNS)。研究证实H2S可以与超氧阴离子(O2-)、过氧化氢(H2O2)、过氧亚硝酸盐(ONOO-)、次氯酸盐(CLO-)等活性氧、活性氮发生化学反应[7-10],从而阻止了由活性氧/活性氮介导的对细胞蛋白质和磷脂的氧化损伤。Rao 等[11]采用 水 飞蓟素(silymarin)干预心肌缺血再灌注损伤,发现GST在水飞蓟素预处理心肌中表达上调,认为可能通过促进GST等抗氧化还原酶的高表达和提高其活性而发挥心肌保护作用。Lyn等[12]采用基因组学技术研究缺血引起的心肌细胞基因的变化,发现在缺血后的心肌重塑过程中,同时伴随着GST基因的高表达。
本研究采用免疫印迹法检测心肌GST的表达,结果发现GST在硫化氢组心肌组织中显著增高,提示H2S预处理延迟相通过上调GST的表达来提高心肌抗氧化损伤的能力,从而发挥心肌延迟保护作用。
本研究中,选择性线粒体KATP通道阻断剂5-HD取消了H2S预处理延迟相对缺血再灌注心肌损伤的保护作用,提示线粒体KATP通道介导了H2S预处理对缺血再灌注心肌的保护作用。同时发现,5-HD取消了H2S预处理延迟相对心肌GST表达的影响,提示线粒体KATP通道介导了H2S预处理延迟相对心肌GST表达的影响。
总之,本研究结果提示H2S预处理延迟相对大鼠缺血再灌注心肌具有保护作用,这与上调心肌GST的表达有关。
[1]HU L F,PAN T T,NEO K L,et al.Cyclooxygenase-2 mediates the delayed cardioprotection induced by hydrogen sulfide preconditioning in isolated rat cardiomyocytes [J].Pflugers Arch,2008,455(6):971-978.
[2]RAN Ke,DUAN Kai-ming,ZOU Ding-quan,et al(冉 珂,段开明,邹定全,等).Effects of Isoflurane delayed preconditioning on nuclear factorкB during myocardial ischemia reperfusion injury in rabbit[J].Chin J Emerg Med(中华急诊医学杂志),2008,17(8):834-837.(in Chinese)
[3]GONG Zi-xi,RAN Ke,CHANG Ye-tian,et al(龚子曦,冉 珂,常业恬,等).Effect of morph ine postconditioning on myocardial ischemia-reperfusion injury in rabbits [J].JournalofZhejiang University:Medical Science(浙江大学学报:医学版),2009,38(5):521-524.(in Chinese)
[4]ELROD J W,CALVERT J W,MORRISON J,et al.Hydrogen sulfide attenuates myocardial ischemiareperfusion injury by preservation of mitochondrial function [J].Proc Natl Acad Sci,2007,104(39):15560-15565.
[5]PRZYLENK K,LI G,WHITTAKER P.No loss in the in vivo efficacy of ischemic preconditioning in middle-aged and old rabbits [J].J Am Coll Cardiol,2001,38(6):1741-1747.
[6]COHEN M V.Efficacy of preconditioning should be gauged by reduction of infarction [J].Br J Pharmacol,2004,141(2):197-198.
[7]MITSUHASHI H,YAMASHITA S,IKEUCHI H,et al.Oxidative stress-dependent conversion of hydrogen sulfide to sulfite by activated neutrophils[J].Shock,2005,24(6):529-534.
[8]GENG B,CHANG L,PAN C,et al.Endogenous hydrogen sulfide regulation of myocardial injury induced by isoproterenol[J].Biochem Biophys Res Commun,2004,318(3):756-763.
[9]WHITEMAN M,ARMSTRONG J S,CHU S H,et al.The novel neuromodulator hydrogen sulfide:an endogenous peroxynitrite scavenger [J].J Neuroehem,2004,90(3):765-768.
[10]WHITEMAN M,CHEUNG N S,ZHU Y Z,et al.Hydrogen sulphide:a novel inhibitor of hypochlorous acid-mediated oxidative damage in the brain[J].Biochem BioPhys Res Commun,2005,326(4):794-798.
[11]RAO P R,VISWANATH R K.Cardioprotective activity of silymarin in ischemia-reperfusioninduced myocardial infarction in albino rats[J].Exp Clin Cardiol,2007,12(4):179-187.
[12]LYN D,LIU X,BENNETT N A,et al.Gene expression profilein mouse myocardium after ischemia[J].Physiol Genomics,2000,27(3):93-100.

