二苯乙烯苷对H2O2诱导PC12细胞损伤的抗氧化作用
王 婷 熊章鄂(三峡大学医学院药理学教研室,湖北 宜昌 443002)
ROS介导的病理损伤与多种年龄相关的神经系统疾病的发病机制密切相关。在伴有轻度认知能力损伤、阿尔茨海默病和血管性痴呆的患者中都可观察到脂质过氧化产物的升高和抗氧化物水平的降低〔1,2〕。二苯乙烯苷(TSG)是从抗衰老中药蓼科植物何首乌的干燥块根中提取分离得到的一种多酚结构的水溶性、何首乌的主要有效成分〔3〕。研究表明,TSG具有抗氧化和清除自由基的作用〔4〕。嗜铬细胞瘤细胞系(PC12)细胞是来自大鼠肾上腺髓质嗜铬细胞瘤的克隆细胞系,作为细胞模型已被广泛应用于神经退行性疾病的研究。本研究采用H2O2损伤的体外培养模型,观察TSG对H2O2诱导PC12神经细胞系氧化损伤的保护作用,为其应用于神经退行性疾病的治疗提供有力的实验依据。
1 材料与方法
1.1 药品与试剂 TSG(C20H22O9),分子量:406,纯度大于98%,购自中国药品生物制品检定所。DMEM/F12培养基,胎牛血清(FBS),胰酶购自Gibco公司。MTT,DCFH-DA购自Molecular Probes公司。超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和丙二醛(MDA)试剂盒购自南京建成生物工程研究所。其余试剂均为国产市售分析纯。
1.2 方法
1.2.1 PC12细胞培养 PC12细胞由华中科技大学同济医学院药理系陈建国教授惠赠,本实验室传代保种。使用含10%FBS、100 U/ml青霉素、100 μg/ml链霉素的 DMEM/F12 完全培养基,在37℃,95%O2和5%CO2培养箱中进行培养,每3天全量更换一次培养基,待细胞铺满培养瓶底80%以上时,按1∶4的比例将细胞传代至多聚赖氨酸的培养瓶或培养板上,以备实验用。
1.2.2 MTT法测定细胞存活率 细胞按合适的密度接种于96孔板,随机分为:正常对照组、H2O2处理组和 TSG(0.1,1,10,50 μmol/L)组。加入不同浓度的TSG预孵育细胞12 h后,再加入120 μmol/L H2O2诱导细胞24 h,进行MTT实验。在避光条件下,每孔加入MTT 0.5 mg/ml,继续培养4 h,弃上清后每孔加DMSO 100 μl,振荡10 min,于酶标仪上测波长为490 nm时的吸光度值(A)。A值为活细胞将MTT还原为蓝色结晶物formazan的光吸收值,在一定细胞数范围内与活细胞数成正比,间接反映活细胞数。各组细胞存活率(%)=(试验组A值/对照组A值)×100%,从而得出各组细胞存活率。
1.2.3 细胞内ROS水平测定 细胞按合适的密度接种于96孔板,分组及处理同上。去除细胞培养液,加入适当体积稀释好的DCFH-DA,使其终浓度为10 μmol/L,37℃培养箱内孵育20 min,用无血清细胞培养液洗涤细胞三次,以充分去除未进入细胞内的DCFH-DA。DCF的荧光强度用Cytofluor2350荧光酶标仪检测,激发波长为488 nm,发射波长525 nm,DCFH的荧光代表了细胞内的ROS水平。
1.2.4 细胞内SOD、GSH-Px活性及MDA含量的测定 胰酶消化收集细胞后用超声裂解细胞,获取细胞匀浆。SOD活性测定依据黄嘌呤氧化酶法的原理,GSH-Px的活性测定根据Mill's法,MDA含量的检测依据硫代巴比妥酸(TBA)法。
1.3 统计学分析 应用SPSS13.0统计软件,数据用x± s表示,多组间显著性比较用单因素方差分析(ANOVA)结合Duncan's检验法。
2 结果
2.1 TSG抑制 H2O2诱导的 PC12细胞损伤 120 μmol/L H2O2作用24 h后,PC12细胞的存活率(0.36±0.05)降低到正常对照组的〔0.67±0.04,(54±6)%〕。TSG(0.1,1,10,50 μmol/L)预处理细胞12 h能够浓度依赖性的降低H2O2诱导的PC12细胞损伤,其存活率分别为0.37±0.02,0.43±0.03,0.51 ±0.06,0.55 ±0.03。
2.2 TSG降低H2O2引起的细胞内ROS水平增高 H2O2处理PC12细胞24 h后,细胞内DCF荧光明显增强(6 182±392),为正常对照组(3 454±321)的180% ±10%,提示细胞内ROS 水平增高。不同浓度的 TSG(0.1,1,10,50 μmol/L)预孵育细胞12 h后,再用120 μmol/L H2O2诱导细胞,能够剂量依赖性的拮抗H2O2引起的细胞内DCF荧光增高。其ROS的DCF荧光强度分别为6 148±241,5 320±274,4 870±310及4 697±238。
2.3 TSG对PC12细胞内抗氧化酶活性的影响 H2O2处理PC12细胞24 h后,细胞内SOD和GSH-Px的活性减少。TSG预处理12 h可以明显对抗H2O2诱导的抗氧化损伤作用。见表1。
表1 TSG对PC12细胞内脂质过氧化产物含量的影响(,n=6)
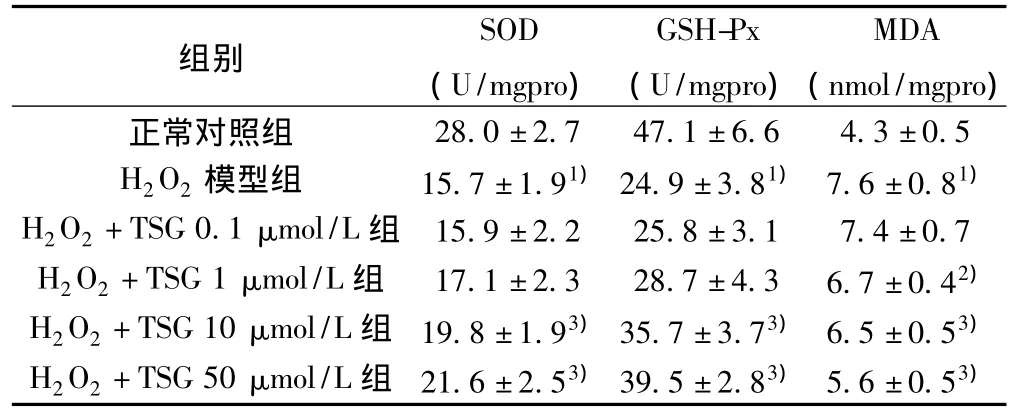
表1 TSG对PC12细胞内脂质过氧化产物含量的影响(,n=6)
与正常对照组比较:1)P<0.01;与模型组比较:2)P<0.05,3)P<0.01
组别SOD(U/mgpro)GSH-Px(U/mgpro)MDA(nmol/mgpro)28.0±2.7 47.1±6.6 4.3±0.5 H2O2模型组 15.7±1.91)24.9±3.81) 7.6±0.81)H2O2+TSG 0.1 μmol/L组 15.9±2.2 25.8±3.1 7.4±0.7 H2O2+TSG 1 μmol/L组 17.1±2.3 28.7±4.3 6.7±0.42)H2O2+TSG 10 μmol/L组 19.8±1.93)35.7±3.73) 6.5±0.53)H2O2+TSG 50 μmol/L组 21.6±2.53)39.5±2.83) 5.6±0.53)正常对照组
2.4 TSG对PC12细胞内脂质过氧化产物含量的影响 H2O2处理PC12细胞24 h后,使细胞脂质过氧化产物MDA的含量增加,不同浓度的TSG预处理细胞后可逆转H2O2所致细胞脂质过氧化产物MDA的含量增加。见表1。
3 讨论
氧化应激是细胞氧化-抗氧化失衡而导致的应激损伤状态。当ROS的生成增加而其清除减少或者对氧化修饰的大分子修复减少时,氧化应激就会发生。ROS的过度产生可以导致一系列的细胞功能损伤。氧化应激对神经元的损伤主要表现在以下几个方面;细胞膜发生脂质过氧化反应,膜磷脂被破坏降解;细胞膜对钠、钙及大分子物质通透性增加,神经元发生细胞毒性水肿〔5〕;线粒体破坏,功能丧失〔6〕。攻击细胞内的 RNA和DNA,影响细胞的基因转录和蛋白表达过程〔7〕。
H2O2是一种膜通透性的ROS,是研究氧化应激的理想模型。本研究采用H2O2损伤的体外细胞培养模型研究了TSG的细胞保护作用。实验结果表明,从何首乌中提取的单体成分TSG能提高H2O2诱导的PC12细胞的存活率,减轻细胞损伤。同时,减轻细胞内ROS累积,增强抗氧化酶SOD和GSH-Px的酶活性,降低细胞内脂质过氧化产物MDA的含量。因此推测,TSG对H2O2诱导的PC12细胞的保护作用部分是通过抑制胞内氧化应激反应来实现的。
1 Butterfield DA,Sultana R.Redox proteomics identification of oxidatively modified brain proteins in Alzheimer's disease and mild cognitive impairment:insights into the progression of this dementing disorder〔J〕.J Alzheimers Dis,2007;12(1):61-72.
2 Casado A,Encarnación López-Fernández M,Concepción Casado M,et al.Lipid peroxidation and antioxidant enzyme activities in vascular and Alzheimer dementias〔J〕.Neurochem Res,2008;33(3):450-8.
3 刘治军,张 丽,李 林.中药何首乌的药理作用研究进展〔J〕.中华名医论坛,2004;5(1):94-6.
4 Ryu G,Ju JH,Park YJ,et al.The radical scavenging effects of stilbene glucosides from Polygonum multiflorum〔J〕.Arch Pharm Res,2002;25(5):636-9.
5 Gibson GE,Karuppagounder SS,Shi Q.Oxidant-induced changes in mitochondria and calcium dynamics in the pathophysiology of Alzheimer's disease〔J〕.Ann N Y Acad Sci,2008;1147:221-32.
6 Naoi M,Maruyama W,Yi H,et al.Mitochondria in neurodegenerative disorders:regulation of the redox state and death signaling leading to neuronal death and surviva〔lJ〕.J Neural Transm,2009;116(11):1371-81.
7 Rao KS.Free radical induced oxidative damage to DNA:relation to brain aging and neurological disorders〔J〕.Indian J Biochem Biophys,2009;46(1):9-15.

